流行病學
Alport綜合徵並非罕見,現已報導約100人家系其是導致終末性腎臟病的原因之一。Waldherr統計此病約占其腎活檢病例的1%,在歐洲透析與移植病例中此病約為3%。
病因
 遺傳性腎炎
遺傳性腎炎1.性連鎖顯性遺傳(sex-linked dominant inheritance) 為本病主要遺傳方式。由於致病基因在X染色體上故遺傳與性別有關。母病傳子也傳女,子女得病機會均等,為50%。父病不傳子,卻傳全部女兒。如此,家系中女性患者多於男性患者但病情男重於女,因為女性還有一條正常的同源染色體(雜合子),而男性卻無(半合子)。
20世紀80年代中後期一些學者開始該致病基因定位探索一致發現定位於X染色體長臂中段(Xq22)。但是,這是什麼基因突變當時並不清楚直至1990年Myers等才證實這突變基因是膠原Ⅳα鏈亞單位α5(Ⅳ)的基因,即COL4A5但是,1993年Zhou等又在此Xq22部位上發現了膠原Ⅳα鏈亞單位α6(Ⅳ)的基因CoL4A6,並證實COL4A6突變亦可導致本病。
2.常染色體顯性遺傳(autosomal dominant inheritance) 1/7~1/3家系按此方式遺傳。由於致病基因在常染色體上,故遺傳與性別無關。患病父或母親的兒女得病機會相同,均約一半,父病能傳子。患者病情輕重與性別無關,男、女病情嚴重度相似。
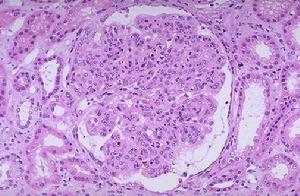 遺傳性腎炎
遺傳性腎炎在發現本病性連鎖顯性遺傳患者的致病基因定位後,人們一直在探索該遺傳方式患者的致病基因定位。已知膠原Ⅳα鏈其他4個亞單位的基因均在常染色體上:α1(Ⅳ)及α2(Ⅳ)的基因COL4A1及COL4A2定位於染色體13;α3(Ⅳ)及α4(Ⅳ)的基因COL4A3及COL4A4定位於染色體2。是哪一個或哪一些基因突變致成本病發病?直至最近才證實是染色體2上的COL4A3及COL4A4。
3.常染色體隱性遺傳(autosomal recessive inheritance) 1981年後本病才有此遺傳方式的報導,現已受公認但如此遺傳的家系畢竟很少。該致病基因雖也在常染色體上,但雜合子的表現型正常惟純合子才顯出疾病故具有臨床症狀的患者常為近親婚配的子女(父母皆為致病基因攜帶者,則其子女患病機會為1/4成為表現型正常的致病基因攜帶者機會為1/2)。該致病基因在染色體上的定位亦於最近查明,亦為染色體2上的COL4A3及COL4A4。
在本病的遺傳上還常見下列現象:在某些顯性遺傳家系中,存在有本身不表現疾病卻能傳病給子代的致病基因攜帶者,這些致病基因攜帶者的產生與雜合子不全外顯率有關,多見於女性另外在顯性遺傳家系中雖然多數患者腎、耳眼病變並存,但卻有少數患者僅有腎炎或耳聾,造成疾病表現不一致,這種疾病表現的多樣性與致病基因表現度(expressivity)不同相關。僅表現為腎炎或耳聾患者的子代又可能因致病基因表現度改變重新使腎耳、眼病變一併呈現。最後少數患者疾病非遺傳而來,系由基因突變引起文獻記載,在本病中這類患者占全部患者的15%~18%。
發病機制
 遺傳性腎炎
遺傳性腎炎膠原Ⅳ分子由3條α(Ⅳ)肽鏈組成,為三股螺鏇結構除中央螺鏇區外,其氨基端為TS區,羧基端為終端膨大的非膠原NC1區。四個膠原Ⅳ分子的氨基端相連,兩個膠原Ⅳ分子的羧基端相接,如此構成網狀,形成基膜的支架。
構成膠原Ⅳ分子的α鏈亞單位原已知5種,即α1(Ⅳ)至α5(Ⅳ),近年又發現第6種α6(Ⅳ)其中α1(Ⅳ)、α3(Ⅳ)及α5(Ⅳ)的胺基酸序列相似而α2(Ⅳ)、α4(Ⅳ)及α6(Ⅳ)的胺基酸序列相似可分成兩類由α1(Ⅳ)及α2(Ⅳ)構成經典的膠原Ⅳ分子而由α3(Ⅳ)至α6(Ⅳ)構成膠原Ⅳ分子的同種型(isoforms)。已知α1(Ⅳ)及α2(Ⅳ)肽鏈廣泛分布於各種基底膜中而α3(Ⅳ)、α4(Ⅳ)及α5(Ⅳ)肽鏈僅呈有限的組織分布,主要分布於GBM、前晶狀體膜及視網膜(內耳基底膜因檢查困難而尚未研究),即本病的主要病變部位。α6(Ⅳ)肽鏈的組織分布尚未完全了解,初步資料顯示它也為有限分布所以可以推論本病基底膜中變異的膠原Ⅳα鏈應在α3(Ⅳ)至α6(Ⅳ)中。
前文已敘,本病中COL4A3至COL4A6的基因突變均已獲證實。此中對COL4A5的突變形式研究最詳,已報導有點突變、並接突變、缺失、以及插入、重複與缺失複合存在,或重複與倒位複合存在的複雜基因重排等。曾經有人推論基因突變導致酶病,酶的異常使膠原Ⅳ分子合成障礙或分解增速而導致基底膜病,但至今未獲酶病證據,此假說無法成立。現在認為,基因疾病可直接導致膠原Ⅳ異常,因為發生了突變的DNA可在轉錄翻譯、翻譯後對肽鏈修飾和肽鏈組成膠原Ⅳ的各個環節上發揮致病作用。
前文也已敘述,本病患者的病變GBM缺乏Goodpasture綜合徵抗原,現已知該抗原為α3(Ⅳ)肽鏈的NC1區。在本病常染色體顯性或隱性遺傳患者中,有突變的COL4A3基因,從而導致α3(Ⅳ)肽鏈異常,使Goodpasture綜合徵抗原缺如這很容易理解。但是,在本病性連鎖顯性遺傳患者中,COL4A5基因突變如何導致Goodpasture綜合徵抗原缺如有人作了多種推測認為最大的可能性是COL4A6突變後生成變異α5(Ⅳ)肽鏈破壞了成熟膠原Ⅳ的穩定結構,使α3(Ⅳ)肽鏈不能進入此膠原Ⅳ分子,或者迅速從膠原Ⅳ中移出,故導致GBM中α3(Ⅳ)缺如。這解釋是否合理尚需驗證。Reeders於1992年作此解釋時,COL4A6及COL4A4基因突變尚未發現,此兩基因突變又如何導致Goodpasture綜合徵抗原缺如目前尚未見解釋。本病發病機制可能有如下幾點:
1.分子生物學 Ⅳ型膠原是基底膜的主要膠原組分單個Ⅳ型膠原蛋白鏈進入細胞後形成三螺鏇分子然後分泌出細胞,進入胞外基質。在哺乳動物基底膜至少包含5種遺傳學上不同的Ⅳ型膠原分子。與其他的膠原蛋白相同,前膠原蛋白Ⅳ鏈由一個主要的膠原區和一個羧基末端的非膠原區組成。膠原區含有甘氨酸-X-Y的三聯體重複序列,X和Y代表各種其他胺基酸。Ⅳ型膠原分子三螺鏇的形成是從在相關鏈的羧基末端非膠原區形成二硫鍵開始的。將這些鏈摺疊成三螺鏇結構並向氨基末端進行,這個過程類似於拉上拉鏈。Ⅳ型膠原與間質膠原蛋白在兩方面有重要的不同,這些特性影響了它所能形成的大分子結構。首先,間質膠原蛋白從細胞內分泌後失去了其羧基末端的非膠原區,而Ⅳ型膠原蛋白三螺鏇仍保留其羧基末端區。其次,Ⅳ型膠原蛋白鏈間隔有大量甘氨酸-X-Y重複序列這樣就增加了三螺鏇的彈性。Ⅳ型膠原三螺鏇通過分子間不同類型的連線方式形成網狀結構:
(1)末端對末端連線:即2個Ⅳ型膠原三螺鏇的羧基末端相連線。
(2)4個三螺鏇在其氨基末端產生共價作用。
(3)側連線:即一條三螺鏇的羧基末端連線在另一條三螺鏇的膠原區上。這些相互作用形成了有彈性的、非原纖維的多邊的支架。已經克隆出6個編碼Ⅳ型膠原的基因,分別編碼α1(Ⅳ)及α2(Ⅳ),其鏈的COL4A1及COL4A2的基因位於13號染色體上;編碼α3(Ⅳ)及α4(Ⅳ)鏈的基因COL4A3及COL4A4位於2號染色體上;編碼α5(Ⅳ)和α6(Ⅳ)鏈的基因COL4A5和COL4A6位於X染色體的長臂上;COL4A1和COL4A2COL4A3和COL4A4、COL4A5和COL4A6分別頭對頭排列,共用一個雙向的啟動子。這些基因有相似之處,每個基因都有約50個外顯子,由基因3′端的幾個外顯子連線於編碼的羧基末端區編碼羧基末端序列的不同導致了抗原特異性、分子大小和電荷的異質性等特點。
Habib等和DiBona發現奧爾波特綜合徵的基底膜羥脯氨酸含量比對照組減少,但基底膜羥脯氨酸含量的減少也是許多非奧爾波特綜合徵腎臟疾病進展期的特徵。Tina等發現奧爾波特綜合徵患者尿中排出羥賴氨酸糖苷增多,這意味著膠原的分解加強,但Schroeder等卻發現奧爾波特綜合徵患者與其他小球疾病患者尿中排出的羥賴氨酸糖苷無差別
Kleppel等報導奧爾波特綜合徵男性患者的腎小球基底膜缺少Ⅳ型膠原蛋白的α3和α4鏈,後來證明這些鏈的缺乏是由於編碼α5(Ⅳ)鏈的COL4A5基因突變所致直接和間接證據表明α3(Ⅳ)、α4(Ⅳ)和α5(Ⅳ)鏈在構成腎小球基底膜和其他基底膜時的特殊關係這些鏈同時分布在胎兒和成人的腎臟、眼耳蝸和脈絡膜叢的基底膜中,由此可以解釋本綜合徵可同時存在眼、耳異常。
α3(Ⅳ)和α4(Ⅳ)鏈只有與α5(Ⅳ)鏈一起才能構成三螺鏇因此COL4A5基因突變阻止了這些鏈構成腎小球基底膜。目前猜想有兩種編碼α5(Ⅳ)鏈的COL4A5基因的突變類型阻止了α3(Ⅳ)和α4(Ⅳ)鏈構成基底膜。任何影響α5(Ⅳ)鏈羧基末端區的突變都能阻止其與α3(Ⅳ)和α4(Ⅳ)鏈的連線,從而阻止三螺鏇的形成。改變α5(Ⅳ)膠原區甘氨酸殘基的突變可妨礙正常摺疊成三螺鏇,從而導致所有鏈的降解(前膠原自殺)。用基因工程的方法培養COL4A5突變細胞或轉基因動物的方法可以證實這種假說。
2.腎損害進展的機制
對於COL4A5通過什麼途徑最終導致腎功能衰竭尚不清楚。儘管奧爾波特綜合徵的男性在出生時腎小球基底膜即缺乏α3(Ⅳ)、α4(Ⅳ)、α5(Ⅳ)鏈,但許多年後才出現明顯的腎小球濾過和選擇性通透性異常在組織學水平,從奧爾波綜合徵男性幼兒的腎小球基底膜變薄到成年男性的瀰漫性腎小球基底膜增厚和分層,需要相當長的一段時間,這與腎小球濾過和選擇性通透性改變的自然病程是平行的。因此,需要研究在此過程中基底膜的分子組成發生了什麼變化、本病腎小球硬化的過程在哪些方面是獨特的、哪些方面與非奧爾波特綜合徵的腎小球改變是相似的等等問題。
α1(Ⅳ)和α2(Ⅳ)鏈常出現在系膜和腎小球基底膜的內皮下區。在糖尿病腎病和膜增生性腎小球腎炎的病程中,這些鏈從腎小球基底膜中消失,但仍在增寬的系膜中存在。在奧爾波特綜合徵,α1(Ⅳ)和α2(Ⅳ)鏈的分布沒有這樣的變化,這些鏈在整個腎小球基底膜都存在膠原蛋白Ⅴ和Ⅵ在正常時也只分布在系膜和內皮下的基底膜,而在奧爾波特綜合徵時則分布在腎小球基底膜的全層,並隨著腎小球的硬化而積累,但在糖尿病腎病和膜增殖性腎小球腎炎時從腎小球基底膜中消失。在奧爾波特綜合徵腎小球其他基質成分如層黏素的A鏈和B鏈硫酸肝素nidogen和蛋白糖苷的分布也不正常。
Melvin等觀察到奧爾波特綜合徵男性患者腎小球基底膜中澱粉樣蛋白P缺失這種物質是腎小球基底膜、系膜和血管壁的正常糖蛋白組分儘管已知澱粉樣蛋白P能與Ⅳ型膠原蛋白羧基末端非膠原區結合,但其在體內腎小球基底膜上的配體仍未鑑定出來。
尚不清楚這些腎小球基底膜成分的異常是否有功能學上的重要性但可以肯定COL4A5基因的突變在某些方面改變了某些基底膜成分的生物合成和分泌。
臨床表現
 遺傳性腎炎
遺傳性腎炎本病男性患者常會最終發生蛋白尿。開始時只是微量蛋白尿,尿蛋白隨著年齡的增長逐漸增加,常發展至腎病綜合徵。高血壓發生率和嚴重程度也隨著年齡的增長而增長。儘管該綜合徵在10歲前可發展至腎功能衰竭但多數患者在20~50歲發展至終末期腎臟病。男性患者預後差,所有男性患者都會發展到終末期腎臟病發展的速度表現出顯著的家族間的變異。一些學者觀察到在同一家族內發展至腎功能衰竭的速率相當固定。這種表型的異質性過去被認為是反映了與特別基因的相關性或受到環境因素的影響,現在多數認為是繼發於X染色體上單一位點上突變的等位基因的異質性同一家族內男性患者發展至腎功能衰竭的速度變異偶有報導
家族中的女性患者預後良好多數生存年紀較大,且僅有較輕腎臟病表現Grunfeld等發現兒童期肉眼血尿、腎病綜合徵和電子顯微鏡下瀰漫性腎小球基底膜增厚是提示女性患者腎炎進展的特徵感覺神經性耳聾和晶體受損也提示預後不良。表現為進展性腎炎的女性患者直到晚年(50~75歲)仍保持有足夠的腎功能。懷孕對輕微病變患者腎臟功能無顯著影響,但可能使較嚴重患者腎功能加速惡化。
2.聽力缺失 奧爾波特綜合徵患者聽力喪失不是先天性的而是常在15歲左右在男性患者發生。在患奧爾波特綜合徵家族的成員中,聽力的損害往往伴隨著腎臟損害。耳聾但不伴腎臟疾病的男性不會將奧爾波特綜合徵傳遞給子代。在早期聽力缺失只有用聽力測試可發現。聽力雙側減少至2000~8000Hz範圍。男性患者聽力的缺失是進展性的,最終將波及其他頻率,包括發聲的頻率。在女性患者聽力缺失較少且傾向於較大年齡發生。女性患者如有進行性的聽力喪失預示腎臟病結局不良。
本病聽覺損傷的部位是耳蝸前庭功能亦可被損害,但無臨床意義。
有報導一些奧爾波特綜合徵患者腎移植後聽力好轉而另一些患者腎移植後聽力無改變甚至惡化。尿毒症本身可使聽力惡化。文獻表明腎移植後聽力好轉的奧爾波特綜合徵患者都合併有其他疾病。
3.眼缺陷 眼缺陷儘管不如耳聾那么普遍,但也很常見,發生率為15%~30%。前圓錐晶狀體(即晶狀體的中心部分形成圓錐狀突起前囊)實質上是奧爾波特綜合徵的特徵性病變。Nielson發現所有有圓錐狀晶體的患者經仔細檢查後都能獲得慢性腎炎和感覺神經性耳聾的證據。Atkin等觀察到前圓錐狀晶體限於那些快速進展至終末期腎病和耳聾的奧爾波特綜合徵家族。用斜照明法,可見前圓錐狀晶體似乎是晶體表面中央部分呈圓錐狀或球狀突入前房,突起物的基底為圓形直徑為2.5~4mm。前圓錐狀晶體在患者剛出生時一般沒有通常在20~30歲出現。可出現進展性晶體變形伴不斷加深的近視。在出現圓錐狀晶體的同時可出現晶體混濁偶爾是由前晶體囊破裂引起。光鏡和電子顯微鏡顯示圓錐狀晶體區的前晶體囊顯著變薄Streeten等在圓錐狀晶體的前晶體囊中觀察到許多垂直方向的斷裂。
在奧爾波特綜合徵患者也可有許多其他的眼損害。最常見的是黃斑區色素的改變,在中央凹周圍有黃色或白色的顆粒形成。一些患者,尤其是兒童,觀察到的惟一異常可能是中央凹反射消失。而在其他患者中可有角膜內皮囊泡,且相當多見,提示角膜後彈性層異常。這些損害常和前圓錐狀晶體並存但也可不伴圓錐狀晶體。Govan認為這些損害定位於支持視色素上皮的基底膜,並與腎小球基底膜在膠原組分上是相似的,因此推斷腎臟和眼部的異常是由於突變造成了基底膜組分的改變。
4.血小板缺陷 1922年,Epstein等報導了的兩個遺傳性腎炎和耳聾的家族同時伴有巨血小板病,患者常在早年就表現出出血傾向,多被診斷為特發性血小板減少性紫癜,繼而發生血尿、蛋白尿和感覺神經性耳聾腎病呈進展性光鏡下特點與奧爾波特綜合徵相符。在Parsa等報導的家族中,為父向子的傳遞呈常染色體顯性遺傳。另有3個患者無陽性家族史,可能是由於新發生的突變所致。其中兩篇報導中患者有腎活檢表現為局灶性腎小球基底膜增厚和分層。
5.瀰漫性平滑肌瘤病 據報導一些患奧爾波特綜合徵的家族同時伴有上消化道和氣管支氣管樹的平滑肌瘤病。在這些家族中,一些女性患者表現為典型的生殖器平滑肌瘤、陰蒂肥大以及陰唇和子宮的不同改變這些家族中的患者常發生後囊下型、雙側型白內障。
併發症
遺傳性腎炎家族中,患者常並發許多非特異性病變,如甲狀腺疾病IgA缺乏、球後視神經炎、升主動脈瘤、肛門直腸畸形、精神病和纖維肌性發育不良等。
診斷
 食療
食療在臨床-病理診斷上標準並未統一。綜合各家意見,我們認為以下幾方面為診斷要點:
1.陽性家族史,遺傳方式絕大多數為性連鎖顯性遺傳其次為常染色體顯性遺傳,極少數為常染色體隱性遺傳。
2.臨床上呈現腎病變(血尿及進行性腎功能損害)、耳病變(高頻性神經性耳聾)及眼病變(前球形晶體及黃斑區中心凹周圍微粒)。
3.腎組織電鏡病理檢查見GBM廣泛變厚破裂,並與變薄的GBM並存。
4.抗膠原ⅣNC1抗體作免疫螢光檢查,表皮基底膜及GBM均不著色(男性)或僅節段淺染(女性)。
Flinter等將陽性家族史、腎病變(包括電鏡下GBM典型改變)耳及眼病變列為4條,認為具備其中3條即能診斷本病。但是,該診斷標準的缺點是若本病患者僅呈腎病變,而無特徵性耳聾及眼疾時容易漏診。
鑑別診斷
 遺傳性腎炎
遺傳性腎炎1.家族性良性薄基底膜病(家族性良性血尿) 家族性良性薄基底膜病為常染色體顯性遺傳。臨床特點為反覆發作肉眼血尿,非進行性疾病,預後良好,不發生腎功能衰竭,無耳、眼疾患。腎活檢光鏡下正常,免疫螢光陰性電鏡下GBM瀰漫變薄
儘管瀰漫性基底膜變薄被認為是良性家族性血尿的標誌,但有一些瀰漫性基底膜變薄的患者是有進行性腎功能衰竭家族史的。瀰漫性腎小球基底膜變薄可能是一種奧爾波特綜合徵的頓挫型或是腎小球基底膜改變的早期階段。患奧爾波特綜合徵的幼年兒童和成年女性常常表現為基底膜變薄,而年老的患者往往表現為明顯的基底膜增厚和花籃狀。Rumpelt發現腎小球基底膜在男性患者隨著年齡的增加而花籃狀程度加深,而在女性患者則仍保持薄基底膜狀態換言之,腎小球基底膜變薄不一定預示是良性的薄基底膜病,僅僅發現腎小球基底膜變薄可能會引致錯誤的臨床病理結論。因此,當在腎活檢標本發現緻密層變薄時,仔細詢問患者家族史,繼而檢查有無蛋白尿、聽力障礙眼科學異常,以鑑別奧爾波特綜合徵和薄基底膜病。但感覺神經性耳聾對奧爾特綜合徵的診斷並非必需。
2.慢性腎小球腎炎 臨床表現可與奧爾波特(Alport)綜合徵相似,但無明顯家族史和耳、眼異常,腎活檢可鑑別。
3.慢性小管間質腎炎 由於奧爾波特(Alport)綜合徵患者腎活檢時光鏡的主要病理表現是廣泛的間質炎症和纖維化需要和各種慢性小管間質腎炎進行鑑別,此時電鏡觀察成為必需。
 遺傳性腎炎
遺傳性腎炎5.其他有基底膜沉積物的疾病 電鏡下基底膜沉積物可見於其他腎臟疾病,需要和奧爾波特綜合徵以外的其他疾病相鑑別,也應考慮是否合併免疫複合物介導的腎小球腎炎
6.其他有基底膜緻密層改變的疾病 近期研究對本病腎小球基底膜改變的特異性提出質疑。在兩大組非選擇性的腎活檢標本中6%~15%的標本可見局灶性層狀和分離的緻密層,主要發生在感染後腎小球腎炎、局灶性節段性腎小球硬化和透明變性、IgA腎病和與表現為腎病綜合徵的系膜增生性腎小球腎炎因此當考慮奧爾波特綜合徵診斷時,應臨床聯繫,並對腎組織進行免疫螢光顯微鏡檢查瀰漫性腎小球基底膜增厚和分離現象是診斷奧爾波特綜合徵重要依據。如發現IgM、C3、備解素C4等在內皮下沉積,則考慮IgM腎病膜增殖性腎小球腎炎和其他免疫複合物介導的腎小球腎炎。
治療
 遺傳性腎炎
遺傳性腎炎預後
女性患者預後較好,一般可存活到60歲以上,而男性患者多在30歲以後發生腎功能衰竭。影響預後的臨床病理指征有男性預後比女性差;發生重度蛋白尿及腎病綜合徵者預後差;耳聾嚴重者預後差,尤其男性患者;有前球形晶體及黃斑中心凹周圍微粒表現者預後差;電鏡下GBM廣泛增厚分層者蛋白尿重者預後差總之腎外疾患出現愈早,尿蛋白愈多,預後愈差。
預防
應注意避免感染、勞累及妊娠,還應禁用腎毒性藥物以預防本病發生

