熔點沸點依次遞增(除釙外都是分子晶體,所以熔沸點隨相對分子質量增大而增高
。)
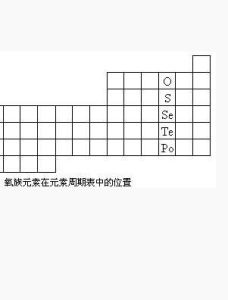
氧族元素
 氧族元素
氧族元素簡介
氧族元素 Chalcogen在標準狀況下,除氧單質為氣體外,其他元素的單質均為固體。化合物中,氧、硫、硒、碲四種元素通常顯-2氧化態,穩定性從氧到碲降低;硫、硒、碲最高氧化態可達+6。 氧、硫、硒的單質可以直接與氫氣化合,生成氫化物。
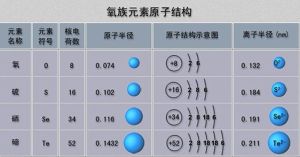
原子結構
| 原子序數 | 元素 | 電子層結構 |
| 8 | 氧 | 2, 6 |
| 16 | 硫 | 2, 8, 6 |
| 34 | 硒 | 2, 8, 18, 6 |
| 52 | 碲 | 2, 8, 18, 18, 6 |
| 84 | 釙 | 2, 8, 18, 32, 18, 6 |
| 116 | Uuh | 2, 8, 18, 32, 32, 18, 6 |
·原子最外層有6個電子
·反應中易得到2個電子
·表現氧化性
不同點
·除氧外其它氧族元素d軌道可參與成健,形成配位數為6的絡合物
·核電荷數依次增大
·電子層數依次增大
·原子半徑依次增大,得電子能力依次減弱,氧化性依次減弱.
單質
氧
氧氣通常條件下是呈無色、無臭和無味的氣體,密度1.429克/升,1.419克/立方厘米(液),1.426克/立方厘米(固),熔點-218.4℃,沸點-182.962℃,在-182.962℃時液化成淡藍色液體,在-218.4℃時凝固成雪狀淡藍色。固體在化合價一般為0和-2。電離能為13.618電子伏特。除惰性氣體外的所有化學元素都能同氧形成化合物。大多數元素在含氧的氣氛中加熱時可生成氧化物。有許多元素可形成一種以上的氧化物。氧分子在低溫下可形成水合晶體O₂.H₂O和O₂.H₂O₂,後者較不穩定。氧氣在空氣中的溶解度是:4.89毫升/100毫升水(0℃),是水中生命體的基礎。氧在地殼中豐度占第一位。乾燥空氣中含有20.946%體積的氧;水有88.81%重量的氧組成。除了O16外,還有O17和O18同位素。硫
 氧族元素
氧族元素通常為淡黃色晶體,它的元素名來源於拉丁文,原意是鮮黃色。單質硫有幾種同素異形體,菱形硫(斜方硫)和單斜硫是現在已知最重要的晶狀硫。它們都是由S8環狀分子組成。
密度 熔點 沸點 存在條件
菱形硫(S8) 2.07克/立方厘米 112.8℃ 444.674℃ 200℃以下
單斜硫(S8) 1.96克/厘米3 119.0℃ 444.6℃ 200℃以上
硫單質導熱性和導電性都差。性鬆脆,不溶於水,易溶於二硫化碳(彈性硫只能部分溶解)。無定形硫主要有彈性硫,是由熔態硫迅速傾倒在冰水中所得。不穩定,可轉變為晶狀硫(正交硫),正交硫是室溫下唯一穩定的硫的存在形式。
化學性質:
化合價為-2、+2、+4和+6。第一電離能10.360電子伏特。化學性質比較活潑,能與氧、金屬、氫氣、鹵素(除碘外)及已知的大多數元素化合。還可以與強氧化性的酸、鹽、氧化物,濃的強鹼溶液反應。它存在正氧化態,也存在負氧化態,可形成離子化合物、共價化合成物和配位共價化合物。
硒
稀散元素之一。在已知的六種固體同素異形體中,三種晶體(α單斜體、β單斜體,和灰色三角晶)是最重要的。也以三種非晶態固體形式存在;紅色和黑色的兩種無定形玻璃狀的硒。前者性脆,密度4.26克/厘米3;後者密度4.28克/厘米3。第一電離能為9.752電子伏特。硒在空氣中燃燒發出藍色火焰,生成二氧化硒(SeO₂)。也能直接與各種金屬和非金屬反應,包括氫和鹵素。不能與非氧化性的酸作用,但它溶於濃硫酸、硝酸和強鹼中。溶於水的硒化氫能使許多重金屬離子沉澱成為微粒的硒化物。硒與氧化態為+1的金屬可生成兩種硒化物,即正硒化物(M2Se)和酸式硒化物(MHSe)。正的鹼金屬和鹼土金屬硒化物的水溶液會使元素硒溶解,生成多硒化合物(M2Sen),與硫能形成多硫化物相似。有結晶形和無定形兩種同素異形體。電離能9.009電子伏特。結晶碲具有銀白色的金屬外觀,密度6.25克/厘米3,熔點452℃,沸點1390℃,硬度是2.5(莫氏硬度)。不溶於同它不發生反應的所有溶劑,在室溫時它的分子量至今還不清楚。無定形碲(褐色),密度6.00克/厘米3,熔點449.5±0.3℃,沸點989.8±3.8℃。碲在空氣中燃燒帶有藍色火焰,生成二氧化碲;可與鹵素反應,但不與硫、硒反應。溶於硫酸、硝酸、氫氧化鉀和氰化鉀溶液。易傳熱和導電。
碲
元素來源:碲是稀散金屬之一,有兩種同素異形體,一種為結晶形、具有銀白色金屬光澤;另一種為無定形,為黑色粉末。結晶形碲的熔點為449.8℃,密度為6.24克/厘米3。性脆。碲的化學性質與硒相似,在空氣或氧中燃燒生成二氧化碲,發出藍色火焰;易和鹵素劇烈反應生成碲的鹵化物,在高溫下不與氫作用。從電解銅的陽極泥和煉鋅的煙塵等中回收製取。
釙
密度9.4克/立方厘米。熔點254℃,沸點962℃。所有釙的同位素都是放射性的。已知有兩種同位素異形體:α-Po為單正方體;β-Po為單菱形體。在約36℃時,發生α-Po轉化為β-Po的相變。金屬、質軟。物理性質似鉈、鉛、鉍。化學性質近似碲。溶於稀礦酸和稀氫氧化鉀。釙的化合物易於水解並還原。化合價已有+2和+4價,也有+6價存在。釙是世界上最稀有的元素。釙同位素中最普遍、最易得的是釙-210,其半衰期僅有138天,其放射性比鐳大近5000倍。釙-210危險性很大,在操作時即便是很小量也要格外小心謹慎。
化學性質
相似性
·能與大多數金屬反應;·均能與氫化合生成氣態氫化物;
·均能在氧氣中燃燒;
·氧化物對應的水化物為酸;
·都具有非金屬性。
| 元素名稱 | 氧 | 硫 | 硒 | 碲 |
| 元素符號 | O | S | Se | Te |
| 核電荷數 | 8 | 16 | 34 | 52 |
| 原子半徑 | 逐漸增大 | |||
| 顏色 | 無色 | 黃色 | 灰色 | 銀白色 |
| 狀態 | 氣體 | 固體 | 固體 | 固體 |
遞變性
·氣態氫化物的穩定性逐漸減弱;·氣態氫化物的還原性逐漸增強;
·氣態氫化物水溶液的酸性逐漸增強;
·最高價氧化物對應水化物酸性逐漸減弱;
·非金屬性逐漸減弱;
·氧化物的鹼性逐漸增強,並出現兩性
化合物
常見的氧族元素的化合物有:氧化物、硫化物、硫酸鹽、亞硫酸鹽、硒酸鹽、碲酸鹽。下文將列舉出一些常見的化合物。二氧化硫
二氧化硫(化學式:SO₂)是最常見的硫氧化物。無色氣體,有強烈刺激性氣味。大氣主要污染物之一。火山爆發時會噴出該氣體,在許多工業過程中也會產生二氧化硫。由於煤和石油通常都含有硫化合物,因此燃燒時會生成二氧化硫。當二氧化硫溶於水中,會形成亞硫酸(酸雨的主要成分)。若把SO₂進一步氧化,通常在催化劑如二氧化氮的存在下,便會生成硫酸。二氧化硫可以通過硫的燃燒取得:S+O2==點燃==SO2;也可以通過銅和濃硫酸反應製得:Cu+2H₂SO4(濃)—Δ→CuSO4+SO2↑+2H2O。實驗室則用稀硫酸和亞硫酸鈉製備:H₂SO4+Na₂SO3==Na2SO4+SO₂↑+H₂O.
SO2是酸性氧化物,具有酸性氧化物的通性。可以與水作用得到二氧化硫水溶液,即“亞硫酸”(中強酸),但溶液中不存在亞硫酸分子。SO2與鹼反應形成亞硫酸鹽和亞硫酸氫鹽。以與氫氧化鈉的反應為例,產物是 Na2SO3還是 NaHSO3,取決於二者的用量關係。二氧化硫和鹼性氧化物反應生成鹽。
SO2有還原性,可以和氧化性物質如氯氣反應:SO2+Cl2==SO2Cl2,在有水存在時,則:SO2+Cl2+2H2O==H2SO4+2HCl;二氧化硫可以被氧氣氧化生成三氧化硫。二氧化硫可以被硝酸、高錳酸鉀、溴等氧化。
SO2也有氧化性,可以和還原性物質反應,如硫化氫:2H2S+SO2==2H2O+3S.
SO2有漂白性,它的漂白作用是由於與某些有色物質生成不穩定的無色物質,但這種無色物質容易分解使物質恢復原來的顏色,但這只是暫時的,如被二氧化硫漂白的品紅加熱可以恢復顏色。工業上用二氧化硫漂白紙張,所以,紙張久置後,會逐漸變黃,這是因為失去了二氧化硫的緣故。SO2的漂白屬於化學變化。
液態的SO2可以發生自偶電離:2SO2→SO(2+)+SO3(2-)。
SO2溶解度和溫度的關係如下表:
| 22 g/100ml (0 °C) | 15 g/100ml (10 °C) |
| 11 g/100ml (20 °C) | 9.4 g/100 ml (25 °C) |
| 8 g/100ml (30 °C) | 6.5 g/100ml (40 °C) |
| 5 g/100ml (50 °C) | 4 g/100ml (60 °C) |
| 3.5 g/100ml (70 °C) | 3.4 g/100ml (80 °C) |
| 3.5 g/100ml (90 °C) | 3.7 g/100ml (100 °C) |
硫化氫
硫化氫是一種無機化合物,化學式為H2S。正常情況下是一種無色、易燃的酸性氣體,濃度低時帶惡臭,氣味如臭蛋;濃度高時反而沒有氣味(因為高濃度的硫化氫可以麻痹嗅覺神經)。它能溶於水,0 °C時1體積水能溶解2.6體積左右的硫化氫。硫化氫的水溶液叫氫硫酸,是一種弱酸,當它受熱時,硫化氫又從水裡逸出。硫化氫是一種急性劇毒,吸入少量高濃度硫化氫可於短時間內致命。低濃度的硫化氫對眼、呼吸系統及中樞神經都有影響。硫化氫自然存在於原油、天然氣、火山氣體和溫泉之中。它也可以在細菌分解有機物的過程中產生。
硫化氫是酸性的,它與鹼及一些金屬(如銀)有化學反應。 例如:硫化氫和銀接觸後,會產生黑褐色的硫化銀:H2S + 2Ag → Ag2S + H2↑ .
硫化氫有還原性,可以和二氧化硫發生氧化還原反應。(見本詞條→化合物→二氧化硫)。
實驗室製取硫化氫:FeS + 2HCl = FeCl2 + H2S↑;此外,硫化氫還可以通過一些硫化物(如硫化鋁)的水解製取:6H2O + Al2S3 = 3H2S↑ + 2Al(OH)3.
三氧化硫
三氧化硫是一種硫的氧化物,分子式為SO3。它的氣體形式是一種嚴重的污染物,是形成酸雨的主要來源之一。三氧化硫中,硫的氧化數為+6,分子為非極性分子。三氧化硫的熔點很低,只有16.9℃,沸點也只有45℃。SO3是硫酸(H2SO4)的酸酐。因此,可以發生以下反應:SO3+H2O==H2SO4,這個反應進行得非常迅速,而且是放熱反應。在大約~340 °C以上時,硫酸、三氧化硫和水才可以在平衡濃度下共存。
實驗室通常通過熱分解硫酸氫鈉來製取三氧化硫:2NaHSO4 -315°C→ Na2S2O7 + H2O ;Na2S2O7 -460°C→ Na2SO4 + SO3 。此外,三氧化硫還可以通過二氧化氮和二氧化硫來製取:SO2+NO2==SO3+NO.
硫酸
硫酸(Sulfuric acid),分子式為H2SO4,是一種無色粘稠高密度的強腐蝕性液體。是一種重要的化工原料,又稱化學工業之母,也是一種常見的化學試劑。硫酸具有極強的腐蝕性,因此在使用時應非常小心。硫酸的熔點為10℃,沸點290℃,和水混溶。硫酸溶於水強烈放熱,因此在稀釋硫酸的時候要注意“酸入水”。
濃硫酸有脫水性,如將濃硫酸滴在蔗糖上,白色的糖逐漸轉成黑色,並釋出白色的氣體(水蒸汽蒸發至空氣中後冷凝成的水珠):C12H22O11 → 12 C + 11 H2O 。濃硫酸有吸水性,可以強烈的吸收水份放出熱量。(如果吸收的是水分子,那么是吸水性,如吸收五水硫酸銅中的五分子的水。)
濃硫酸有酸性和氧化性,其氧化性一般要在加熱的情況下才能體現出來。如,濃硫酸可以氧化單質銅:Cu + 2 H2SO4 → CuSO4 + SO2 + 2 H2O;濃硫酸氧化金屬不放出氫氣,而放出二氧化硫。濃硫酸也能氧化非金屬如磷、硫、硒、碳等。
稀硫酸和活潑金屬反應放出氫氣,如鋅和硫酸反應生成硫酸鋅和氫氣(Zn+H2SO4==ZnSO4+H2↑),這一反應在實驗室用來製取氫氣。硫酸能和金屬氧化物反應:CuO+H2SO4==CuSO4+H2O(這種製取硫酸銅的方式比用濃硫酸直接氧化銅要環保)。硫酸可以和某些鹽反應:BaCl2+H2SO4==BaSO4↓+2HCl。硫酸的酸性可以使石蕊溶液變紅。
六氟化硫
 氧族元素
氧族元素六氟化硫由單質化合製取,反應也會生成硫的其他氟化物如十氟化二硫,可通過加熱使其歧化後,再用氫氧化鈉處理除去剩餘的四氟化硫而純化。六氟化硫是個極為惰性的氣體,不與水、鹽酸、氫氧化鈉和熔融的鈉作用,但會與金屬鋰反應並放熱。
人吸入六氟化硫後聲音變粗,因為六氟化硫氣體的重量使人的聲帶中聲波的速度降低一半,與吸入氦氣後聲音變細正好相反。
二氯化二硫
二氯化二硫(S2Cl2)是一種黃紅色液體,有刺激性、窒息性惡臭,在空氣中強烈發煙。遇水分解為硫、二氧化硫、氯化氫。溶於醚、苯、二硫化碳。室溫下穩定,100°C時分解為相應單質,300°C時則完全分解。二氯化二硫能被金屬還原為氯化物和硫化物。與氯氣反應生成二氯化硫。能與金屬氧化物或硫化物反應生成金屬氯化物。製備:由硫與限量氯氣在50~60°C反應16~20小時而得:2S+Cl2==S2Cl2。二硫化碳與氯氣在95~100°C反應製取四氯化碳,副產二氯化二硫:CS2+3Cl2==CCl4+S2Cl2。
用途:用作橡膠的低溫硫化劑和粘結劑。在有機合成中用於引入 C–S 鍵。在氯化鋁存在下,與苯反應生成二苯硫醚。與乙烯反應生成芥子氣。也是Herz反應中的試劑。
硫醯氯
硫醯氯(又名磺醯氯)是硫酸的兩個-OH基團被氯替代後形成的化合物,分子式為SO2Cl2,為無色有強烈刺鼻氣味的液體,在潮濕空氣中發煙,其沸點為69.1℃。它用作有機化學中的氯化試劑,可以將烷烴、烯烴、炔烴及芳香化合物的C-H鍵轉化為C-Cl鍵,將醇轉化為氯代烴。反應由偶氮二異丁腈引發,是自由基機理,稱為氯磺化反應。硫醯氯也用於藥物和染料的製取。硫醯氯分子為畸變的四面體結構,硫為+6氧化態,S-O鍵含有一定的雙鍵成分。在催化劑如活性炭、氯化鐵或樟腦的存在下,二氧化硫與氯氣化合即生成硫醯氯,通過蒸餾提純。反應式:SO2 + Cl2 → SO2Cl2 。氯磺酸加熱也可得到硫醯氯:2ClSO3H → SO2Cl2 + H2SO4 。
硫醯氯極易水解,生成氯化氫(鹽酸)和硫酸:2 H2O + SO2Cl2 → 2 HCl + H2SO4
硫醯氯在100°C以上便開始分解,得到二氧化硫與氯氣,使試劑變黃。長期放置時也會發生分解。
氯化亞碸
氯化亞碸,又名亞硫醯氯,是一種無機化合物,化學式是SOCl2。常溫常壓下,它是無色、可蒸餾的液體,140°C 時分解。SOCl2有時易與硫醯氯(SO2Cl2)相混淆,但它們的化學性質差別很大。氯化亞碸的分子構型為錐體型,其中硫(VI)中心含有一對孤對電子。而光氣則是平面構型。氯化亞碸與水反應生成氯化氫和二氧化硫:H2O + SOCl2=SCl2 → SO2 + 2 HCl
由於氯化亞碸與水強烈反應,SOCl2不會在自然界存在。
氯化亞碸是無色或淡黃色發煙液體,有強刺激性氣味。遇水或醇分解成二氧化硫和氯化氫。對有機分子中的羥基有選擇性取代作用。本產品可溶於苯、氯仿、二硫化碳和四氯化碳。加熱至150°C開始分解,500°C分解完全。
在工業上,氯化亞碸主要由三氧化硫和二氯化硫反應製得:SO3 + SCl2 → SOCl2 + SO2。
硫酸銅
硫酸銅,化學式CuSO4,為白色粉末, 其常見的形態為其結晶體,五水合硫酸銅(CuSO4·5H2O),為藍色固體。其水溶液因水合銅離子的緣故而呈現出藍色,故在實驗室里無水硫酸銅常被用於檢驗水的存在。在現實生產生活中,硫酸銅常用於煉製精銅,與熟石灰混合可制農藥波爾多液。硫酸銅屬於重金屬鹽,有毒,成人致死劑量0.9g/kg。若誤食,應立即大量食用牛奶、雞蛋清等富含蛋白質食品,或者使用EDTA鈣鈉鹽解毒。用途:滅菌劑:硫酸銅可以用於殺滅真菌。與石灰水混合後生成波爾多液,用於控制檸檬、葡萄等作物上的真菌。稀溶液用於水族館中滅菌,以及除去蝸牛。由於銅離子對魚有毒,用量必須嚴格控制。大多數真菌只需非常低濃度的硫酸銅就可被殺滅。此外,硫酸銅也可用來控制大腸桿菌。
分析試劑:
幾種化學分析都需用到硫酸銅。它用於斐林試劑和班氏試劑中檢驗還原糖。在反應中,二價銅離子被還原成一價的不溶紅色沉澱氧化亞銅。硫酸銅還可用於雙縮脲試劑中用來檢測蛋白質。
硫酸銅可用於檢驗貧血。將血樣滴入硫酸銅溶液中,若血樣中含足夠血紅蛋白,血樣會快速下沉;若血紅蛋白含量不夠,血樣會懸浮在溶液中。
焰色反應中硫酸銅顯藍綠色,比鋇離子的顏色藍得多。
有機合成:硫酸銅可以用於有機合成。無水鹽用於催化轉縮醛反應。五水鹽與高錳酸鉀反應生成一種氧化劑,用於伯醇的轉換。
化學教學:硫酸銅可用於晶體的生成試驗和電鍍銅實驗。硫酸銅也常用於演示放熱反應,演示時將鎂條插入硫酸銅溶液中。硫酸銅還可以用來演示晶體失水風化和得到結晶水的過程。中學課本上有個用鐵置換銅的實驗,是將鐵條(或鐵絲)插入硫酸銅溶液中,可以置換出紅色的銅。
二氧化硒
二氧化硒(化學式:SeO2)是硒(IV)的氧化物,無色晶體,是最常用的硒化合物,315℃升華,有毒,人攝入後體內會散發出特別的臭味(攝入後應服用維生素C)。硒在空氣中燃燒(藍色火焰),硒與硝酸、過氧化氫反應氧化,或亞硒酸脫水都可以得到二氧化硒。二氧化硒可溶於水,生成亞硒酸;溶於鹼則生成亞硒酸鹽。它是有機合成中的氧化劑,可用於烯丙位氧化、Riley氧化反應等。環己酮發生反應得到1,2-環己二酮,三聚甲醛反應得到乙二醛。硒化氫
硒化氫是一種極毒、有惡臭的無色氣體,酸性比硫化氫強,加熱灼燒可逐漸分解。可燃。通常由金屬硒化物和水或稀酸的反應製取。其他硒化合物
亞硒酸是硒的含氧酸的一種,其中硒的氧化態為+4。它是白色正交晶系晶體,極易溶於水,由二氧化硒溶於少量水緩慢蒸髮結晶並用氫氧化鉀乾燥得到。晶體中稍許畸變的SeO3基團,靠較強的氫鍵相互連線。固態亞硒酸在150℃分解。在更強的氧化劑(如臭氧、氯氣、高錳酸根離子)作用下,亞硒酸也可以被氧化為硒酸。亞硒酸有很高毒性,中毒症狀可能延遲數小時,包括昏迷、噁心、低血壓,嚴重時可能致死。硒酸是硒的含氧酸的一種,其中硒的化合價的氧化態為+6,有很強的氧化性,可以溶解金。
二硒化碳(化學式:CSe2),是一種黃色且有刺激性氣味的液體。和二氧化碳、二硫化碳一樣,二硒化碳也被認為是一種無機化合物。二硒化碳可在550℃以下藉由硒粉與二氯甲烷反應製得:2 Se + CH2Cl2 → CSe2 + 2 HCl ↑.
其他碲化合物
碲化氫是無色、有惡臭、極毒的無色氣體,不穩定,加熱分解,有較強的還原性,可以被一些常見的氧化劑氧化。三氧化碲〔TeO3〕是一種無機化合物。碲的化合價為+6。三氧化碲有兩種形式,一種是紅色的α-TeO3,一種是灰色的β-TeO3。
二氧化碲,不溶於水的固體。
原碲酸是可溶於水、易溶於熱水的白色晶體,化學式H6TeO6,是很弱的二元酸(電離常數為K1=2.09X10^-8, K2=6.46X10^-12),一般只有2個氫原子會被取代,但也有個別情況6個氫原子都能被取代。原碲酸加熱分解出三氧化碲。原碲酸是弱酸。原碲酸有強氧化性,能溶解銀,和濃鹽酸的混酸(存在游離Cl2)能溶解鉑和金,本身被還原成二氧化碲。SO2或N2H4能將原碲酸還原成單質碲。
碲酸鋇,由二氧化碲和過氧化鋇反應產生,與鉬酸鋇為同晶型。
參見
氮族元素(Pnictogen、Nitrogen group)鹵族元素(Halogen)
稀有氣體(Noble gas)