含義
電離常數是電離平衡的平衡常數,描述了一定溫度下,弱電解質的電離能力。
意義
弱電解質在一定條件下電離達到平衡時,(水)溶液中電離所生成的各種離子濃度以其在化學方程式中的計量數為冪的乘積,跟溶液中未電離分子的濃度以其在化學方程式中的計量數為冪的乘積的比值,即溶液中電離出來的各離子濃度乘積(c(A+)*c(B-))與溶液中未電離的電解質分子濃度(c(AB))的比值是一個常數,叫做該弱電解質的電離平衡常數。 這個常數叫電離平衡常數,簡稱電離常數。
要注意的是電離平衡常數隻適用於弱電解質的計算,強電解質不適用*。
*註:但這並不是說強電解質沒有電離平衡常數,由於物理作用等因素影響,強電解質也並非完全電離。只不過強電解質不使用電離平衡常數進行相關計算。強電解質可以用陰陽離子平均活度(由於單個離子活度無法確定,陰陽離子平均活度可以由實驗測定 )來表示電離程度,參與計算。
電離平衡
電離平衡是一種化學現象,通常發生在具有極性共價鍵的化合物溶於水中的情況。
概念與定義
具有極性共價鍵的弱電解質(例如部分弱酸、弱鹼)溶於水時,其分子可以微弱電離出離子;同時,溶液中的相應離子也可以結合成分子。一般地,自上述反應開始起,弱電解質分子電離出離子的速率不斷降低,而離子重新結合成弱電解質分子的速率不斷升高,當兩者的反應速率相等時,溶液便達到了電離平衡。此時,溶液中電解質分子的濃度與離子的濃度分別處於穩定狀態,不再發生變化。
用簡單的語言概括電離平衡的定義,即:在一定條件下,弱電解質的離子化速率等於其分子化速率。
在右側的示意圖中,橫軸表示反應時間,縱軸表示反應速率,曲線v1表示弱電解質分子電離出離子的速率,曲線v2表示離子結合成弱電解質分子的速率。如圖所示,經過時間 t,兩個反應的速率相等,此時溶液達到電離平衡。
平衡方向的改變
在上述反應過程中,弱電解質分子電離與離子結合成為分子,二者共同構成一組可逆反應。常以弱電解質分子電離出離子的反應方向為正反應方向,以離子重新結合成弱電解質分子的反應方向為逆反應方向。
與化學平衡一樣,電離平衡是可以因為條件變化(如濃度、溫度、酸鹼性等)而移動的。
以下列表歸納了外界條件變化對電離平衡及 c(H)的影響,這裡假設弱電解質AB可以電離成(A)和(B),且電離過程吸熱,則
| 電離方程式 | AB=(可逆反應)=(A)+(B) | |
| 條件改變內容 | v(正),v(逆)關係 | 平衡移動方向 |
| 增大c(AB) | v(正)>v(逆) | 向右 |
| 減小c(AB) | v(正)<v(逆) | 向左 |
| 增大c(A) | v(正)<v(逆) | 向左 |
| 減小c(A) | v(正)>v(逆) | 向右 |
| 增大c(B) | v(正)<v(逆) | 向左 |
| 減小c(B) | v(正)>v(逆) | 向右 |
| 稀釋溶液 | v(正)>v(逆) | 向右 |
| 升高溫度 | v(正)>v(逆) | 向右 |
| 降低溫度 | v(正)<v(逆) | 向左 |
為了便於理解,可以參考醋酸(CHCOOH)的電離平衡,將CHCOOH代入上表的AB,將H代入A,將CHCOO代入B。
另外,電離平衡也遵循勒夏特列原理。
計算方法
弱電解質AxBy在水溶液中達到電離平衡時:AxBy⇋ xA+ + yB-
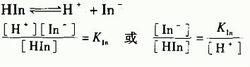 例如
例如則,K(電離)=C[A+]^x·C[B-]^y/ C[AxBy] 式中C[A+]、C[B-]、C[AB]分別表示A+、B-和AxBy在電離平衡時的物質的量濃度。
電離平衡常數的大小反映弱電解質的電離程度,不同溫度時有不同的電離常數。
在同一溫度下,同一電解質的電離平衡常數相同,但隨著弱電解質濃度的降低.轉化率會增大。由該溫度下的解離度a=(K/起始濃度)的算術平方根,可得知:弱電解質濃度越低電離程度越大 。
電離常數
弱電解質電離常數
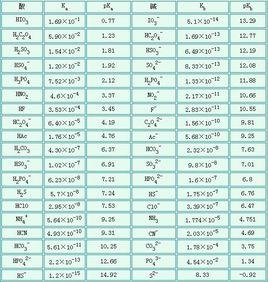
條件是在室溫下(25°C)。Ka表示弱酸的電離常數,Kb表示弱鹼的電離常數,pKa(pKb)表示其負對數。
弱酸
| 名稱 | 化學式 | Ka | pKa |
| 砷酸 | HAsO | 6.2X10ˆ-3(Ka1) 1.2X10ˆ-7(Ka2) 3.1X10ˆ-12(Ka3) | 2.21 6.93 11.51 |
| 亞砷酸 | HAsO | 5.1X10^-10 | 9.29 |
| 硼酸 | H3BO3 | 5.8X10^-10 | 9.24 |
| 次溴酸 | HBrO | 2.3X10^-9 | 8.63 |
| 氫氰酸 | HCN | 6.2X10^-10 | 9.21 |
| 氰酸 | HCNO | 3.3X10^-4 | 3.48 |
| 碳酸 | H2CO3 | 4.45X10^-7(ka1) 4.7×10^-11(ka2) | 6.352 |
| 次氯酸 | HClO | 2.98X10^-8 | 7.526 |
| 亞氯酸 | HClO | 1.1X10^-2 | 1.95 |
| 鉻酸 | HCrO2 | 3.2X10^-7(Ka2) | 6.50 |
| 氫氟酸 | HF | 6.8X10^-4 | 3.17 |
| 次碘酸 | HIO | 2.3X10^-11 | 10.64 |
| 碘酸 | HIO3 | 0.49 | 0.31 |
| 亞硝酸 | HNO2 | 7.1X10^-4 | 3.15 |
| 過氧化氫 | HO | 2.2X10^-12 | 11.65 |
| 次磷酸 | HPO | 5.9X10^-2 | 1.23 |
| 磷酸 | H3PO4 | 7.11X10^-3(Ka1) 6.23X10^-8(Ka2) 4.5X10^-13(Ka3) | 2.18 7.199 12.35 |
| 焦磷酸 | H4P2O7 | 0.20(Ka1) 6.5X10^-3(Ka2) 1.6X10^-7(Ka3) 2.6X10^-10(Ka4) | 0.70 2.19 6.80 9.59 |
| 亞磷酸 | HPO2 | 3.7X10^-2(Ka1) 2.9X10^-7(Ka2) | 1.43 6.54 |
| 氫硫酸 | H2S | 1.3X10^-7(Ka1) 7.1X10^-15(Ka2) | 6.88 14.15 |
| 硫酸 | HSO | 1.02X10^-2(Ka2) | 1.99 |
| 亞硫酸 | H2SO3 | 1.23X10^-2(Ka1) 5.6X10^-8(Ka2) | 1.91 7.18 |
| 硫氰酸 | HSCN | 0.13 | 0.9 |
| 硫代硫酸 | H2S2O3 | 0.25(Ka1) 1.9X10^-2(Ka2) | 0.60 1.72 |
| 偏矽酸 | H2SiO3 | 1.7X10^-10(Ka1) 1.6X10^-12(Ka2) | 9.77 11.8 |
| 甲酸 | HCOOH | 1.80X10^-4 | 3.745 |
| 草酸 | HOOC-COOH | 5.60X10^-2(Ka1) 5.42X10^-5(Ka2) | 1.252 4.266 |
| 乙酸 | CH3COOH | 1.75X10^-5 | 4.757 |
| 丙酸 | C2H5COOH | 1.34X10^-5 | 4.874 |
| 乳酸(D-2-羥基丙酸) | CHCH(OH)COOH | 1.38X10^-4 | 3.860 |
| 苯酚 | CHOH | 1.0X10^-10 | 9.98 |
| 苯甲酸 | CHCOOH | 6.28X10^-5 | 4.202 |
| 水楊酸(2-羥基-苯甲酸) | CHO | 1.0X10^-3(COOH) 2.2X10^-14(OH) | 2.98 13.66 |
| 鄰苯二甲酸 | CHO | 1.12X10^-3(Ka1) 3.91X10^-6(Ka2) | 2.950 5.408 |
| 檸檬酸(2-羥基-1,2,3-丙三羧酸) | CHO | 7.44X10^-4(Ka1) 1.73X10^-5(Ka2) 4.02X10^-7(Ka3) | 3.128 4.761 6.396 |
弱鹼
| 名稱 | 化學式 | Ka(b) | pKb |
| 一水合氨 | NH HO | 1.8X10^-5 | 4.74 |
| 聯氨(肼) | N2H4 | 3.0X10^-6(Kb1) 7.6X10^-15(Kb2) | 5.52 14.12 |
| 苯胺 | CHNH | 4.2X10^-10 | 9.38 |
| 羥胺 | NHOH | 9.1X10^-9 | 8.04 |
| 甲胺 | CHNH | 4.2X10^-4 | 3.38 |
| 乙胺 | CHNH | 5.6X10^-4 | 3.25 |