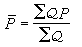高層大氣化學
正文
研究地球高層大氣中性成分和電離成分及其化學反應的學科,是高層大氣學的一個分支。高層大氣化學的研究課題主要有:高層大氣的組成成分及其空間分布,各成分的源和匯,各成分間的化學反應等。高層大氣化學分為中性成分化學和離子成分化學兩部分。前者著重研究50~110公里高度中性成分化學,後者研究60~500公里或整個電離層離子成分化學。
研究簡史 1931年,S.查普曼提出電離層形成的理論和用化學反應解釋氣輝氧綠線,為高層大氣光化學奠定了基礎。40年代中開始的火箭探空技術促進了高層大氣光化學的發展。從40年代到50年代初,尼科萊(M.Ni-colet)、貝茨(D.R.Bates)和米特拉(S.K.Mitra)等人提出了關於地球高層大氣氮、氧、氫成分化學的最初理論。高層大氣光化學是高層大氣學的重要組成部分。由於高空物理過程與化學過程的相互聯繫與制約,高層大氣化學的研究日益顯得重要,因而逐漸形成為一個獨立的分支學科。火箭和人造衛星空間探測技術的發展,實驗室測量與理論計算的改進,使高層大氣化學研究進入了迅速發展的新階段。
高層大氣化學反應的能源 太陽光是使高層大氣成分光解的主要能源。太陽短波輻射照射地球大氣,大氣分子吸收太陽輻射而被激發,即為大氣化學反應的初級過程;激發態成分再與其他分子相互作用稱為次級過程。激發態可以是分子的轉動或振動能級的激發,也可以是原子的電子能態的激發,或分子和原子的電離等。常見的初級過程有:①光致激發,即原子A在光子hv 作用下變成激發態原子的過程(A+hv ─→A*);②光致離解,即分子AB在光子作用下分解成原子或簡單分子的過程(AB+hv ─→A+B);③光致電離,即分子或原子在光子作用下變成離子AB+和電子e的過程(AB+hv ─→AB++e)。由於激發態成分生存時間很短(除某些亞穩態外,一般為億分之一秒),它們一經形成就進入次級化學反應。常見的次級過程主要有:①去活(又稱去激發)或猝滅,激發態成分跟其他原子或分子M相碰撞而丟失能量,以致不能再產生光子,不再有化學發光(A*+M─→A+M);②離解,激發態成分分解為原子或簡單分子的過程(AB*+M─→A+B+M);③能量轉移(A*+B─→A+B*)和原子互換(A*+BC─→AB+C)。
太陽短波輻射是臭氧層也是電離層形成的主要原因。一般具有波長λ為170~800埃的太陽輻射,在140~180公里的高空被大氣分子吸收,形成F1層。具有波長小於100埃的太陽X射線,和波長約為800~1025埃的太陽紫外輻射,在95~140公里高空被大氣分子吸收,形成E層。波長約為1200~2000埃的太陽輻射,主要被低熱層和中間層的氧分子吸收,這在很大程度上決定了 50~120公里高空氧原子和臭氧的光化學反應和它們的分布。波長為2~8埃的太陽X射線、遠紫外輻射,和波長為1026埃的太陽Lβ輻射是85~100公里高空電離的主要光子來源。波長為1216埃的太陽Lα 輻射,使75~90公里高空的一氧化氮電離而形成D層。波長在 1800~2900埃之間的太陽輻射,在10~50公里高空形成臭氧層。
化學反應最激烈的地方,一般位於對流層頂以上的20~110公里高度上。這裡,太陽短波輻射使大氣中一些重要成分光解,由此產生的原子、分子及激發態成分間發生一系列化學反應並構成大氣活動的主要特徵。通常稱這一區域為光化層。在光化層上部100公里附近,氧分子因吸收波長約為1370~1750埃的太陽輻射而離解(這個譜段稱為氧分子舒曼-龍格離解連續譜),是那裡最重要的光致離解過程。在較低高度,氧分子對波長約為1850~2430埃的太陽輻射具有較弱的吸收,該輻射也能使它離解(這個譜段稱為氧分子赫茨伯格離解連續譜)。
高層大氣中性成分化學 地球大氣的主要成分是N2和O2,分別占78%和21%,其次是惰性氣體Ar,占0.93%。其餘均為微量成分。這個比例大致維持到90公里高度。但在熱層,那裡的基態氧原子O(3P)數量很大,其濃度接近和超過N2和O2,有時也把O(3P)稱為主要成分。地球高層大氣有代表性的重要中性成分見圖1。在高層大氣化學中,微量成分主要是指各種化學性質活潑的自由基,具有或長或短生存時間的激發態分子和原子。其中一個重要類型是亞穩態成分。它是生存時間比較長的激發態中性成分或離子成分,在高層大氣化學中占有重要地位。
在高層大氣中,化學性質活潑的中性成分(包括一部分微量成分和幾乎所有亞穩態成分),主要是基態氧原子O(3P)、亞穩態氧原子 O(1D)、亞穩態氧分子 O2(1△g)、臭氧O3、基態氮原子N(4S)、亞穩態氮原子N(2D)、一氧化氮NO、二氧化氮NO2、二氧化碳CO2、水汽H2O、羥基OH和氫過氧基 HO2等。它們對高層大氣物理過程和化學過程都很敏感。如O3、H2O和CO2同紅外電磁波發生強烈作用,會影響全球大氣的輻射平衡,從而影響到全球的氣候。
中性成分的化學反應主要有光致離解、光致電離、光致激發、螢光或共振散射(在光致激發後,被激發的原子或分子將直接返回基態或中間激發態,伴隨著特徵輻射的發射,當激發和輻射波有相同波長時,該過程稱共振散射,而輻射波長不同於吸收光波長時,該過程稱螢光)、猝滅、原子互換、原子複合(如A+B+M-→AB+M)等反應。其中,原子複合和原子互換反應較普遍。雙原子複合成一個分子,過剩能轉化成輻射,這在某些氣輝線的激發上較重要。在中間層和低熱層大氣中,原子互換反應能激發某些重要氣輝帶,例如羥基(OH)邁納爾帶氣輝。
在中性成分化學中,中間層是值得特別注意的區域,因為這裡是水汽和氧分子光致離解的重要區域,而且光致離解產物的化學生存時間較長(但不超過幾小時),影響中性成分的空間分布。
臭氧O3 一般存在於 130公里以下的大氣中,濃度最大值位於20~25公里高度附近。臭氧產生於氧分子的光致離解和隨後的三體碰撞反應:
O2 + hv(λ<2400┱)→O(3P) + O(3P),
O2 + hv(λ<1750┱)→O(3P) + O(1P),
O2 + O(3P) + M→O3 + M,
式中hv 代表光子,M代表其他成分。在25公里,氧的離解係數約為 1.8×10-12秒-1,在40公里為 3.3×10-10秒-1,在100公里增加到4×10-6秒-1。臭氧在哈特利連續區很容易光解為亞穩態氧分子O2(1△g)和亞穩態氧原子 O(1D):O3 + hv(λ<3100┱)→O2(1△g) + O(1D)。
在哈特利連續吸收區以外則有:O3 + hv(λ<6112┱)→O2(1△g) + O(3P)
和O3 + hv(λ<11800┱)→O2 + O(3P)。
臭氧在大氣中很容易跟氧原子作用再度形成氧分子:O3 + O(3P)→2O2。
上述臭氧的產生和消失反應的思想是查普曼提出的,因此稱之為查普曼氧循環。還有O(3P) + O(3P) + M→O2 + M
和O(1D) + M→O(3P) + M ,
在高層大氣中也是重要的化學反應。日照時,臭氧在平流層頂部和中間層底部光化學平衡相當快。在55公里以上直至中間層頂,臭氧的濃度晝夜變化較大,這裡白天O(3P)、NO和H也能破壞臭氧,但比光致離解過程弱。在70公里以上,一般認為氫跟臭氧作用導致羥基OH邁納爾帶氣輝的生成,其輻射的最大值在90公里附近。夜間,光致離解消失,臭氧同OH、HO2和NO等碰撞而遭到破壞。
亞穩態氧分子O2(1△g) 光化層氧分子的重要形式,它主要產生於臭氧的光致離解反應。它損失於輻射或被基態氧原子 O(3P)的碰撞去活。O2(1△g)輻射可以通過日氣輝1.27微米帶觀測到:
O2(1△g)→O2 + hv(1.27μm),
O2(1△g)主要分布在50~95公里高空。基態氧原子O(3P) 主要產生於氧分子在舒曼-龍格連續譜的離解和赫茨伯格連續譜的離解。是光化層上部數量最多的微量成分。它主要通過原子複合和原子互換過程而消失。
亞穩態氧原子O(1D) 有較長的輻射生存時間(110秒),存在於整個光化層和熱層。20世紀30年代從氧原子6300埃氣輝觀測中確認了它的存在。在中間層,它基本來自氧分子在舒曼-龍格連續譜的光致離解和臭氧的光致離解,丟失在碰撞去活和原子互換反應中。在熱層,O(1D)的主要源反應與匯反應是:
O + e*(光電子)→O(1D) + e,
O2+ + e →O(1D) + O(離解複合反應),
N(2D) + O2→O(1D) + NO,
O2 + hv(λ= 1350~1750┱)→O(1D) + O,
O(1D)→O(4S) +hv(6300┱),
O(1D) + N2→O(4S) + N2,
O(1D) + N2→,O(3P) + N2*,
這裡N2*是振動激發態。N(2D)和O2之間的能量轉移反應是70年代發現的極光氧紅線的重要來源。亞穩態氧原子O(1S) 有相對短促的輻射生存時間(0.74秒),它存在於較低高度(100公里附近)和較高高度(240公里附近)的氣輝中,也存在於極光中。在較低高度氣輝中,它產生於原子複合以後的能量轉移過程,丟失於同O2(1△g)的碰撞去活中。在極光中,氧綠線產生於下列4個反應:
N2(A3∑) + O→N2 + O(1S),
O娚 + N→NO+ + O(1S)(電荷轉移反應),
O + e*→O(1S) + e,
O娚 + e→O(1S) + O(離解複合反應),
它也丟失於同O2(1△g)的碰撞去活中:O(1S) + O2(1△g)→O + O2。O(1S)
在高高度氣輝中的化學過程類似於O(1D)。基態氮原子N(4S)和亞穩態氮原子N(2D) NO在波長λ≤1910埃紫外光作用下,離解成N(4S)和O(3P)。在低熱層,N2同光電子碰撞後的離解及NO+的離解複合反應是N(2D)的重要來源。在160~300公里的主要源反應有:
NO+ + e→N(2D) + O,
N娚 + e→N(2D) + N(2D)(均是離解複合反應),
N娚 + O→N(2D) + NO+(電荷轉移反應)。
N(2D)丟失於同原子或電子的碰撞去活中,也丟失於同分子的能量轉移反應中。一氧化氮NO 廣泛存在於中間層和熱層。在80公里以下,N(4S)同O2之間的原子互換反應是NO的基本來源。但在80公里以上,必須考慮N(2D)同O2之間的原子互換反應,其反應速率係數比前者大幾個量級。NO消耗在它同氮原子的互換反應和它自己的光致離解等反應中。
二氧化氮NO2 在中間層,NO2比NO濃度低得多。NO、O(3P)與大氣主要成分之間的三體複合反應是光化層NO2的主要來源。NO與 O3之間的原子交換反應也是NO2的來源。NO2消失於它同氧原子的原子互換反應中。
氫分子H2和氫原子H 中間層的氫氣是氫過氧基HO2與氫原子間原子互換反應的產物,也是兩個氫原子同大氣主要成分(N2和O2)三體複合反應的產物。水汽在太陽Lα 輻射作用下,光致離解也產生H2。在中間層,H2的產生多於損失,多出的部分可以向低熱層傳輸,也可以向平流層傳輸。H2主要丟失於同O(1D)或 OH的原子互換反應中。
氫原子在中間層頂產生於水汽被太陽遠紫外線的光致離解:
H2O + hv(λ<1750┱)→OH + H。
在光化層頂部附近,只要是波長短於2000埃的紫外線即可造成水的離解,而在中間層的70公里高空,只有Lα 輻射才能使H2O離解。氫原子丟失於它同O2和M分子的三體複合,以及它同O3的原子互換反應中。羥基OH 存在於整個光化層,濃度最大值在60公里高空附近。O(1D)同來自較低層大氣的水汽、氫氣等結合,經常有OH形成。
O(3P) + OH→O2 + H,
原子互換反應,可以有效地破壞氧原子,它貫穿於整箇中間層大氣。氫過氧基HO2 氫原子、氧分子與M分子間的三體複合反應是中間層 HO2的主要來源。這裡,它可以有效地光致離解為OH和O(3P)。在40公里以上,OH與HO2之間可以通過它們各自同O3的反應而相互轉換。
水汽H2O 在中間層,OH與HO2之間的原子互換反應,是導致水汽再生的基本過程:
OH + HO2→H2O + O2。
這裡,水汽可能光致離解,但來自較低層的水汽可以彌補這一損失。水汽還大量損失於它同 O(1D)之間的原子互換反應中。在平流層,水汽比在中間層再生快,其垂直分布很少受離解過程的影響。二氧化碳CO2 其濃度隨高度降低很慢。碳的氫化物如甲烷與羥基作用生成的 CH3,再經過一系列複雜的氧化反應即可形成一氧化碳CO,而CO同羥基OH的原子互換反應乃是自然界 CO2的重要來源。由於在中間層臭氧混合比顯著下降,直接吸收的太陽紫外輻射明顯減少,這裡的輻射傳輸便主要由CO2的15微米振動帶起作用,它控制著大氣的垂直溫度分布。
高層大氣離子成分化學 在60公里以上的電離層包含各種類型的離子,有分子的離子,也有原子的離子;有基態成分的離子,也有激發態成分(包括亞穩態)的離子;有正離子,也有負離子;有各式各樣的水化離子團,也有金屬離子等等。高層大氣離子成分的分布(圖2),在 90公里以上,數量最多的離子是NO+和O娚,再就是各種水化離子團和負離子O娛等。 在電離層中,由於受到太陽紫外線、X射線、太陽宇宙線和銀河宇宙線的作用,部分氣體分子或原子被電離產生電子、正離子和負離子。當這些電離輻射使得電子從原子或分子內部拋出時,就出現了光電子e*,它具有動能,相當於太陽輻射能和電離需要能之差。如果能量足夠高,它可以電離別的原子。由於碰撞作用,光電子獲得的動能又可能轉交給其他原子,使這些原子處在被激發態,並以某一頻率將這些能量輻射出去。在電子和離子的複合作用下,也可以產生輻射。還可能通過非彈性碰撞把中性原子和分子的被激發輻射能變為動能。在電離層上部,光電子同其他電子的碰撞可引起電子的加熱。所有這些都使得電離層化學出現複雜情況。
光致電離是電離層化學反應的重要過程。除此之外,還有正離子同電子碰撞合成為中性成分的離解複合反應(AB++e→A+B)、離子原子交換反應(A娚+B→AB++A)和電荷轉移反應(A娚+B2→B娚+A2)等常見的電離層反應。輻射複合(A++e→A+hv)、 三體附著(e+A2+A2→A娛+A2)、離解附著(e+A2→A-+A)、離解光電離(A2+hv →A++A+e)、離解電荷轉移(A++B2→A+B+B+)。碰撞分離(A娛+A2→A2+A2+e)和光致分離(A-+hv →A+e)等反應也在某些層內遇到。
電離層的每個分層都有特定的離子化學和電子損失過程。在 D層,正離子和自由電子產生於NO和O2(1△g)的光致電離,而電子的損失主要取決於離解複合過程和電子的附著過程。動力過程在 D層起重要作用。因為電子生存時間很短,所以動力過程不是表現在直接帶走電子,而是通過中性成分影響電子濃度。在E層,離解複合仍然是重要的電子損失過程。在高電離層,電子和離子濃度不完全受光化學平衡支配,離子和電子的擴散速率同化學丟失速率相比擬。離子原子交換反應是F2層的典型過程。F2層的主要離子是原子的離子,因此離解光電離反應和離解電荷轉移反應居多。可以說,在高於90公里的高空,電子的丟失基本是NO+和O娚的離解複合造成的。在小於500公里左右的高空,只要質子含量不大,那么電離層化學就完全是氮氧及其化合物的離子化學。它們的化學反應圖式如圖3。 D層離子化學 D層是電離層最複雜的區域,這裡存在多種分子NO、O2(1△g)、CO2、H2O等,又有眾多正負離子和各種離子團,導致複雜的化學反應。這裡還有金屬離子。但主要是NO在太陽賴曼 α(Lα)輻射下光致電離產生的:
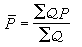 。
。
O娚+N2→NO+ +NO。
亞穩態氧分子O2(1△g)在太陽遠紫外的光致電離是 O娚離子的來源: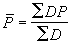 。
。
D層的負離子限於92公里以下,主要有O娛、Cl-、NO婣、CO婣、HCO婣、NO婣(H2O)n等,其中以O娛最重要,它是O2吸附電子的結果。在80公里以上,氧原子與臭氧O3之比超過1,這裡可以發生碰撞分離過程,生成O3。在82公里以上,NO+和O娚的離解複合是電子損失的主要原因。
E層離子化學 在E層同時存在大量中性成分和正離子。氮分子和氧分子濃度仍然比較高。氮原子 N( 4S)、N(2D)和NO在中性成分化學中起著重要作用。N2和 NO的光致離解反應產生大量氮原子,N娚同O間的離子原子交換反應和NO+的離解複合反應,以及快速光電子碰撞氮分子,也都產生氮原子。例如:
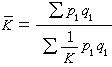 ,
,
NO++e→N(5S)【或N(2D)】+O。
另外,在120公里以下,依靠N(2D)同O2之間的原子互換反應產生NO。在太陽活動增強和極光時,E層的NO數量明顯增加。極光時,高磁緯E層有大量N(2D)產生,使這裡的NO濃度比中緯度上空高3~4倍。在160公里以下,由氮分子貢獻的氮離子較多。這是因為在這些高度上氮分子的密度還比較高,而氮分子可以被波長小於796埃的遠紫外線電離生成 N娚和電子。不過,生成的N娚很快同氧原子或氧分子作用生成 NO+或O娚(在130公里反應所需的時間為0.1秒)。O娚是光致電離產生的主要離子,但O娚同N(4S)或N(2D)之間的離子原子交換或電荷轉移反應也生成一部分NO+。結果,在E層居支配地位的離子是NO+和O娚。離解複合是這兩個離子損失的主要過程。這裡白天多數離子和電子的生存時間短於100秒,傳輸過程沒有大的影響。夜間,由於電子密度下降約兩個量級而使傳輸過程變得重要。
在95~115公里高空的Es層,金屬離子較多,主要為Mg+、Fe+、Na+、Ca+,而NO+濃度在Es層內比Es層外低。
F層化學 與D層和E層不同,F層的基本離子都是原了的離子。通常電子和離子分布偏離化學平衡分布。在F2層電子密度峰值處,離子和電子穿過中性成分擴散的速率,類似於離子在化學過程所丟失的速率。在這峰值以下,化學和熱平衡過程仍占優勢,在這峰值以上,擴散過程占優勢。
在 F1層,雖然光致電離形成了眾多的 O+、N娚、NO+、O娚及少量的N+和He+等,但中性成分總濃度仍較大。電子丟失速度同電子密度平方成正比。在F2層,中性成分總濃度明顯減少,原子的離子占優勢,主要是O+、N+、He+和H+。
O+是F層的重要離子,在F2層電子密度峰值處,它的數密度約為106厘米-3,在離子中居首位。它主要來源於氧原子被波長短於 910埃遠紫外線的光致電離。近年來發現:振動激發態的離子N娚*同氧原子之間的非共振電荷轉移反應是基態O+,即O+(4S)離子的重要來源:N娚*+O→O++N2。生成的 O+離子可以繼續完成同 O2之間的電荷轉移反應:O++O2→O娚*+O。在F1層,O娚*化學生存時間很短(100秒)。
亞穩態O+(2D)離子是決定熱層組成的重要離子。在10年前,根據火箭積累的3914埃輻射和光電子譜等資料發現:O+(2D)同N2之間的電荷轉移反應產生的N娚,是240公里以上N娚的主要來源。O+(2D)的重要源反應和匯反應是:
O+hv→O+(2D)+e,
O+e→O+(2D)+2e,
O+(2P)→O+(2D)+hv,
O+(2D)+e→O+(4S)+e,
O+(2D)+O→O+(4S)+O,
O+(2D)+O2→O+O2+,
O+(2D)+N2→N2++O。
此處,O+(2P)是亞穩態成分。極光和曙暮氣輝觀測多重譜線7320~7330埃表明:該亞穩態相當嚴重地被熱層大氣猝滅。O娚在F1層的產生和消除過程類似於E層,只是消除它的離子原子交換反應主要在O娚與 N(4S)之間進行。在F2層,O娚除產生於O+同O2之間的電荷轉移反應外,還可以來自亞穩態O+(2D)離子同O2之間的電荷交換,這在磁擾動時特別明顯。
N娚*(振動激發態)是F1層重要的亞穩態成分。
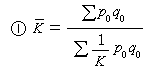
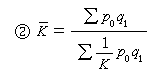 這兩個振動激發態輻射產生了極光中N娚第一負系(3914埃為主)和N娚邁納爾帶,是極光中最強的兩個帶系。
這兩個振動激發態輻射產生了極光中N娚第一負系(3914埃為主)和N娚邁納爾帶,是極光中最強的兩個帶系。 N娚離子在F1層產生的速率仍然較高,但消除速率比在E層慢。
NO+在 F層主要是電荷轉移反應O++N2→NO++N(4S)生成的F層的NO分子濃度很低,光致離解產生的NO+亦少。N+離子同O2分子間的電荷轉移反應也生成一部分NO+。
N+是N2的離解光電離反應和He+離子與N2之間的離解電荷轉移反應的結果。
He+離子大量存在於300公里以上的F2層。它是He原子光致電離的結果,而He是靠分子擴散到F2層的。He+丟失於它同N2或O2的離解電荷轉移反應。
H+離子是 H原子光致電離的結果。 熱層的氫原子最初來自中間層大氣,渦流擴散把氫原子傳輸到混合層頂105~110公里。分子擴散又使氫傳輸到外層。在F層,隨機共振電荷的轉移反應是十分重要的:
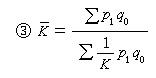 。正反應和逆反應都有較大的速率常數, 這就使得人們常能在400公里以下觀測到H+和O+之間的化學平衡。
。正反應和逆反應都有較大的速率常數, 這就使得人們常能在400公里以下觀測到H+和O+之間的化學平衡。 氫原子和氦原子具有較小的質量,而且,在F2層電子密度峰值以上區域擴散平衡過程占優勢,這就使得它們能達到外層很高的高度。這裡,中性成分密度很低,它們的分子自由程超過10公里,分子碰撞和化學反應的幾率很小,可能存在著極少量的亞穩態氫原子同氧原子間的化學反應。在1000~3000公里以上高空,占支配地位的成分是 H、H+和少量的He+、O+。它們的相對含量同太陽活動有關。
存在問題和展望 高層大氣化學的重要問題是化學成分的全球空間分布及其隨時間的變化,以及化學反應系統模式的建立。但進行研究的困難較多,如微量成分的多樣性和複雜性;與物理過程如擴散過程等耦合在一起;以及化學反應速率係數在實驗室不易精確測定等。新的探測手段,如雷射雷達和精密的法布里-珀羅干涉儀等的採用,將有力地促進高層大氣化學的研究。由於高層大氣化學過程和物理過程密切相關,研究高層大氣化學必將與物理過程結合進行,如與大氣熱平衡過程、擴散過程、氣輝現象、極光現象、大氣風場以及其他動力學過程結合進行綜合研究。
參考書目
M.J.McEwan and L.F.Phillips,Chemistry of theAtmosphere,Edward Arnold,London,1975.
J.W.Chamberlain,Theory of Planetary Atmospher,Academic Press,New York,1978.
D.G.Torr, Neutral and Ion Composition of the thermos phere, Review of Geophysics and Space Physics,Vol.21,p.245,1983.