定義
 | |
| 絡合物效應 | |
基本介紹
 | |
| 絡合物效應 | |
電子授受型絡合物的形成是由於一個電子或一個電子對從電子給體部分地轉移到電子受體。給體分為π給體和n給體。π給體通過其π電子與受體絡合,如烷烴、烯烴和芳香烴化合物等。n 給體則是通過孤獨電子對離域到受體的原子軌道而絡合,如含氧、氮和硫的有機化合物等。電子授受型絡合物形成速率遠遠大於一般的液相反應速率,而且只能用弛豫法或流動法進行測定。如果電子授受型絡合物由反應粒子和溶劑分子組成,則它將影響反應粒子的反應活性,即它們的溶劑化將直接影響反應的進程。這與溶劑的性質(如介電常數、偶極矩等)有關。如果由兩種反應粒子組成了絡合物,而且它就是複雜反應的中間物,則這種絡合物可以是弱電子授受型的非鍵結構,也可以是強電子授受型的電荷轉移絡合物。確定為後者時,必須知道介質是如何影響絡合平衡常數K的,因為此時反應速率常數k=k2K,即它不僅與絡合物的分解速率常數k2有關,而且與K成正比。顯然,隨著K值的增大,反應速率也增大。 表示除主反應以外,因其他絡合劑存在而引起的副反應時的副反應係數。通常用表示。當金屬離子與絡合劑的絡合反應是主反應時,如有另一絡合劑存在,可與形成絡合物,使主反革命應受到影響。值說明金屬離子總濃度是游離金屬離子濃度多少倍。即,此值越大,表示金屬離子被絡合得越完全,即副反應越嚴重。
概念介紹
 | |
| 絡合物效應 | |
絡合物complexcompound絡合物是由一些帶負電的基團或電中性的極性分子,同金屬離子或原子形成的配位鍵化合物。絡合物之一絡合物通常指含有絡離子的化合物,例如絡鹽[Ag(NH3)2]Cl、絡酸H2[PtCl6]、絡鹼[Cu(NH3)4](OH)2等;也指不帶電荷的絡合分子,例如[Fe(SCN)3]、[Co(NH3)3Cl3]等。配合物又稱絡合物。
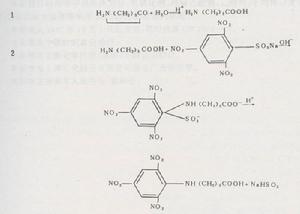
絡合物的組成以[Cu(NH3)4]SO4為例說明如下:
1、絡合物的形成體,常見的是過渡元素的陽離子,如Fe3+、Fe2+、Cu2+、Ag+、Pt2+等。
2、配位體可以是分子,如NH3、H2O等,也可以是陰離子,如CN-、SCN-、F-、Cl-等。
3、配位數是直接同中心離子(或原子)絡合的配位體的數目,最常見的配位數是6和4。
絡離子是由中心離子同配位體以配位鍵結合而成的,是具有一定穩定性的複雜離子。在形成配位鍵時,中心離子提供空軌道,配位體提供孤對電子絡離子比較穩定,但在水溶液中也存在著電離平衡,例如:
[Cu(NH3)4]2+Cu2++4NH3因此在[Cu(NH3)4]SO4溶液中,通入H2S時,由於生成CuS(極難溶)絡合物之二。含有絡離子的化合物屬於絡合物。白色的無水硫酸銅溶於水時形成藍色溶液,這是因為生成了銅的水合離子。銅的水合離子組成為[Cu(H2O)4]2+,它就是一種絡離子。膽礬CuSO4·5H2O就是一種絡合物,其組成也可寫為[Cu(H2O)4]SO4·H2O,它是由四水合銅(Ⅱ)離子跟一水硫酸根離子結合而成。在硫酸銅溶液里加入過量的氨水,溶液由藍色轉變為深藍。這是因為四水合銅(Ⅱ)離子經過反應,最後生成一種更穩定的銅氨絡離子[Cu(NH3)4]2+而使溶液呈深藍色。如果將此銅氨溶液濃縮結晶,可得到深藍色晶體[Cu(NH3)4]SO4,它叫硫酸四氨合銅(Ⅱ)或硫酸銅氨,它也是一種絡合物,又如,鐵的重要絡合物有六氰合鐵絡合物:亞鐵氰化鉀K4[Fe(CN)6](俗名黃血鹽)和鐵氰化鉀K3[Fe(CN)6](俗名赤血鹽)。這些絡合物分別含的六氰合鐵(Ⅱ)酸根[Fe(CN)6]4-絡離子和六氰合鐵(Ⅲ)酸根[Fe(CN)6]3-絡離子,它們是由CN-離子分別跟Fe2+和Fe3+絡合而成的。由以上例子可見:絡離子是由一種離子跟一種分子,或由兩種不同離子所形成的一類複雜離子。絡合物一般由內界(絡離子)和外界兩部分組成。內界由中心離子(如Fe2+、Fe3+、Cu2+、Ag+等)作核心跟配位體(如H2O、NH3、CN-SCN-、Cl-等)結合在一起構成。一個中心離子結合的配位體的總數稱為中心離子的配位數。絡離子所帶電荷是中心離子的電荷數和配位體的電荷數的代以[Cu(NH3)4]SO4為例,用圖示表示絡合物的組成如下:
絡合物的化學鍵:絡合物中的絡離子和外界離子之間是以離子鍵結合的;在內界的中心離子和配位體之間以配位鍵結合。組成絡合物的外界離子、中心離子和配位體離子電荷的代數和必定等於零,絡合物呈電中性、絡合物,絡合物又稱配位化合物。凡是由兩個或兩個以上含有孤對電子(或π鍵)的分子或離子作配位體,與具有空的價電子軌道的中心原子或離子結合而成的結構單元稱絡合單元,帶有電荷的絡合單元稱絡離子。電中性的絡合單元或絡離子與相反電荷的離子組成的化合物都稱為絡合物。習慣上有時也把絡離子稱為絡合物。隨著絡合化學的不斷發展,絡合物的範圍也不斷擴大,把NH+4、SO24-、MnO-4等也列入絡合物的範圍,這可稱作廣義的絡合物。一般情況下,絡合物可分為以下幾類:
1、單核絡合物,在1箇中心離子(或原子)周圍有規律地分布著一定數量的配位體,如硫酸四氨合銅[Cu(NH3)4]SO4六氰合鐵(Ⅱ)酸鉀K4[Fe(CN)6]、四羧基鎳Ni(CO)4等,這種絡合物一般無環狀結構。
2、螯合物(又稱內絡合物),由中心離子(或原子)和多齒配位體絡合形成具有環狀結構的絡合物,如二氨基乙酸合銅:螯合物中一般以五元環或六元環為穩定。
3、其它特殊絡合物,主要有:多核絡合物(含兩個或兩個以上的中心離子或原子),多酸型絡合物,分子氮絡合物,π-酸配位體絡合物,π-絡合物等。中心離子在絡合單元中,金屬離子位於絡離子的幾何中心,稱中心離子(有的絡合單元中也可以是金屬原子)。如[Cu(NH3)4]2+絡離子中的Cu2+離子,[Fe(CN)6]4-絡離子中的Fe2+離子,Ni(CO)4中的Ni原子等。價鍵理論認為,中心離子(或原子)與配位體以配位鍵形成絡合單元時,中心離子(或原子)提供空軌道,是電子對的接受體。配位體跟具有空的價電子軌道的中心離子或原子相結合的離子或分子。一般配位體是含有孤對電子的離子或分子,如Cl-、CN-、NH3、H2O等;如果一個配位體含有兩個或兩個以上的能提供孤對電子的原子,這種配位體稱作多齒配位體或多基配位體,如乙二胺:H2N—CH2—CH2—NH2,三乙烯四胺:H2N—C2H4—NH—C2H4—NH—C2H4—NH2等。此外,有些含有π鍵的烯烴、炔烴和芳香烴分子,也可作為配位體,稱π鍵配位體,它們是以π鍵電子與金屬離子絡合的。
維爾鈉配位理論
 | |
| 絡合物效應 | |
價鍵理論
 | |
| 絡合物效應 | |
晶體場理論
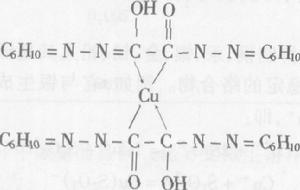 | |
| 絡合物效應 | |
1、中心離子原來簡併的d軌道在配位體電場的作用下,發生了能級分裂,有的能量升高,有的能量降低。分裂後,最高能量d軌道和最低能量d軌道之間的能量差叫分裂能。中心離子的d軌道能量在正八面體場中的分裂如下圖所示:中心離子的d軌道能量在正四面體場中的分裂如下圖所示:
2、分裂能Δ值的大小,主要受配位體的電場、中心離子的電荷及它屬於第幾過渡系等因素的影響。(3)使本來是自鏇平行分占兩個軌道的電子擠到同一軌道上去必會使[fontcolor=#0000ff]能量[/font]升高,這增高的能量稱為成對能,用Ep表示。在弱配位場中Δ<Ep,d電子儘可能占據較多的軌道且自鏇平行,形成高自鏇絡合物;在強配位場中Δ>Ep,d電子儘可能占據能量較低的軌道形成低自鏇絡合物。晶體場穩定化能在晶體場理論中將d電子從未分裂的d軌道進入分裂的d軌道所產生的總能量的下降值,稱為晶體場穩定化能(CFSE)。總能量下降愈多,即CFSE愈大(負值絕對值愈大),絡合物就愈穩定。
軌道理論
 | |
| 絡合物效應 | |
1、找出中心離子(原子)和配位體的價電子軌道,按所組成的分子軌道是σ軌道還是π軌道分組,分別稱為σ軌道和π軌道。
2、將配位體中的σ軌道和π軌道分別重新組合成若干新軌道,這些新軌道稱為群軌道,使得這些群軌道的對稱性分別與中心離子(原子)的各原子軌道相匹配。
3、將對稱性相同的中心離子(原子)的原子軌道和配位體的群軌道組合成分子軌道。絡合物的分子軌道理論可以得到和晶體場理論一致的結果,同時又能解釋光譜化學系列、有機烯絡合物的形成、羰基絡合物的穩定性等方面的問題。
例子介紹
 | |
| 絡合物效應 | |
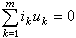
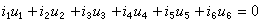
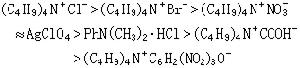
式中Ph為苯基。顯然,形成絡合物的能力強,有利於離解。目前要找到嚴格的定量關係還有困難。可用來說明反應物和溶劑分子形成氫鍵而影響了反應速率的一個很好的例子,是醚對苯酚烷基化反應的阻化作用。例如,在溶液中加入二氧雜環己烷或四氫呋喃,都會降低烷基化反應速率。前者與苯酚形成1∶2氫鍵型絡合物,後者形成1∶1型氫鍵化合物。