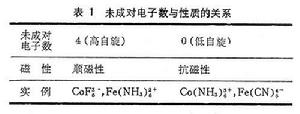
配位場理論
正文
配位場就是配位體對中心離子(這裡大多是指過渡金屬絡合物)作用的靜電勢場。由於配位體有各種對稱性排布,遂有各種類型的配位場,如四面體配位化合物形成的四面體場,八面體配位化合物形成的八面體場等。有三種理論用於說明和解釋配合物的結構和性能:價鍵理論、晶體場理論和分子軌道理論。由L.C.鮑林提出的價鍵理論,在說明配合物(或配離子)的幾何構型和磁學性質是很有效的(表1),但對含有較多的d電子的過渡金屬配合物的穩定存在和配合物的電子光譜卻不能給予滿意的解釋。因此,目前價鍵理論已基本不用了。而處理離子型配合物的晶體場理論和處理共價型配合物的分子軌道理論的結合成為配位場理論,在20世紀50年代以來得到迅速發展,用於討論過渡金屬配合物的物理化學性質。晶體場理論和分子軌道理論則是配位場理論的兩種極限情況。
 配位場理論
配位場理論在無配位場存在下的中心離子是自由的,其電子云分布是球形對稱的,五個d原子軌道處於同一個能級,這叫簡併態。當配合物形成,即存在配位場的作用下,這些d軌道能級就要發生分裂(即部分消除簡併),一部分能級處於比原能級高的位置,另一部分能級則處於比原能級低的位置,這稱為能級分裂。例如CoF咶配離子,在6個氟離子形成的八面體場作用下,過渡金屬離子的d軌道能級分裂為兩組(圖1 ),
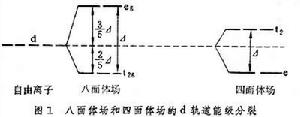 能級較高的一組有兩個d軌道(d
能級較高的一組有兩個d軌道(d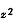 、d
、d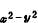 ),這組雙重簡併的d軌道用符號eg表示;另一組能級較低,有三個d軌道(dxy、dxz、dyz),用t2g標記。這兩組軌道的能級差用墹表示,稱為場分裂值。圖1表明八面體場和四面體場的d軌道能級分裂情況。不同對稱性的場分裂值墹是不同的,它的大小與中心離子和配位體的性質有關,按照理論計算和總結過渡金屬絡合物的電子光譜數據,可得出以下經驗規律:
),這組雙重簡併的d軌道用符號eg表示;另一組能級較低,有三個d軌道(dxy、dxz、dyz),用t2g標記。這兩組軌道的能級差用墹表示,稱為場分裂值。圖1表明八面體場和四面體場的d軌道能級分裂情況。不同對稱性的場分裂值墹是不同的,它的大小與中心離子和配位體的性質有關,按照理論計算和總結過渡金屬絡合物的電子光譜數據,可得出以下經驗規律: ① 當中心離子固定時,墹 隨下列配位體依次增加:
I-<Br-<SCN-<Cl-<F-<H2O<NCS-
<NH3<乙二胺<鄰聯吡啶<CN-
Mn2+<Co2+<Ni2+<V2+<Fe3+<Cr3+<Co3+<Ru3+
<Mo3+<Rh3+<Pd4+<Ir3+<Re4+<Pt4+
I<Br<Cl<S<F<O<N<C
墹值可用兩部分貢獻的乘積來表示:墹=f(配位體的貢獻)×g(中心離子的貢獻)
墹值大的稱為強場,墹值小的稱為弱場,這是對同一種對稱性的配位場而言的。對於不同對稱性的配位場的情況,按照晶體場理論計算得出以下典型的關係式:
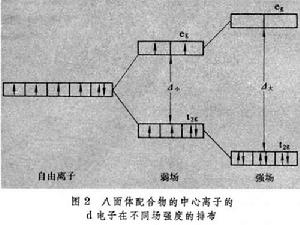
依據構成原子和分子的電子層結構的基本原理,討論弱場和強場下中心離子d電子的排布情況。例如,八面體配合物CoF咶、Fe(NH3)嵜和Co(NH3)扟、Fe(CH)忹的中心離子均為d6組態,在不同場強度的排布見圖2。
 配位場理論
配位場理論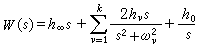 ,而處在eg軌道則貢獻
,而處在eg軌道則貢獻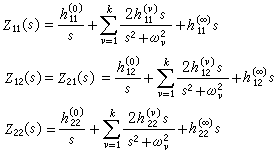 (5個d軌道權重平均值為零)。因此,對於八面體場
(5個d軌道權重平均值為零)。因此,對於八面體場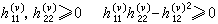 組態和四面體場的
組態和四面體場的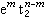 組態的配位場穩定化能(表2)用以下兩個公式計算:
組態的配位場穩定化能(表2)用以下兩個公式計算: 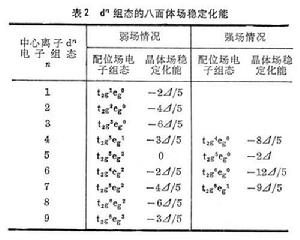 配位場理論
配位場理論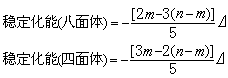
楊-特勒畸變 如果一個非線形分子處於軌道簡併態,則該分子要發生變形,使簡併消除。這表明楊-特勒畸變引起附加的穩定化能使配合物穩定。有些配合物原來就不是嚴格的正多面體配位或者由於配位原子在平衡位置振動而偏離正多面體配位,產生靜態扭歪。扭歪的八面體有兩種構型,即沿四次軸拉長或縮短。例如,Cu2+(d9)的八面體配合物ML6,其中心離子的電子組態為t
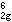 e
e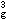 ,三個eg電子有
,三個eg電子有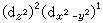 和
和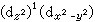 兩種分布方式,前者表明z軸方向的電子密度比xy平面的x,y方向高,更有效地禁止核電荷與配位體的作用,因此,z軸方向配位體與中心離子的靜電作用能較小,就產生向z軸方向拉長的畸變。同樣對 (d
兩種分布方式,前者表明z軸方向的電子密度比xy平面的x,y方向高,更有效地禁止核電荷與配位體的作用,因此,z軸方向配位體與中心離子的靜電作用能較小,就產生向z軸方向拉長的畸變。同樣對 (d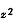 )1(d
)1(d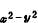 )2組態分析,則出現沿z 軸方向縮短的畸變。多面體產生各種畸變現象稱為楊-特勒效應。
)2組態分析,則出現沿z 軸方向縮短的畸變。多面體產生各種畸變現象稱為楊-特勒效應。 分子軌道理論 如果是中心離子和配位場之間有顯著重疊的共價配合物,要更真實地反映其化學鍵性質,必須採用分子軌道理論。
對於ML6的八面體配合物, 中心離子的一個s、三個p和兩個d原子軌道與6個配位體的σ軌道結合, 組成6個σ成鍵軌道和6個σ*反鍵軌道。過渡金屬的d電子則處於t2g非鍵軌道或部分在弱反鍵e
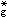 軌道上。另外,當配位體可能進一步提供p軌道,與中心離子t2g軌道形成π成鍵和π*反鍵軌道(圖3)
軌道上。另外,當配位體可能進一步提供p軌道,與中心離子t2g軌道形成π成鍵和π*反鍵軌道(圖3)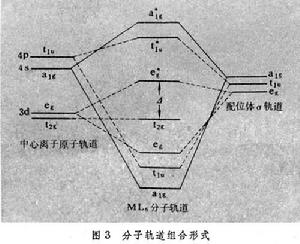 時,中心離子的s、p、d軌道和配位體的σ軌道都按八面體對稱性分類為單重、雙重和三重簡併軌道a1g、 eg、t1u。相同對稱性的中心離子的原子軌道和配位體σ軌道組合為分子軌道,其分子軌道組合形式和能級次序如圖3所示。如果把配合物分子的價電子按以上能級圖依序填入,可得配合物的電子組態。金屬離子原子軌道和配位體軌道對其分子軌道組成的貢獻不一定是等同的。如果配位體軌道貢獻大,則占據該分子軌道的電子主要體現配位體的性質;反之,則體現金屬離子的性質。
時,中心離子的s、p、d軌道和配位體的σ軌道都按八面體對稱性分類為單重、雙重和三重簡併軌道a1g、 eg、t1u。相同對稱性的中心離子的原子軌道和配位體σ軌道組合為分子軌道,其分子軌道組合形式和能級次序如圖3所示。如果把配合物分子的價電子按以上能級圖依序填入,可得配合物的電子組態。金屬離子原子軌道和配位體軌道對其分子軌道組成的貢獻不一定是等同的。如果配位體軌道貢獻大,則占據該分子軌道的電子主要體現配位體的性質;反之,則體現金屬離子的性質。 電荷遷移光譜 如果上述分子軌道的電子產生躍遷,則出現電子光譜;電子由主要為配位體特性的分子軌道躍遷到主要為金屬離子特性的分子軌道或相反情況,相當於電荷由配位體遷移到金屬離子或相反情況,則出現電荷遷移光譜。例如,ML6配合物可能有三種電荷遷移光譜帶的電子躍遷:
① 配位體與金屬離子只形成σ鍵,可能有σ→t2g和σ→e壛躍遷,可與金屬還原帶聯繫起來。
② 配位體與金屬離子形成σ和π鍵,可能有σ→t2g和σ→e壛以及π→t2g和π→e壛兩類躍遷,也是相當於金屬還原帶。
③ 配位體有未占據的反鍵軌道π*,金屬離子反饋電子到配位體,除了可能有σ→t2g和σ→e壛躍遷外,還有t2g→π*或e壛→π*躍遷,這相當於金屬氧化帶。
顯然,分子軌道理論解釋電荷遷移光譜是十分成功的。分子軌道理論在處理配合物結構和說明它的物理性質、化學性質上,比晶體場理論略高一籌。20世紀50年代以後,對配合物進行了大量的分子軌道理論計算,採用了非經驗的自洽場從頭算和xα方法以及半經驗的全略微分重疊、間略微分重疊等量子化學計算方法。
隨著無機和有機配合物合成的日益增多和各種結構與性能的研究,配位場理論不斷發展,成為近代重要的化學鍵理論之一,是理論物理和理論化學的一個重要分支。它在解釋配位化合物的結構與性能關係、催化反應機理,雷射物質的工作原理以及晶體的物理性質等方面都得到廣泛的套用。
