有機化學結構理論
正文
闡述形成有機分子的原子在分子中相互結合、相互影響,以及它們與該化合物性質之間的相互關係的學科。19世紀初期,開始了結構理論的研究。1828年F.維勒和J.von 李比希認識到每一個化合物都有一定的組成。瑞典化學家J.J.貝采利烏斯1827年提出了同分異構現象的概念,並且指出異構體的不同是與分子中各個原子結合的不同而產生的,把這種不同的結合叫做結構。這是結構理論的開端。
原子價學說 1858年德國化學家F.A.凱庫勒和英國化學家A.S.庫珀同時分別引入了原子價的概念,提出了“原子價學說”。並根據碳、氫、氮等元素的原子價,提出在有機化合物中碳原子可以相互結合成鏈,形成碳鏈學說。
凱庫勒和庫珀闡明了無論在簡單還是複雜的化合物中,碳原子與其他原子的數目總保持著一定的比例。例如,在甲烷CH4、四氯化碳CCl4、氯仿CHCl3中都是由一個碳原子與四個其他原子結合。凱庫勒認為每一種原子都有一定的“化合力”,並且把這種化合力叫做價。假定氫是一價的,則碳在以上四個化合物中都是四價的。凱庫勒提出用短線表示原子的價,例如:
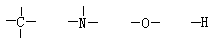
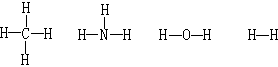
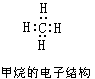
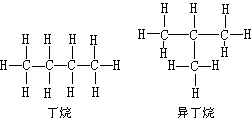
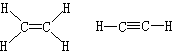
 )。1865年凱庫勒又將這個理論套用到芳香族化合物中,提出了在芳香族化合物中,碳原子形成環狀結構;並提出苯的凱庫勒結構式。
)。1865年凱庫勒又將這個理論套用到芳香族化合物中,提出了在芳香族化合物中,碳原子形成環狀結構;並提出苯的凱庫勒結構式。 由於當時無法直接測定有機分子靜態時的結構,凱庫勒認為通過化學反應了解的這些式子只是表示一個分子的化學性能,僅代表某一反應前和反應後結構上的差別。一個化合物可以發生不同的反應也就應該有不同的式子。庫珀則在表示有機化合物的結構時,僅僅由元素的原子價概念出發,而忽略了化學性質。因而凱庫勒和庫珀在結構理論上雖然取得了不可磨滅的功績,但是他們對分子結構的本質並沒有明確的概念。
布特列洛夫的結構學說 1861年俄國化學家Α.М.布特列洛夫指出,物質成分中的每一個分子不是原子的簡單堆積,而是原子按一定排列順序的化學結合;原子之間有複雜的化學力相互作用著,這種化學力作用的分配,便叫作物質的化學結構。布特列洛夫明確指出一個分子只有一個結構,由化合物的化學性質可以推斷化學結構;反之,通過化學結構也可以預見分子的化學性質。布特列洛夫還通過實踐合成了叔丁醇,補足了丁醇四種異構體的一個,進一步驗證了結構學說的正確性。
碳原子的四面體結構假說 1874年, 荷蘭的J.H.范托夫和法國的J.-A.勒貝爾 將鏇光異構體(見鏇光異構)的數目與空間結構聯繫起來,提出碳原子具有四面體結構的假說,闡明了碳原子與其他四個原子(或基團)結合時, 碳原子位於一個正四面體的中央,四個原子(或基團)位於四面體的角頂。如果碳原子連線的四個原子(或基團)不相同時,則產生實體和鏡像不相同的一對,有鏇光異構體存在,產生鏇光異構現象。這個假說奠定了立體化學的基礎。
幾何異構現象理論 1887年 J.A.威斯利采努斯和1888年A.von拜耳根據范托夫觀察到的順丁烯二酸可以形成酸酐,反丁烯二酸不能形成酸酐,而只有轉變成順丁烯二酸後才能形成酸酐的特點,提出幾何異構現象的理論,建立了幾何結構的觀念。
1885年C.拉爾研究了乙醯乙酸乙酯的特性,明確了互變異構現象。
 電子-模型圖
電子-模型圖 ① 電子配對法,又稱價鍵法,是在W.H.海特勒和F.W.倫敦處理氫分子的基礎上發展起來的。電子配對法認為,自鏇相反的成單的電子相互接近時,可以相互配對,形成穩定的化學鍵。這樣構成的化學鍵叫做共價鍵。如果一個原子有幾個未成對電子,便可以和幾個自鏇相反的電子相互配對成鍵,因而一個原子有n個未成對電子,它的化合價數就是n。
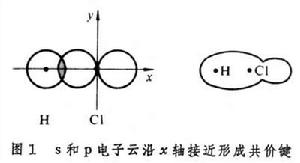
自鏇相反的兩個電子相互結合成鍵時,成鍵電子的原子軌道重疊愈多,則電子云密度愈大,形成的共價鍵就愈牢固。這樣,共價鍵的形成在可能範圍內採取電子云密度最大的方向。例如,H的1s電子云與Cl的3px電子云重疊,H和Cl沿x軸相互接近,結合成穩定的分子(圖1)。這樣形成的共價鍵叫 σ鍵,由於軌道重疊的結果,電子云有圓柱狀的軸對稱。電子配對法也適用於多原子分子,如四價碳化物。
 有機化學結構理論
有機化學結構理論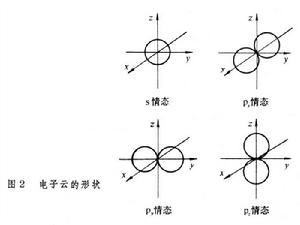 有機化學結構理論
有機化學結構理論 有機化學結構理論
有機化學結構理論 有機化學結構理論
有機化學結構理論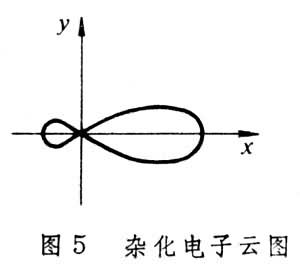 有機化學結構理論
有機化學結構理論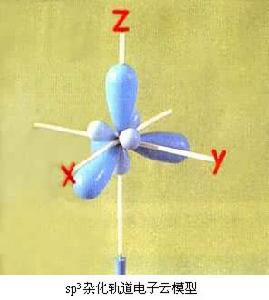 有機化學結構理論
有機化學結構理論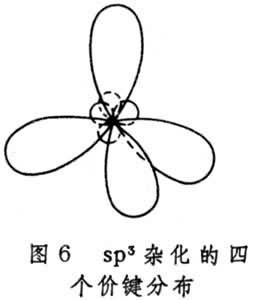 有機化學結構理論
有機化學結構理論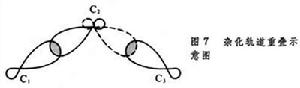 有機化學結構理論
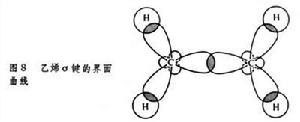
有機化學結構理論在形成烯鍵的過程中,每個碳原子的一個s電子和兩個p電子雜化,形成sp2 電子云,與所結合的原子或原子團形成3個σ鍵,在同一平面里,互成120°夾角(圖8)。兩個碳原子各自剩餘的一個電子,未經雜化,依兩個“8”字形的p軌道相互結合,形成π鍵。形成π鍵的兩個p軌道相互平行, 在與σ鍵垂直的方向,均等地分布於σ鍵所占平面的上下(圖9)。π 鍵的電子軌道在它們相互平行時軌道重疊部分最大。沿C─C鍵鏇轉則使兩個π 電子軌道離開平行狀態,因而π電子的結合對鏇轉有阻礙作用。
 有機化學結構理論
有機化學結構理論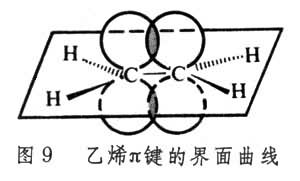 有機化學結構理論
有機化學結構理論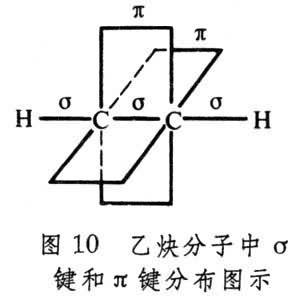 有機化學結構理論
有機化學結構理論② 分子軌道理論認為原子相互結合形成分子以後,價電子不再定域於個別原子之內,而運動於整個分子之中。分子軌道理論用原子軌道線性組合表示分子軌道。用狀態函式ψ來描述分子中每個電子的運動狀態,ψ就是分子軌道。ψ2 dτ表示該電子在微體積dτ內的幾率,而ψ2 則為幾率密度(又稱電子云密度)。以Ei代表每一個分子軌道ψi相應的能量, 則Ei近似地表示在該軌道上的電子電離時所需的能量。假設分子的總能量E 等於被電子占據著的分子軌道的能量的總和,如果ψi被兩個電子所占據,它的能量Ei應該計算兩次,即:
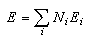
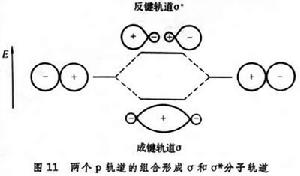
分子軌道是由原了軌道組合形成的。一個填充了的軌道最多能有兩個電子。兩個能量相同的原子軌道的組合,形成兩個分子軌道,其中一個能量比原子軌道能量低,叫成鍵軌道;另一個能量比原子軌道能量高,叫反鍵軌道。對於C-C的σ 鍵,代表原子軌道之間成鍵的和反鍵的符號是:兩個(+)葉瓣之間的作用是成鍵(σ軌道);一個(+)和一個(-)葉瓣之間的作用是反鍵(σ* 軌道)。符號不連續。
在這裡的描繪中,軌道保持其在雜化原子軌道中的形狀,但它們不是定量地代表所形成C─C鍵中電子密度的分布。這裡相互作用的特徵是成鍵軌道和反鍵軌道之間在對稱性上的區別。對垂直於兩個碳原子之間的軸的平面,成鍵軌道是對稱的(S),而反鍵軌道是反對稱的(A)(圖11)。
 有機化學結構理論
有機化學結構理論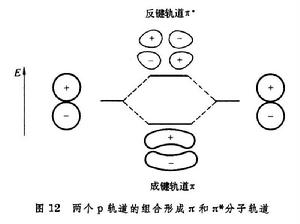 有機化學結構理論
有機化學結構理論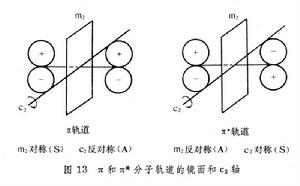 有機化學結構理論
有機化學結構理論這兩種軌道(成鍵和反鍵)的區別也在於它們在對稱性上的不同。圖13里有兩個鏡面(m2),一個平分軌道(在分子平面里),另一個與 C─Cσ鍵垂直(與分子平面垂直並平分分子),和一個通過C─C鍵中心的二重鏇轉軸c2。借用兩個獨立的對稱操作可以辨明π軌道和π* 軌道。π軌道對鏡面m2是對稱的(S),而圍繞c2軸鏇轉是反對稱的(A)。與此相對應的π* 軌道對m2是反對稱的(A),圍繞c2軸是對稱的(S)。
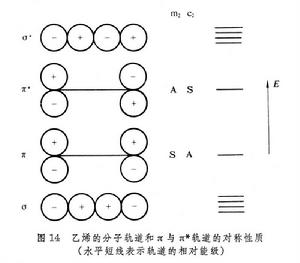
兩個2pz軌道間的重疊,比包含在σ 相互作用中的重疊小,所以π鍵也比σ鍵弱。同時,π與π* 能級比σ能級提高,比σ* 能級降低(圖14)。
 有機化學結構理論
有機化學結構理論20世紀60年代以來,一方面在量子力學的基礎上不斷改進分子軌道的計算方法,與計算機相配合,已得到許多準確的數據,如分子中原子上的電子密度、原子間的距離和鍵角等;另一方面,用近代物理技術的方法測量這些數據,在某些場合,是完全吻合的。1935年開始,化學家們還從熱力學的推導和試驗的數據,論證了分子中不以價鍵直接相連的各原子間的相互關係,提出了以單鍵相連的兩原子間的鏇轉能引起同分異構現象,這部分內容由D.H.R.巴頓於1950年總結在他提出的構象分析的理論之中。為分子的形象提出了新的概念,對許多以前不理解的現象也得到闡明,並且有很強的預見性,在有機化學和其有關科學中,有著極為深遠的意義。
參考書目
高振衡編:《物理有機化學》,人民教育出版社,北京,1982。
J. B. Hendrickson, D. J. Cram and G. S.Hammond,Organic Chemistry, 3rd ed.,McGraw-Hill, New York,1970.
L. N. Ferguson,The Modern Structural Theory ofOrganic Chemistry,Prentice-Hall,New Jersey,1963.
L.Pauling,The Nature of the Chemical Bond, 3rd ed.,Cornell Uuiv. Press, Ithaca, 1960.
