研究歷史
氫氧化鈉在很早以前就以鹼性物質為人們熟知。
1787年,醫生NicolasLeblanc(1762-1806)發明了用食鹽製取氫氧化鈉的合適工藝,並進行了大規模生產。
1887年,瑞典化學家阿倫尼烏斯創立了酸鹼電離理論(即水溶液酸鹼理論),他提出酸即在水溶液中凡是電離產生的陽離子全部都是氫離子的物質,鹼即在水溶液中凡是電離產生的陰離子全部都是氫氧根離子的物質。
從此氫氧化鈉的鹼性得到了明確的定義。
理化性質
物理性質
氫氧化鈉為白色半透明結晶狀固體。
其水溶液有澀味和滑膩感。
吸水性(潮解性)
液態氫氧化鈉沒有吸水性。
溶解性
極易溶於水,溶解時放出大量的熱。
氫氧化鈉在水中的溶解度變化如下:
| 溫度(°C) | 溶解度(g/100mL) |
|---|---|
| 0 | 42 |
| 10 | 51 |
| 20 | 109 |
| 30 | 119 |
| 40 | 129 |
| 50 | 145 |
| 60 | 174 |
| 70 | 299 |
| 80 | 314 |
| 90 | 329 |
| 100 | 347 |
化學性質
鹼性
氫氧化鈉溶於水中會完全解離成鈉離子與氫氧根離子,所以它具有鹼的通性。
它可與任何質子酸進行酸鹼中和反應(也屬於複分解反應):
NaOH+HCl=NaCl+H₂O
2NaOH+H₂SO₄=Na₂SO₄+2H₂O
NaOH+HNO₃=NaNO₃+H₂O
NaOH+NH₄Cl=NaCl+NH₃·H₂O
2NaOH+CuSO₄=Cu(OH)₂↓+Na₂SO₄
2NaOH+MgCl₂=2NaCl+Mg(OH)₂↓
ZnCl2+4NaOH(過量)=Na2[Zn(OH)4]+2NaCl
氫氧化鈉在空氣中容易變質成碳酸鈉(Na₂CO₃),因為空氣中含有酸性氧化物二氧化碳(CO₂):
2NaOH+CO₂=Na₂CO₃+H₂O這也是其鹼性的體現。
倘若持續通入過量的二氧化碳,則會生成碳酸氫鈉(NaHCO₃),俗稱為小蘇打,反應方程式如下所示:
Na₂CO₃+CO₂+H₂O=2NaHCO₃
同樣,氫氧化鈉能與像二氧化矽(SiO₂)、二氧化硫(SO₂)等酸性氧化物發生反應:
2NaOH+SiO₂=Na₂SiO₃+H₂O
2NaOH+SO₂(微量)=Na₂SO₃+H₂O
NaOH+SO₂(過量)=NaHSO₃(生成的Na₂SO₃和水與過量的SO₂反應生成了NaHSO₃)
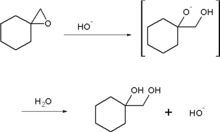 鹼催化環氧烷開環舉例
鹼催化環氧烷開環舉例有機反應
許多的有機反應中,氫氧化鈉也扮演著類似催化劑的角色。
最具代表性的莫過於皂化反應:RCOOR'+NaOH=RCOONa+R'OH
也可催化許多其他反應,如環氧烷開環、鹵仿反應等:I2+NaOH+R(CH3)C=O→R-COONa+CHI3(生成碘仿)
氫氧化鈉可以和鹵代烴等發生親核取代反應,如:CH3CH2Cl+NaOH→CH3CH2OH+NaCl
也可能使鹵代烴發生消除:CH3CH2Cl+NaOH→CH2=CH2+NaCl+H2O
氫氧化鈉在強熱下可以使羧酸發生脫羧反應,例如:R-COONa+NaOH→RH+Na2CO3[8]
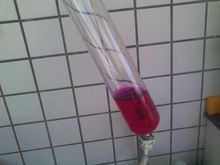 氫氧化鈉溶液滴入酚酞試液後變紅
氫氧化鈉溶液滴入酚酞試液後變紅顏色反應
它能與指示劑發生反應:
氫氧化鈉溶液滴入酚酞試液後變紅
其他反應
1986年,英國有一油罐車誤裝載重量百分率濃度為25%的氫氧化鈉水溶液,氫氧化鈉便與油罐壁的鋁產生化學變化,導致油罐因內部壓力過載而永久受損。
反應方程式如下所示:2Al+2NaOH+6H₂O=2Na[Al(OH)₄](四羥基合鋁酸鈉)+3H₂↑註:四羥基合鋁酸鈉可認為是偏鋁酸鈉與2個水結合的產物
矽也會與氫氧化鈉反應生成氫氣,如:Si+2NaOH+H₂O=Na₂SiO₃+2H₂↑
氫氧化鋁的製備也牽涉到氫氧化鈉的使用:6NaOH+2KAl(SO₄)₂=2Al(OH)₃↓+K₂SO₄+3Na₂SO₄
註:Al(OH)₃(氫氧化鋁)為一種常用於除去水中雜質的膠狀凝聚劑。
因過渡金屬的氫氧化物大都不太溶於水,且氫氧化鋁表面的面積大可以吸附小微粒,故於自來水中添加明礬(KAl(SO4)2·12H2O)可促使過渡金屬以氫氧化物的形式沉澱析出,再利用簡單的過濾設備,即可完成自來水的初步過濾。
氫氧化鋁可用於製取明礬(KAl(SO4)2·12H2O):將氫氧化鋁溶於硫酸,再加入計量的硫酸鉀溶液加熱反應、經過濾、濃縮、結晶、離心分離、乾燥,製得硫酸鋁鉀成品。
淨水詳細原理是明礬在水中可以電離出兩種金屬離子:KAl(SO4)2=K++Al3++2SO42-,而Al3+很容易生成膠狀的氫氧化鋁Al(OH)3:Al3++3H2O≒Al(OH)3+3H+,氫氧化鋁膠體的吸附能力很強,可以吸附水裡懸浮的雜質,並形成沉澱,使水澄清。
製備方法
實驗室製法
 氫氧化鈉
氫氧化鈉鈉鹽與氧化鈣反應
可以用一些碳酸氫鈉(小蘇打)和一些氧化鈣(生石灰)。
把生石灰放於水中,反應後變為石灰漿(氫氧化鈣溶液、熟石灰),把碳酸氫鈉(或碳酸鈉)的固體顆粒(濃溶液也行)加入石灰漿中,為保證產物氫氧化鈉的純度,需使石灰漿過。
原因:參考氫氧化鈣和碳酸鈉的溶解度。攪拌加快其反應,待其反應一會兒後,靜置片刻,隨著碳酸鈣的沉澱,上層清液就是氫氧化鈉溶液,小心倒出即可。(切記倒出後稱量時不能放在濾紙上!)
CaO+H₂O=Ca(OH)₂
NaHCO₃+Ca(OH)₂=CaCO₃↓+NaOH+H₂O(推薦)
Ca(OH)₂+Na₂CO₃=CaCO₃↓+2NaOH
鈉與水反應
取一塊金屬鈉,擦去表面煤油,颳去表面氧化層,放入盛有水的燒杯中。
2Na+2H₂O=2NaOH+H₂↑
現象:(浮、熔、游、響)
浮:鈉浮在水面上;
熔:鈉熔化成小球;
游:鈉在水面上遊動,因為有氫氣生成;
響:鈉噝噝作響,因為有氫氣生成。
工業製法
苛化法
將純鹼、石灰分別經化鹼製成純鹼溶液、石灰製成石灰乳,於99~101℃進行苛化反應,苛化液經澄清、蒸發濃縮至40%以上,製得液體燒鹼。將濃縮液進一步熬濃固化,製得固體燒鹼成品。
苛化泥用水洗滌,洗水用於化鹼。
Na2CO3+Ca(OH)2=2NaOH+CaCO3↓
隔膜電解法
將原鹽化鹽後加入純鹼、燒鹼、氯化鋇精製劑除去鈣、鎂、硫酸根離子等雜質。
再于澄清槽中加入聚丙烯酸鈉或苛化麩皮以加速沉澱,砂濾後加入鹽酸中和,鹽水經預熱後送去電解。
電解液經預熱、蒸發、分鹽、冷卻,製得液體燒鹼,進一步熬濃即得固體燒鹼成品。
鹽泥洗水用於化鹽。
2NaCl+2H2O[電解]=2NaOH+Cl2↑+H2↑
離子交換膜法
將原鹽化鹽後按傳統的辦法進行鹽水精製,把一次精鹽水經微孔燒結碳素管式過濾器進行過濾後,再經螫合離子交換樹脂塔進行二次精製,使鹽水中鈣、鎂含量降到0.002%以下。
將二次精製鹽水電解,於陽極室生成氯氣,陽極室鹽水中的Na+通過離子膜進入陰極室與陰極室的OH生成氫氧化鈉,H+直接在陰極上放電生成氫氣。
電解過程中向陽極室加入適量的高純度鹽酸以中和返遷的OH-,陰極室中應加入所需純水。
在陰極室生成的高純燒鹼濃度為30%~32%(質量),可以直接作為液鹼產品,也可以進一步熬濃,製得固體燒鹼成品。
2NaCl+2H₂O=2NaOH+H₂↑+Cl₂↑
檢測方法
實驗室測定
 甲基橙
甲基橙方法名稱:氫氧化鈉—氫氧化鈉的測定—中和滴定法。
套用範圍:該方法採用滴定法測定氫氧化鈉的含量。
該方法適用於氫氧化鈉。
實驗原理:利用酸鹼指示劑在溶液pH值不同時顯現不同顏色的特性,用酸調整試樣溶液的pH至特定值時,通過消耗酸的量計算出試樣中氫氧化鈉的量與變質的量。
試劑:
1、水(新沸放冷);
2、硫酸滴定液(0.1mol/L);
3、酚酞指示液;
4、甲基橙指示液:取甲基橙0.1g,加水100mL使溶解,即得。
儀器設備:酸式滴定管、分析天平、容量瓶、錐形瓶、鐵架台、移液管。
操作步驟:供試品加新沸過的冷水適量使溶解後,放冷,用水稀釋至刻度,搖勻,精密量取25mL,加酚酞指示液3滴,用硫酸滴定液(0.1mol/L)滴定至紅色消失,記錄消耗硫酸滴定液(0.1mol/L)的容積(mL),加甲基橙指示液2滴,繼續加硫酸滴定液(0.1mol/L)至顯持續的橙紅色,根據前後兩次消耗硫酸滴定液(0.1mol/L)的容積(mL),算出供試量中的鹼含量(作為NaOH計算)並根據加甲基橙指示液後消耗硫酸滴定液(0.1mol/L)的容積(mL),算出供試量中Na₂CO₃的含量。
註:“精密稱取”系指稱取重量應準確至所稱取重量的千分之一,“精密量取”系指量取體積的準確度應符合國家標準中對該體積移液管的精度要求。
變質檢驗
NaOH變質後會生成Na₂CO₃
化學方程式:2NaOH+CO₂=Na₂CO₃+H₂O
1、樣品中滴加過量稀鹽酸若有氣泡產生,則氫氧化鈉變質。
原理:2HCl+Na₂CO₃=2NaCl+CO₂↑+H₂O
(空氣中含有少量的CO₂,而敞口放置的NaOH溶液能夠與CO₂反應,生成Na₂CO₃和H₂O從而變質;HCl中的H+能夠與Na₂CO₃中的CO32-離子反應生成CO₂氣體和H₂O,通過氣泡產生這個現象來檢驗變質)
註:HCl會優先與NaOH反應生成NaCl和H₂O。因為NaOH是強鹼,而Na₂CO₃是水溶液顯鹼性。
2、樣品中滴加澄清石灰水,若有白色沉澱生成,則氫氧化鈉變質。
原理:Na₂CO₃+Ca(OH)₂=CaCO₃↓+2NaOH
3、樣品中加氯化鋇,若有白色沉澱生成,則氫氧化鈉變質。
原理:Na₂CO₃+BaCl₂=BaCO₃↓+2NaCl
4、檢驗氫氧化鈉部分變質:
①加入過量BaCl₂或Ba(NO₃)2至完全沉澱,證明有Na₂CO₃產生,待沉澱完全靜止後,取上層清液於試管內,滴加無色酚酞溶液,酚酞變紅,則證明有NaOH。
註:不滴加NH₄Cl,因為Na₂CO₃溶於水後呈鹼性是因為會有OH¯根離子,NH₄+與OH¯跟結合也會有刺激性氣味,無法區分是原有氫氧化鈉導致還是碳酸鈉導致。
②在NaOH中加入過量CaCl2:
若有白色沉澱生成,則說明NaOH變質。
加入無色酚酞,若無色酚酞不變色,則說明完全變質。
若無色酚酞變紅,說明部分變質。
套用領域
氫氧化鈉(NaOH)的用途極廣。
用於生產紙、肥皂、染料、人造絲,冶鍊金屬、石油精製、棉織品整理、煤焦油產物的提純,以及食品加工、木材加工及機械工業等方面。
化學實驗
 氫氧化鈉
氫氧化鈉可以用作化學實驗。除了用做試劑以外,由於它有很強的吸水性和潮解性,還可用做鹼性乾燥劑。
也可以吸收酸性氣體(如在硫在氧氣中燃燒的實驗中,氫氧化鈉溶液可裝入瓶中吸收有毒的二氧化硫)。
中性、鹼性氣體中混有CO₂,可用NaOH除雜,生成Na₂CO₃(碳酸鈉)和H₂O(生成的Na₂CO₃溶於H₂O中):
CO₂+2NaOH=Na₂CO₃+H₂O;H2O+CO2+Na2CO3=2NaHCO3
化學工業
氫氧化鈉在國民經濟中有廣泛套用,許多工業部門都需要氫氧化鈉。
使用氫氧化鈉最多的部門是化學藥品的製造,其次是造紙、煉鋁、煉鎢、人造絲、人造棉和肥皂製造業。
另外,在生產染料、塑膠、藥劑及有機中間體,舊橡膠的再生,制金屬鈉、水的電解以及無機鹽生產中,製取硼砂、鉻鹽、錳酸鹽、磷酸鹽等,也要使用大量的燒鹼。
同時氫氧化鈉是生產聚碳酸酯、超級吸收質聚合物、沸石、環氧樹脂、磷酸鈉、亞硫酸鈉和大量鈉鹽的重要原材料之一。
生產洗滌劑
 氫氧化鈉
氫氧化鈉肥皂是燒鹼最古老和最廣泛的用途。
氫氧化鈉一直被用於傳統的生活用途。直到今天,肥皂、香皂和其它種類的洗滌用品對燒鹼的需求量依然占燒鹼的15%左右。
脂肪和植物油的主要成分是三酸甘油酯(三醯甘油),它的鹼水解方程式為:
(RCOO)3C3H5(油脂)+3NaOH=3(RCOONa)(高級脂肪酸鈉)+C3H8O3(甘油)
該反應為生產肥皂的原理,故得名皂化反應。
R基可能不同,但生成的R-COONa都可以做肥皂。
常見的R-有:
C17H33-:8-十七碳烯基。R-COOH為油酸。
C15H31-:正十五烷基。R-COOH為軟脂酸。
C17H35-:正十七烷基。R-COOH為硬脂酸。
洗滌劑:氫氧化鈉被用於生產各種洗滌劑,甚至如今的洗衣粉(十二烷基苯磺酸鈉等成分)也是由大量的燒鹼製造出來的,燒鹼被用於磺化反應後對過剩的發煙硫酸進行中和。
造紙
氫氧化鈉在造紙工業中發揮著重要的作用。
由於其鹼性特質,它被用於煮和漂白紙頁的過程。
造紙的原料是木材或草類植物,這些植物里除含纖維素外,還含有相當多的非纖維素(木質素、樹膠等)。
加入稀的氫氧化鈉溶液可將非纖維素成分溶解而分離,從而製得以纖維素為主要成分的紙漿。
人造纖維和紡織
人造纖維如人造棉、人造毛、人造絲等,大都是粘膠纖維,它們是用纖維素、氫氧化鈉、二硫化碳(CS2)為原料製成粘膠液,經噴絲、凝結而製得。
在紡織工業中,氫氧化鈉被用於纖維的處理和染色,且用於對棉纖維進行絲光處理。棉織品用燒鹼溶液處理後,能除去覆蓋在棉織品上的蠟質、油脂、澱粉等物質,同時能增加織物的絲光色澤,使染色更均勻。
精鍊石油
石油產品經硫酸洗滌後還含有一些酸性物質,必須用氫氧化鈉溶液洗滌,再經水洗,才能得到精製產品。
食品工業
我國《食品添加劑使用衛生標準》(GB2920-1996)規定:可作加工助劑,按生產需要適量使用。
氫氧化鈉可以被廣泛使用於下列生產過程:
容器的清洗過程;澱粉的加工過程;羧甲基纖維素的製備過程;谷氨酸鈉的製造過程。
水處理
氫氧化鈉被廣泛套用於水處理。
在污水處理廠,氫氧化鈉可以通過中和反應減小水的硬度。
在工業領域,是離子交換樹脂再生的再生劑。氫氧化鈉具有強鹼性,且在水中具有相對高的可溶性。
由於氫氧化鈉在水中具有相對高的可溶性,所以容易衡量用量,可以方便地在水處理的各個領域使用。
氫氧化鈉被使用在水處理方面的如下課題:消除水的硬度;調節水的pH值;對廢水進行中和;通過沉澱消除水中重金屬離子;離子交換樹脂的再生。
冶金
氫氧化鈉被用於處理鋁土礦,在鋁土礦中含有氧化鋁,氧化鋁是製取鋁的原料。
用氫氧化鈉可以把氧化鋁從精礦中提純。
反應方程式:Al2O3+2NaOH+H2O=2Na[Al(OH)4]或Al2O3+2NaOH=2NaAlO2+H2O[12]
氫氧化鈉也用於從黑鎢礦中提取煉鎢的原料鎢酸鹽:
4FeWO4+8NaOH+2H2O+O2=4Na2WO4+4Fe(OH)3
氫氧化鈉還被用於生產鋅合金和鋅錠。
安全措施
職業健康限值
中國職業衛生標準為MAC=2mg/m3。
健康危害
侵入途徑:吸入、食入。
健康危害:該品有強烈刺激和腐蝕性。粉塵或煙霧會刺激眼和呼吸道,腐蝕鼻中隔,皮膚和眼與NaOH直接接觸會引起灼傷,誤服可造成消化道灼傷,黏膜糜爛、出血和休克。
分解產物:可能產生有害的毒性煙霧。
危害防治
 NaOH袋裝
NaOH袋裝隔離泄漏污染區,周圍設警告標誌,建議應急處理人員戴好防毒面具,穿化學防護服。
不要直接接觸泄漏物,用清潔的鏟子收集於乾燥潔淨有蓋的容器中,以少量NaOH加入大量水中,調節至中性,再放入廢水系統。
也可以用大量水沖洗,經稀釋的洗水放入廢水系統。
如大量泄漏,收集回收或處理無害後廢棄。
安全標誌
 腐蝕性物品
腐蝕性物品氫氧化鈉屬於強鹼性物質,具有強腐蝕性,需有的“腐蝕性物品”標誌。
(如圖)
防護措施
呼吸系統防護:必要時佩帶防毒口罩。
眼睛防護:戴化學安全防護眼鏡。
防護服:穿工作服(防腐材料製作)。小心使用,小心濺落到衣物、口鼻中。
手防護:戴橡皮手套。
其它:工作後,淋浴更衣。注意個人清潔衛生。
急救措施
皮膚接觸:先用水沖洗至少15分鐘(稀液)/用布擦乾(濃液),再用5~10%硫酸鎂、或3%硼酸溶液清洗並就醫。
眼睛接觸:立即提起眼瞼,用流動清水或生理鹽水清洗至少15分鐘。或用3%硼酸溶液(或稀醋酸)沖洗。就醫。
吸入:迅速脫離現場至空氣新鮮處。必要時進行人工呼吸。就醫。
食入:少量誤食時立即用食醋、3~5%醋酸或5%稀鹽酸、大量橘汁或檸檬汁等中和;給飲蛋清、牛奶或植物油並迅速就醫,禁忌催吐和洗胃。
儲存運輸
儲存方法
 氫氧化鈉
氫氧化鈉固體氫氧化鈉裝入0.5毫米厚的鋼桶中嚴封,每桶淨重不超過100公斤。
塑膠袋或二層牛皮紙袋外全開口或中開口鋼桶。
螺紋口玻璃瓶、鐵蓋壓口玻璃瓶、塑膠瓶或金屬桶(罐)外普通木箱。
螺紋口玻璃瓶、塑膠瓶或鍍錫薄鋼板桶(罐)外滿底板花格箱、纖維板箱或膠合板箱。
鍍錫薄鋼板桶(罐)、金屬桶(罐)、塑膠瓶或金屬軟管外瓦楞紙箱。
包裝容器要完整、密封,有明顯的“腐蝕性物品”標誌。
氫氧化鈉對玻璃製品有輕微的腐蝕性,兩者會生成矽酸鈉,使得玻璃儀器中的活塞黏著於儀器上。
因此盛放氫氧化鈉溶液時不可以用玻璃瓶塞,否則可能會導致瓶蓋無法打開。
如果以玻璃容器長時間盛裝熱的氫氧化鈉溶液,也會造成玻璃容器損壞。
(玻璃中含有SiO₂:2NaOH+SiO₂=Na₂SiO₃+H₂O)
運輸方法
鐵路運輸時,鋼桶包裝的可用敞車運輸。起運時包裝要完整,裝載應穩妥。
運輸過程中要確保容器不泄漏、不倒塌、不墜落、不損壞,防潮防雨。
如發現包裝容器發生鏽蝕、破裂、孔洞、溶化淌水等現象時,應立即更換包裝或及早發貨使用,容器破損可用錫焊修補。
嚴禁與易燃物或可燃物、酸類、食用化學品等混裝混運。
運輸時運輸車輛應配備泄漏應急處理設備。
常見誤區
 氫氧化鈉
氫氧化鈉誤區1:鐵不能與氫氧化鈉反應
事實:無水條件下氫氧化鈉在高溫下可以與鐵粉反應並生成金屬鈉(或鉀)。
(蓋·呂薩克等)把鐵屑分別同苛性鉀(KOH)和苛性鈉(NaOH)混合起來,放在一個密封的彎曲玻璃管內加熱。
結果,在高溫下熔化的苛性鹼與紅熱的鐵屑起化學反應,生成了金屬鉀和鈉。這種方法既簡單又經濟,而且可以制出大量的鉀和鈉。
故實驗室熔融氫氧化鈉時應使用鎳制容器而不可以使用鐵制容器。
誤區2:氫氧化鈉是強鹼,但它並沒有殺菌的作用
事實:氫氧化鈉可以用於特定場所的消毒,並且它還是國家推薦的破壞朊病毒的消毒劑。
註:被感染朊病毒患者或疑似感染朊病毒患者的高度危險組織(大腦、硬腦膜、垂體、眼、脊髓等組織)污染的中度和高度危險性物品,可選以下方法之一進行消毒滅菌,且滅菌的嚴格程度逐步遞增:
a)將使用後的物品浸泡於1mol∕L氫氧化鈉溶液內作用60min,然後按WS310.2中的方法進行清洗、消毒與滅菌,壓力蒸汽滅菌應採用134℃~138℃,18min,或132℃,30min,或121℃,60min。
b)將使用後的物品採用清洗消毒機(宜選用具有殺朊病毒活性的清洗劑)或其他安全的方法去除可見污染物,然後浸泡於1mol∕L氫氧化鈉溶液內作用60min,並置於壓力蒸汽滅菌121℃,30min;然後清洗,並按照一般程式滅菌。
誤區3:鈉與氫氧化鈉不反應
事實:氫氧化鈉與金屬鈉可以反應,是製備氧化鈉的一個方法。
具體如下:
用氫氧化鈉和金屬鈉的混合物加熱以製備氧化鈉。
金屬鈉應稍過量,目的是除去氫氧化鈉所含的少量水分。
將粒狀NaOH和小塊金屬鈉混合,放入鎳坩堝。鎳坩堝放置於封好底部的硬質玻璃管中,管上部與真空泵和長管壓力計聯接。混合物在300~320℃開始反應,生成的氫氣被真空泵抽出。
真空度保持在399.96~533.288Pa(30~40mmHg柱),殘留的鈉被減壓蒸出。生成物為白色粉末,其中Na2O只含96%,另有2%NaOH,2%Na2CO3雜質。
誤區4:氫氧化鈉溶於沸水使水沸騰
具體如下:
取三支試管,分別向試管內倒入5mL蒸餾水,先在酒精燈外焰上進行預熱,再集中加熱,直至試管內的水騰;移開試管,向剛沸騰過的熱水中分別加入少許氯化鈉、硝酸銨、碎瓷片,均觀察到試管內的水重新沸騰起來。
眾所周之,碎瓷片不溶於水;氯化鈉溶於水時,溶液溫度不會有明顯變化,固體硝酸銨溶於水時吸收熱量,溶液溫度應該降低,但把這三種物質分別加入剛沸騰過的水中時,都觀察到水重新沸騰了起來。
顯然,“水的重新沸騰是由固體氫氧化鈉溶於水時放出熱量所致”的說法有所欠缺。
給蒸餾水加熱時,由於液體裡缺乏形成氣泡的核心,容易導致形成過熱液體,過熱液體是亞穩定狀態。
當向過熱液體中加人固體時,會侵入氣泡,提供了氣化中心,所以會看見水重新沸騰起來。
化妝品中的那些成分
| 每個人日常生活中都會接觸到化妝品,從護膚品、彩妝,到洗髮水、染髮劑,再到牙膏、沐浴露,我們每天都離不開這些日常使用的化妝品。但是,你知道這些化妝品都加了什麼成分嗎? |

