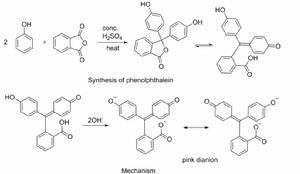
 酸鹼指示劑
酸鹼指示劑分類
 酸鹼指示劑
酸鹼指示劑1、硝基酚類:這是一類酸性顯著的指示劑,如對-硝基酚等。
2、酚酞類:有酚酞、百里酚酞和α-萘酚酞等,它們都是有機弱酸。
3、磺代酚酞類:有酚紅、甲酚紅、溴酚藍、百里酚藍等,它們都是有機弱酸。
4、偶氮化合物類:有甲基橙、中性紅等,它們都是兩性指示劑,既可作酸式離解,也可作鹼式離解。
發現經過
 酸鹼指示劑
酸鹼指示劑300多年前,英國年輕的科學家羅伯特·波義耳在化學實驗中偶然捕捉到一種奇特的實驗現象,有一天清晨,波義耳正準備到實驗室去做實驗,一位花木工為他送來一籃非常鮮美的紫羅蘭,喜愛鮮花的波義耳隨手取下一塊帶進了實驗室,把鮮花放在實驗桌上開始了實驗,當地從大瓶里傾倒出鹽酸時,一股刺鼻的氣體從瓶口湧出,倒出的淡黃色液體世冒白霧,還有少許酸沫飛濺到鮮花上,他想“真可惜,鹽酸弄到鮮花上了”,為洗掉花上的酸沫,他把花放到水裡,一會兒發現紫羅蘭顏色變紅了,當時波義耳既新奇又興奮,他認為,可能是鹽酸使紫羅蘭顏色變紅色,為進一步驗證這一現象,他立即返回住所,把那籃鮮花全部拿到實驗室,取了當時已知的幾種酸的稀溶液,把紫羅蘭花瓣分別放入這些稀酸中,結果現象完全相同,紫羅蘭都變為紅色。由此他推斷,不僅鹽酸,而且其它各種酸都能使紫羅蘭變為紅色。他想,這太重要了,以後只要把紫羅蘭花瓣放迸溶液,看它是不是變紅色,就可判別這種溶液是不是酸。偶然的發現,激發了科學家的探求欲望,後來,他又弄來其它花瓣做試驗,並製成花瓣的水或酒精的浸液,用它來檢驗是不是酸,同時用它來檢驗一些鹼溶液,也產生了一些變色現象。這位追求真知,永不睏倦的科學家,為了獲得豐富、準確的第一手資料,他還採集了藥草、牽牛花,苔蘚、月季花、樹皮和各種植物的根……泡出了多種顏色的不同浸液,有些浸液遇酸變色,有些浸液遇鹼變色,不過有趣的是,他從石蕊苔蘚中提取的紫色浸液,酸能使它變紅色,鹼能使它變藍色,這就是最早的石蕊試液,波義耳把它稱作指示劑。為使用方便,波義耳用一些浸液把紙浸透、烘乾製成紙片,使用時只要將小紙片放入被檢測的溶液,紙片上就會發生顏色變化,從而顯示出溶液是酸性還是鹼性。今天,我們使用的石蕊、酚酞試紙、pH試紙,就是根據波義耳的發現原理研製而成的。後來,隨著科學技術的進步和發展,許多其它的指示劑也相繼被另一些科學家所發現。
常用指示劑
鹼指示劑 | 變色範圍 | PKHin | 顏色 | 濃度 | 用量 | |
| 酸色 | 鹼色 | (滴/10mL試液) | ||||
| 百里酚藍 (麝香草酚藍) | 1.2~2.8 | 1.65 | 紅 | 黃 | 0.1%的20%酒精溶液 | 1~2 |
| 甲基黃 | 2.9~4.0 | 3.3 | 紅 | 黃 | 0.1%的90%酒精溶液 | 1 |
| 甲基橙 | 3.1~4.4 | 3.40 | 紅 | 黃 | 0.05%的水溶液 | 1 |
| 溴酚藍 | 3.0~4.6 | 3.85 | 黃 | 藍紫 | 0.1%的20%酒精溶液或其鈉鹽水溶液 | 1 |
| 甲基紅 | 4.4~6.2 | 4.95 | 紅 | 黃 | 0.1%的60%酒精溶液或其鈉鹽水溶液 | 1 |
| 溴百里酚藍 (溴麝香草酚藍) | 6.2~7.6 | 7.1 | 黃 | 藍 | 0.1%的20%酒精溶液或其鈉鹽水溶液 | 1 |
| 中性紅 | 6.8~8.0 | 7.4 | 紅 | 黃 | 0.1%的60%酒精溶液 | 1 |
| 酚紅 | 6.7~8.4 | 7.9 | 黃 | 紅 | 0.1%的60%酒精溶液或其鈉鹽水溶液 | 1 |
| 酚酞 | 8.0~10.0 | 9.1 | 無 | 紅 | 0.5%的90%酒精溶液 | 1~3 |
| 百里酚酞 (麝香草酚酞) | 9.4~10.6 | 10.0 | 無 | 藍 | 0.1%的90%酒精溶液 | 1~2 |
變色原理
 酸鹼指示劑
酸鹼指示劑石蕊和酚酞都是酸鹼指示劑,它們是一種弱的有機酸。在溶液里,隨著溶液酸鹼性的變化,指示劑的分子結構發生變化而顯示出不同的顏色。
石蕊(主要成分用HL表示)在水溶液里能發生如下電離: HL紅色 H+ L-藍色
在酸性溶液里,紅色的分子是存在的主要形式,溶液顯紅色;在鹼性溶液里,上述電離平衡向右移動,藍色的離子是存在的主要形式,溶液顯藍色;在中性溶液里,紅色的分子和藍色的酸根離子同時存在,所以溶液顯紫色。
石蕊能溶於水,不溶於酒精,變色範圍是pH 5.0~8.0>
酚酞是一種有機弱酸,它在酸性溶液中,濃度較高時,形成無色分子。但隨著溶液中H+濃度的減小,OH-濃度的增大,酚酞結構發生改變,並進一步電離成紅色離子這個轉變過程是一個可逆過程,如果溶液中H+濃度增加,上述平衡向反方向移動,酚酞又變成了無色分子。因此,酚酞在酸性溶液里呈無色,當溶液中H+濃度降低,濃度升高時呈紅色。酚酞的變色範圍是pH 8.0~10.0。
酚酞的醌式或醌式酸鹽,在鹼性介質中是很不穩定的,它會慢慢地轉化成無色的羧酸鹽式因此做氫氧化鈉溶液使酚酞顯色實驗時,要用氫氧化鈉稀溶液,而不能用濃溶液。
用量
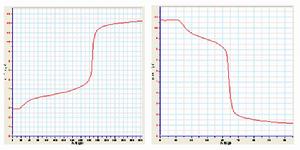 鹼指示劑應該選用甲基橙作指示劑。
鹼指示劑應該選用甲基橙作指示劑。指示劑用量過多,還會影響變色的敏銳性。例如:以甲基橙為指示劑,用HCl滴定NaOH溶液,終點為橙色,若甲基橙用量過多則終點敏銳性就較差。
2. 溫度和溶劑
溫度的變化會引起指示劑電離常數和水的質子自遞常數發生變化,因而指示劑的變色範圍亦隨之改變,對鹼性指示劑的影響較酸性指示劑更為明顯。不同的溶劑具有不同的介電常數和酸鹼性,因而也會影響指示劑的電離常數和變色範圍。
3. 指示劑的選擇指示劑選擇不當,加之肉眼對變色點辨認困難,都會給測定結果帶來誤差。
因此,在多種指示劑中,選擇指示劑的依據是:要選擇一種變色範圍恰好在滴定曲線的突躍範圍之內,或者至少要占滴定曲線突躍範圍一部分的指示劑。這樣當滴定正好在滴定曲線突躍範圍之內結束時,其最大誤差不過0.1%,這是容量分析容許的。
自製
 酸鹼指示劑
酸鹼指示劑1.從紅蘿蔔皮中提取酸鹼指示劑刮下紅蘿蔔的紅皮後,用95%的酒精浸泡一天左右,過濾取出它的濾液即酸鹼指示劑。按檢驗的需要製作pH1-14的標準液若干個,每個標準液取10ml分置於試管中,再分別加入紅蘿蔔皮浸泡液10滴,塞緊作為比色樣品。在某待測溶液中加入紅蘿蔔浸泡液,顏色發生變化後再與比色樣品比較,就能確定待測溶液 pH值的大致範圍。
2. 從紫草中提取酸鹼指示劑 取紫草5g,用50%的酒精浸泡一天可得到紫草素的紫色的酒精溶液即酸鹼指示劑。其遇到酸鹼的變色與石蕊試液相同。
3. 從紫色捲心菜中提取酸鹼指示劑 取約250g紫色捲心菜,洗淨切碎置於不鏽鋼鍋中加水煮沸10分鐘,然後過濾冷卻置於容器中即可用作酸鹼指示劑。其用法可參照上述操作1的方法。
4. 從米莧菜中提取酸鹼指示劑,其操作方法同操作3。
5.用咖喱粉制酸鹼指示劑
取一藥匙咖喱粉,用50%的調成糊狀,塗在一塊白布的兩面上,放置一段時間後用水衝去多餘的咖喱粉,白布被染成黃色,這就製成一塊可以多次反覆使用的酸鹼指示布。它遇鹼性溶液時呈紅色,遇酸性溶液時呈黃褐色。每次用完後,用水把布上的酸性或鹼性物質漂洗乾淨,指示布又恢復原來的黃色。可以供下次繼續使用。 還有很多植物的色素如月季花、菊花、牽牛花等的浸出液都可以製成不同的酸鹼指示劑。
常見配製方法
名稱 | 本身 性質 | 室溫下的顏色變化 | 溶液的配置方法 | 10 mL待測 液需用滴數 | |
pH範圍 | 顏色 | ||||
甲基橙 | 鹼 | 3.1~4.4 | 紅~黃 | 每100 mL水中溶解0.1 g甲基橙 | 1 |
石蕊 | 酸 | 5.0~8.0 | 紅~藍 | 向5 g石蕊中加入95%熱酒精500 mL充分振盪後靜置一晝夜,然後傾去紅色浸出液(酒精可回收)。向存留的石蕊固體中加入500 mL純水,煮沸後靜置一晝夜後過濾,保留濾液,再向濾渣中加入200 mL純水,煮沸後過濾,棄去濾渣。將兩次濾液混合,水浴蒸發濃縮至向100 mL水中加入三滴濃縮液即能明顯著色為止(若用於分析化學,還需除去碳酸根,步驟較繁,此處略)。 | 1 |
鹼 | 6.6~8.0 | 黃~紅 | 取0.1 g苯酚紅與5.7 mL 0.05 mol/L的NaOH溶液在研缽中研勻後用純水溶解製成250 mL試液。 | 1 | |
酚酞 | 酸 | 8.2~10.0 | 無色~紅 | 將0.1 g酚酞溶於100 mL 90%的酒精中。 | 1~3 |
變色範圍
| 液的組成 | 變色pH範圍 | 顏色變化 | 溶液配製方法 |
| 甲基紫 (第一變色範圍) | 0.13~0.5 | 黃~綠 | 1g·L-1 或0.5g·L-1 的水溶液 |
| 苦味酸 | 0.0~1.3 | 無色~黃色 | 1g·L-1 水溶液 |
| 甲基綠 | 0.1~2.0 | 黃~綠~淺藍 | 0.5g·L-1 水溶液 |
| 孔雀綠 (第一變色範圍) | 0.13~2.0 | 黃~淺藍~綠 | 1g·L-1 水溶液 |
| 甲酚紅 (第一變色範圍) | 0.2~1.8 | 紅~黃 | 0.04g指示劑溶於100mL50%乙醇中 |
| 甲基紫 (第二變色範圍) | 1.0~1.5 | 綠~藍 | 1g·L-1 水溶液 |
| 百里酚藍 (麝香草酚藍) (第一變色範圍) | 1.2~2.8 | 紅~黃 | 0.1g指示劑溶於100mL20%乙醇中 |
| 甲基紫 (第三變色範圍) | 2.0~3.0 | 藍~紫 | 1g·L-1 水溶液 |
| 茜素黃r (第一變色範圍) | 1.9~3.3 | 紅~黃 | 1g·L-1 水溶液 |
| 二甲基黃 | 2.9~4.0 | 紅~黃 | 0.1g 或0.01g 指示劑溶於100mL90%乙醇中 |
| 甲基橙 | 3.1~4.4 | 紅~橙黃 | 1g·L-1 水溶液 |
| 溴酚藍 | 3.0~4.6 | 黃~藍 | 0.1g指示劑溶於100mL20% 乙醇中 |
| 剛果紅 | 3.0~5.2 | 藍紫~紅 | 1g·L-1 水溶液 |
| 茜素紅S (第一變色範圍) | 3.7~5.2 | 黃~紫 | 1g·L-1 水溶液 |
| 溴甲酚綠 | 3.8~5.4 | 黃~藍 | 0.1g指示劑溶於100mL20%乙醇中 |
| 甲基紅 | 4.4~6.2 | 紅~黃 | 0.1g或0.2g指示劑溶於100mL60%乙醇中 |
| 溴酚紅 | 5.0~6.8 | 黃~紅 | 0.1g或0.04g指示劑溶於100mL20%乙醇中 |
| 溴甲酚紫 | 5.2~6.8 | 黃~紫紅 | 0.1g指示劑溶於100mL20%乙醇中 |
| 溴百里酚藍 | 6.0~7.6 | 黃~藍 | 0.05g指示劑溶於100mL20%乙醇中 |
| 中性紅 | 6.8~8.0 | 紅~亮黃 | 0.1g指示劑溶於100mL60%乙醇中 |
| 酚紅 | 6.8~8.0 | 黃~紅 | 0.1g指示劑溶於100mL20%乙醇中 |
| 甲酚紅 | 7.2~8.8 | 亮黃~紫紅 | 0.1g指示劑溶於100mL50%乙醇中 |
| 百里酚藍 (麝香草酚藍) (第二變色範圍) | 8.0~9.0 | 黃~藍 | 參看第一變色範圍 |
| 酚酞 | 8.2~10.0 | 無色~紫紅 | (1)0.1g指示劑溶於100mL60%乙醇中 (2)1g酚酞溶於100mL90%乙醇中 |
| 百里酚酞 | 9.4~10.6 | 無色~藍 | 0.1g指示劑溶於100mL90%乙醇中 |
| 茜素紅S (第二變色範圍) | 10.0~12.0 | 紫~淡黃 | 參看第一變色範圍 |
| 茜素黃R (第二變色範圍) | 10.1~12.1 | 黃~淡紫 | 1g·L-1 水溶液 |
| 孔雀綠 (第二變色範圍) | 11.5~13.2 | 藍綠~無色 | 參看第一變色範圍 |
| 達旦黃 | 12.0~13.0 | 黃~紅 | 1g·L-1 水溶液 |
無機化學
| 無機化學是除碳氫化合物及其衍生物外,對所有元素及其化合物的性質和他們的反應進行實驗研究和理論解釋的科學,是化學學科中發展最早的一個分支學科。現在讓我們來認識一下這部分化學知識吧。 |

