絡合滴定法
正文
又稱螯合滴定法。是以絡合反應(見配位化學)為基礎的容量分析方法,它主要以氨羧絡合劑為滴定劑,較常用氨羧絡合劑有氨三乙酸(NTA)、乙二胺四乙酸(EDTA)、環己烷二胺四乙酸(DCTA)、三乙四胺五乙酸(DTPA)、乙二醇二乙醚二胺四乙酸(EGTA)。這些氨羧絡合劑對許多金屬有很強的絡合能力,在鹼性介質中能與鈣和鎂化合成為易溶而又難於離解的絡合物。瑞士的G.K.施瓦岑巴赫及其合作者詳細研究了它們的化學性質,並於1945年首先提出用EDTA二鈉鹽滴定鈣和鎂以及測定水的硬度(見彩圖),奠定了絡合滴定法的基礎。在絡合滴定中大約95%以上的滴定是用EDTA二鈉鹽進行的。 絡合滴定法
絡合滴定法 絡合滴定法
絡合滴定法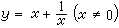 (1)
(1)
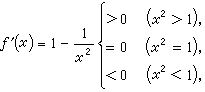 (2)
(2)
 絡合滴定法
絡合滴定法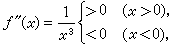 (3)
(3)
αY(H)=【H+ 】K1+【H+ 】2 K1K2+【H+ 】3 K1K2K3+【H+ 】4 K1K2K3K4 (4)
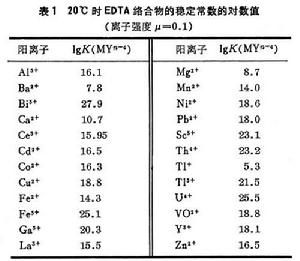
式中K1、K2、K3、K4分別為EDTA質子絡合物的各級酸度常數,即EDTA的各級離解常數的倒數。EDTA的酸效應係數見表2。EDTA絡合物的穩定性受酸度的影響,在一定pH下,其平衡常數應為: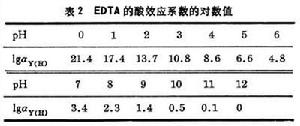 絡合滴定法
絡合滴定法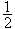 (5)
(5)
lgK′=lgK-lgαY(H) (6)
式中K′為取決於酸效應的表觀穩定常數。例如,在pH=2時,Fe(Ⅲ)-EDTA絡合物的lgK′=11.4,而Cu-EDTA的lgK′為5.1。酸度愈高,絡合物的穩定性愈低。以金屬的濃度為0.01Μ和滴定誤差為0.1%時為例,要求lgK′≥8,才能為EDTA準確滴定。上例說明,在pH=2時,EDTA可以準確滴定鐵(Ⅲ)而不能滴定銅。據此也可以確定滴定每一金屬的pH範圍:第一組:pH=1~3(lgK>20)者,有 Zr、Th、Bi、Fe(Ⅲ)、Ga、In、Hg等。
第二組:pH=4~6(lgK=15~18)者,有鋁、稀土元素、二價過渡金屬等。
第三組:pH=10~12(lgK=8~11)者,有鎂、鹼土金屬。
滴定第一組金屬時,第二和第三組的金屬原則上不干擾;滴定第二組金屬時,第三組不會干擾;同組之間的金屬相互干擾。故利用酸效應以提高滴定的選擇性是有限度的,必須採取有效辦法,如使用隱蔽劑或分離手段以消除干擾。
當兩種金屬MⅠ和MⅡ共存時,如果K
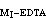 >108 ,而且【MⅡ】=0.01Μ和(K
>108 ,而且【MⅡ】=0.01Μ和(K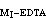 -K
-K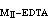 )>106 ,則可先滴定MⅠ而不受MⅡ干擾,繼之可滴定MⅡ。例如,在pH2.5下滴定釷後,繼續調節至pH=5~6,可滴定鋅或鉛。
)>106 ,則可先滴定MⅠ而不受MⅡ干擾,繼之可滴定MⅡ。例如,在pH2.5下滴定釷後,繼續調節至pH=5~6,可滴定鋅或鉛。 滴定方法 直接滴定 用標準EDTA溶液直接滴定金屬,以一適當指示劑確定終點。由於反應過程釋放出氫離子,須使用緩衝溶液以維持pH恆定。有些金屬在控制的pH下會水解,須加入一輔助絡合劑以抑制之。例如,在pH=10時滴定銅、鎳或鋅等,可加入氨水防止水解,再用鉻黑T為指示劑進行滴定。
回滴法 某些金屬容易水解或與EDTA絡合緩慢,或者直接滴定沒有適當的指示劑,可加入過量EDTA,然後用一適當金屬回滴。例如,鋁離子容易聚合而又與EDTA絡合緩慢,經常用回滴法測定。
置換滴定 在缺乏適當指示劑或在滴定條件下金屬會水解而不能直接滴定時,除採用回滴法外,也可用置換滴定。置換反應為:
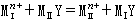
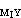 >K
>K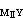 >108 ,使MⅠ能定量置換MⅡ而為EDTA滴定,從而間接求出MⅠ。例如,在有酒石酸的鉛溶液中調至pH=10,加入過量的Mg-EDTA絡合物,置換出與鉛相當的鎂,可用EDTA滴定而間接測得鉛。另一種置換滴定法是用一種比 EDTA更強的絡合劑HnZ置換MⅠ-EDTA絡合物中的EDTA,用MⅡ滴定:
>108 ,使MⅠ能定量置換MⅡ而為EDTA滴定,從而間接求出MⅠ。例如,在有酒石酸的鉛溶液中調至pH=10,加入過量的Mg-EDTA絡合物,置換出與鉛相當的鎂,可用EDTA滴定而間接測得鉛。另一種置換滴定法是用一種比 EDTA更強的絡合劑HnZ置換MⅠ-EDTA絡合物中的EDTA,用MⅡ滴定: MⅠY+Zn+ =MⅠZ+Yn+ (7)
最常用的方法是以氟化銨置換Al-EDTA中的EDTA,用鉛或鋅滴定而間接測定鋁。間接滴定 主要用於滴定那些與 EDTA 弱絡合的陽離子或不與 EDTA 絡合的陰離子。例如,在含鈹的鹼性碳酸銨溶液中加入氯化六氨合鈷(Ⅲ),生成橙色沉澱【Co(NH3)6】【(H2O)Be(CO3)(OH)3·3H2O】,將沉澱濾出,溶解後用EDTA滴定鈷而測得鈹。磷酸根可以沉澱成磷酸鉍,加入過量的鉍後用EDTA滴定而間接測得磷。
金屬指示劑 容量分析 以目視法確定終點必須藉助指示劑來完成,絡合滴定法不能例外。本法所用的指示劑要能與金屬絡合後呈相當深的顏色,絡合物的lgK>5才有足夠的靈敏度。指示劑絡合物的穩定性要比EDTA絡合物的穩定性約低3個lgK單位,終點才敏銳。此外,在同一pH下游離指示劑與指示劑絡合物有顯著不同的顏色,以使終點突變明顯。此類指示劑稱為金屬(顯色)指示劑。如果它能產生螢光,則稱為金屬螢光指示劑。鉻黑T是滴定鎂的良好指示劑,在pH=10時呈純藍色,與鎂絡合呈紅色,其lgK′為5.4,故相當靈敏。在此pH下Mg-EDTA絡合物的lgK′=8.2,大於Mg-鉻黑T的lgK′(2.8),故易為EDTA奪取與指示劑結合的鎂,終點敏銳,從紅變為藍色。鉻黑 T與銅、鎳、鐵、鋁等形成比EDTA更穩定的絡合物,不能用作那些金屬離子的指示劑。如滴定鎂時有痕量的上述金屬存在,則產生所謂封閉作用,阻塞了終點,可加入少量氰化鉀以消除。金屬指示劑除少數是無機化合物外,大都是有機化合物。已提出的指示劑為數不少,但用於實際工作中只有二、三十種(表3)。
 絡合滴定法
絡合滴定法隱蔽劑 當MⅠ和MⅡ的lgK值相差不大(小於6)時,要使用隱蔽劑(見隱蔽和解蔽)隱蔽MⅠ或MⅡ,才能滴定MⅡ或MⅠ。作為隱蔽劑必須具備下列性質:①隱蔽劑與干擾離子的絡合物必須比EDTA更穩定;②與干擾離子生成無色或淺色的可溶性絡合物,加入後溶液清晰,不影響終點判斷,也不太變動溶液的pH;③不降低EDTA絡合物的穩定性。絡合滴定法中常用的隱蔽劑列於表4。
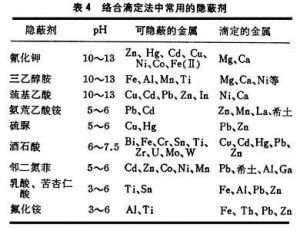 絡合滴定法
絡合滴定法參考書目
G.K.施瓦岑巴赫和H.弗拉施卡著,閻大任譯:《絡合滴定法》,冶金工業出版社,北京,1981。(G.K.Schwar-zenbach and H.Flaschka,Complexometric Titration, Methuen,London, 1969.)
