溶劑的均化和區分效應
1.均化效應
常見的礦酸如高氯酸、鹽酸、硫酸、硝酸等,都是強酸,在水中存在著下列酸鹼平衡:
HClO4+H2O→←H3O++ClO4-
HCl+H2O→←H3O++Cl-
H2SO4+H2O→←H3O++HSO4-
HNO3+H2O→←H3O++NO3-
在水中,礦酸是強酸,水則是鹼。水接受了礦酸的質子而形成另一種酸——水合質子(H3O+);礦酸放出質子後則轉變成相應的共軛鹼(ClO4-、Cl-、HSO4-、NO3-等)。這一酸鹼反應向右進行得十分完全。即不論上述礦酸的酸度多強,溶於水後,其固有的酸強強度已不能表現出來,而統統都被均化到水合質子(H3O+)的強度水平,結果使它們的酸強度都相等。溶劑的這種均化作用叫均化效應或稱調平效應。具有均化效應的溶劑叫均化性溶劑。水是上述礦酸的均化性溶劑。
2.區分效應
但水不能調平鹽酸和醋酸,因為對醋酸來說,水的鹼性太弱,質子轉移反應很不完全,
HAc+H2O→←H3O++Ac-
溶液中存在大量的醋酸分子,而水合質子極少。由於鹽酸和醋酸在溶劑水中反應進行的程度不同,故顯示出二者酸強度的差別。這種能區分酸(鹼)強弱的作用叫區分效應。具有區分效應的溶劑稱為區分性溶劑。對於鹽酸和醋酸來說,水是一個很好的區分性溶劑。
3.舉例
例如,某一弱鹼B,在水中CKb<10-8,由於B的鹼性太弱,而溶劑H2O的酸性又不夠強,鹼B在水溶液中的質子轉移反應很不完全,即溶劑H2O對鹼B不能起均化作用,故不能被滴定。若更換酸性溶劑,將弱鹼B溶於冰醋酸中,其質子轉移反應向右可趨於完全:
B+HAc→←BH++Ac-
鹼B溶於冰醋酸後,其鹼強度已被均化到溶劑陰離子的鹼強度水平,因而可用高氯酸進行滴定:
HClO4+HAc→← H2Ac++ClO4-
B+HAc→←BH++Ac-
H2Ac++Ac-→←2HAc
整個過程中,溶劑(HAc)仍然起了傳遞質子的作用,而本身並無什麼變化。
溶劑的分類
(一)質子性溶劑
1.酸性溶劑 有機弱鹼在酸性溶劑中可顯著地增強其相對鹼度,最常用的酸性溶劑為冰乙酸(冰醋酸)。
2.鹼性溶劑 有機弱酸在鹼性溶劑中可顯著地增強其相對酸度,最常用的鹼性溶劑為二甲基甲醯胺。
3.兩性溶劑 兼有酸鹼兩種性能,最常用的為甲醇。
(二)非質子性溶劑(惰性溶劑) 這類溶劑沒有酸、鹼性,如苯、三氯甲烷。
四、鹼的滴定
(一)溶劑
冰醋酸是滴定弱鹼最常用的溶劑。
常用的一級和二級冰醋酸都含有少量的水分,而水的存在常影響滴定突躍,使指示劑變色不敏銳。除去水的方法是加入計算量的醋酐,使與水反應轉變為醋酸。
(CH3CO)2O+H2O→2CH3COOH
1 : 1
若一級冰醋酸含水量為0.2%,比重為1.05,除去1000ml冰醋酸中的水,應加比重1.08含量97.0%的醋酐的體積為:
1.08×1000×97.0%
C醋酐 = ————————- = 10.26mol/L
102.09
1.05×1000×0.2%
C水 = ———————— = 0.1165mol/L
18.02
C醋酐×V = C水×1000
V = C水×1000/ C醋酐 = 0.1165×1000/10.26 = 11.35ml
(二)滴定液的配製與標定
高氯酸滴定液
1.配製 間接法配製
2.標定 用基準鄰苯二甲酸氫鉀標定,以結晶紫指示液指示終點。
3.貯藏 置棕色玻瓶中,密閉保存。
4.校正
若滴定樣品與標定高氯酸滴定液時的溫度差別超過10℃,則應重新標定;若未超過10℃,則可根據下式將高氯酸滴定液的濃度加以校正。
N0
N1 = ————————
1+0.0011(t1-t0)
式中 0.0011為冰醋酸的膨脹係數;
t0為標定高氯酸滴定液時的溫度;
t1為滴定樣品時的溫度;
N0為t0時高氯酸滴定液的濃度;
N1為t1時高氯酸滴定液的濃度。
(三)指示劑
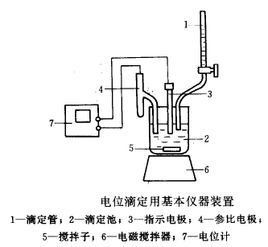
以冰醋酸作溶劑,用高氯酸滴定液滴定鹼時,最常用的指示劑為結晶紫,其酸式色為黃色,鹼式色為紫色,由鹼區到酸區的顏色變化有:紫、藍、藍綠、黃綠、黃。在滴定不同強度的鹼時,終點顏色變化不同。滴定較強鹼,應以藍色或藍綠色為終點;滴定較弱鹼,應以藍綠或綠色為終點。對於終點的判定,最好以電位滴定法作對照,以確定終點的顏色。並作空白試驗以減少滴定誤差。
(四)有機鹼的氫鹵酸鹽的滴定
由於有機鹼的氫鹵酸鹽(以B•HX代表)中的氫鹵酸HX在冰醋酸中酸性較強,不能直接用高氯酸滴定,而必須消除HX的干擾。通常多採用先加過量的醋酸汞冰醋酸溶液,使形成難電離的鹵化汞,而氫鹵酸鹽則轉變成可測定的醋酸鹽,然後再用高氯酸滴定,以結晶紫或其它適宜的指示劑指示終點。
2B•HX+Hg(Ac)2→2B•HAc+HgX2
B•HAc+HClO4→B•HClO4+HAc
酸的滴定(略)
注意事項
1.供試品如為氫鹵酸鹽,應在加入醋酸汞試液3~5ml,使生成難解離的鹵化汞,以消除氫鹵酸鹽在冰醋酸中生成氫鹵酸的干擾後,再進行滴定。
2.供試品如為磷酸鹽,可以直接滴定;硫酸鹽也可直接滴定,但滴定至其成為硫酸氫鹽為止。
3.供試品如為硝酸鹽時,因硝酸可使指示劑褪色,終點極難觀察,遇此情況應以電位滴定法指示終點為宜。
4.電位滴定時用玻璃電極為指示電極,飽和甘汞電極(玻璃套管內裝氯化鉀的飽和無水甲醇溶液)為參比電極。
5.玻璃儀器必須乾燥,試劑的含水量應在0.2%以下。
6.配製高氯酸滴定液時,應將高氯酸用冰醋酸稀釋後,在攪拌下,緩緩滴加醋酐(乙酸酐),量取高氯酸的量筒不得量取醋酐,因高氯酸與有機物接觸極易引起爆炸。
7.配製高氯酸滴定液時,若用於易乙醯化的供試品測定,必須測定本液的含水量(費休氏法),再用水或醋酐調節至本液的含水量為0.01~0.2%。
8.配製甲醇鈉滴定液時,應避免與空氣中的二氧化碳及水氣接觸,每次臨用前均應重新標定。
9.鹼滴定液滴定操作時,應在乾燥的恆溫條件下進行,不得有氨氣、二氧化碳和水氣。
10.若滴定樣品與標定高氯酸滴定液時的溫度差別超過10℃,則應重新標定;若未超過10℃,則可根據下式將高氯酸滴定液的濃度加以校正。
N0
N1 = ————————
1+0.0011(t1-t0)
式中 0.0011為冰醋酸的膨脹係數;
t0為標定高氯酸滴定液時的溫度;
t1為滴定樣品時的溫度;
N0為t0時高氯酸滴定液的濃度;
適用範圍
本法使用於測定有機鹼及其氫鹵酸鹽、磷酸鹽、硫酸鹽和有機酸鹽以及有機酸鹼金屬鹽類藥物的含量。也用於測定某些有機弱酸的含量。
允許差
本法的相對偏差不得超過0.3%