簡介
可簡單認為是鋁與某些金屬氧化物(如Fe2O3、Fe3O4、Cr2O3、V2O5等)在高熱條件下發生的反應。
利用鋁的強還原性和鋁轉化為氧化鋁時能放出大量熱的性質,工業上常用鋁粉來還原一些氧化物,這類反應被稱為鋁熱反應。例如,在焊接鐵軌時,人們常將鋁粉與氧化鐵的混合物點燃,由於反應放出大量的熱,置換出的鐵以熔融態形式流出。讓熔融的鐵流入鐵軌的裂縫,冷卻後就將鐵軌牢牢的黏結在一起。此外,鋁熱反應還可以表示鋁元素置換其他金屬元素(如錳等)的氧化物置換出該金屬元素。
實驗原理
 實驗裝置
實驗裝置鋁熱反應的原理,是鋁單質在高溫的條件下進行的一種氧化還原反應,體現出了鋁的強還原性。由於氧化鋁的生成焓(-1645kJ/mol)極低,故反應會放出巨大的熱,甚至可以使生成的金屬以熔融態出現。另一方面,反應放出大量熱使鋁熔化,反應在液相中進行使反應速率極快,短時間放出極大量的熱。鋁熱反應的劇烈程度,由金屬離子氧化性所決定。據估計,500克鋁熱劑(成分是氧化鐵和鋁)會在30秒內燃燒殆盡。
實驗反應化學方程式:
氧化鐵:
2Al+Fe2O3=Al2O3+2Fe
四氧化三鐵:
8Al+3Fe3O4=4Al2O3+9Fe
二氧化錳:
4Al+3MnO2=2Al2O3+3Mn
(反應條件都為高溫)
適合金屬
鋁熱法一般用來製備高熔點且活潑性小於鋁的金屬,比如Cr、Mn、Fe、Mo等等。Al是否可以用CO等還原性氣體還原還沒見過,不過鋁可以用C還原,其還原需要相當高的溫度,大約是2000度,要達到這么高的溫度成本更高,另外Al和O的結合能力比較強,單用還原劑不容易將其還原。
高熔點的金屬一般還原所需的溫度也較高,用H2、CO還原的成本也高,但是像鐵這一類的用H2和CO在較低的溫度下就可以還原了就不用鋁熱法了。工業上的生成都是由成本來決定的,所採用的方法肯定就是成本最低的方法。
實驗步驟
儀器和藥品
 實驗裝置
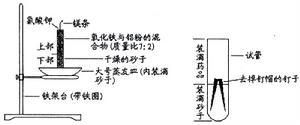
實驗裝置蒸發皿、鐵架台(帶鐵圈)、小試管(10cm×10mm)、3-4cm長的鐵釘、氧化鐵、鋁粉、氯酸鉀(研細)、酒精棉球(或直衝式打火機)、砂子、燒杯、藥匙、坩堝鉗、鑷子、剪刀、火柴、砂紙、水、釘錘。
實驗步驟
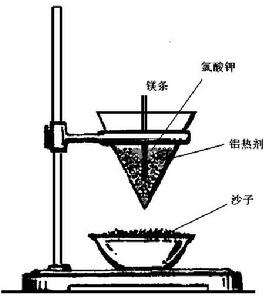
1.將盛滿砂子(用水潤濕)的蒸發皿架在鐵架台的鐵圈上。
2.在小試管內裝入1/2-1/3乾燥的砂子。
3.用鑷子向砂中插入兩支去掉釘帽的鐵釘,將鐵釘約1/4部分留在砂外並用鑷子將其靠緊。
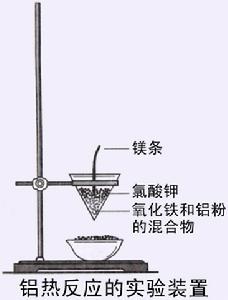
4.在砂子上面裝滿按照質量比為7:2混合均勻的氧化鐵粉末和鋁粉,並墩實。
5.在裝滿藥品後的小試管上部放入少量氯酸鉀粉末(用藥匙將氯酸鉀與表面藥品略為混合),並在小試管上部插入一根(約3cm)打亮的鎂條。將小試管豎直插入盛有砂的蒸發皿中。
6.用酒精棉球(或直衝式打火機)點燃鎂條。
7.反應完全後,用坩堝鉗夾住小試管的一端並將其敲斷(或趁熱在砂與紅熱界面處滴加少量水),倒出砂子並取出已焊接在一起的兩支鐵釘。
注意事項
 鋁熱反應
鋁熱反應首先,鋁熱反應有一定的危險性,如果沒有較好有效的防火和耐高溫措施,不適合在家裡或房間裡做該實驗,否則容易造成化學燙傷,化學火暴火乍等事故。如果對鋁熱感興趣,可以選擇室外或者安全的有防火措施的房間進行實驗,並建議用氧化鐵作為金屬氧化物,並嚴格控制反應物量的大小,建議鋁粉可稍微過量,以使金屬氧化物完全反應。在使用鎂條時請注意,鎂條必須打磨光亮,並且要10厘米左右,太短熱量不夠,太長燃燒時間太長,並造成浪費。建議不要在承接容器中加水,否則水高溫分解的氫氣容易產生化學火暴火乍。切忌不能在反應物附近放可燃物,易燃物或玻璃等易爆物品。當用氯酸鉀作氧化劑時,切不可加大劑量,否則會引起物理爆炸和化學爆炸,在點燃反應物之前,先撤離周圍人員,並保持一段距離。
在點燃鎂帶時,可使用高溫打火機,噴火槍或酒精燈。發現鎂條逐漸變黑和閃火星時,說明鎂條已經吸收了夠多的熱量,馬上要燃燒了,這時要繼續加熱,並準備撤離。點燃鎂帶後,要趕快離至適合的距離,實驗者必須戴墨鏡或防強光的設備觀察實驗現象,以防止被鋁熱反應的強光灼傷眼睛。絕對不允許在反應物旁觀察反應現象。反應時,會有900~1500攝氏度的高溫的金屬熔融物噴出,這時要隔離周圍人員,不得靠近。反應結束後,不可用水澆滅,要等其自然冷卻。
進行反應時,容易造成劇烈反應的金屬氧化物,如二氧化錳等,建議不要用相機進行拍攝,如需拍攝分析,最好用耐強光的鏡頭,或在鏡頭上裝上黑色膠片等。
冷卻結束後,可看見被還原的金屬,該金屬可收藏或再使用。
用途
鋁熱反應十分激烈,所以點燃後難以熄滅。若在鋼等其他金屬物上點燃,還會熔穿金屬物,加劇反應。故常被用於製作燃燒彈,可以熔穿裝甲。
鋁熱反應過程中放出的熱可以使高熔點金屬熔化並流出,故鋁熱法廣泛運用於焊接搶險工程之中。另外,鋁熱法也是冶煉釩、鉻、錳等高熔點金屬的重要手段。
除此之外,其他的金屬單質與金屬氧化物混合之後點燃,也會發生強烈的氧化還原反應,效果類似於鋁熱反應。其中的金屬單質可以是鋁、鎂、鈣、鈦、矽、硼,而金屬氧化物可以是三氧化二硼、二氧化矽、三氧化二鉻、二氧化錳、三氧化二鐵、四氧化三鐵、氧化銅和四氧化三鉛等。有時這些反應也根據反應中的還原劑而被稱為“鎂熱法”、“矽熱法”、“鈣熱法”、“碳熱法”等等。
無機化學
| 無機化學是除碳氫化合物及其衍生物外,對所有元素及其化合物的性質和他們的反應進行實驗研究和理論解釋的科學,是化學學科中發展最早的一個分支學科。現在讓我們來認識一下這部分化學知識吧。 |