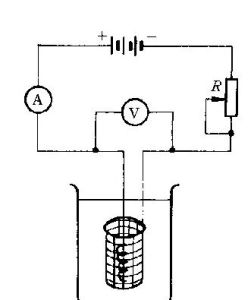
原理分析
 電解法
電解法CuCl2是強電解質且易溶於水,在水溶液中電離生成Cu2+和Cl-。
CuCl2=Cu2++2Cl-
通電前,Cu2+和Cl-在水裡自由地移動著;通電後,這些自由移動著的離子,在電場作用下,改作定向移動。溶液中帶正電的Cu2+向陰極移動,帶負電的氯離子向陽極移動。在陰極,銅離子獲得電子而還原成銅原子覆蓋在陰極上;在陽極,氯離子失去電子而被氧化成氯原子,並兩兩結合成氯分子,從陽極放出。
陰極:Cu2++2e-=Cu
陽極:Cl--2e-=Cl2↑
電解CuCl2溶液的化學反應方程式:CuCl2=Cu+Cl2↑(電解)(5)電解質水溶液電解反應的綜合分析
在上面敘述氯化銅電解的過程中,沒有提到溶液里的H+和OH-,其實H+和OH-雖少,但的確是存在的,只是他們沒有參加電極反應。也就是說在氯化銅溶液中,除Cu2+和Cl-外,還有H+和OH-,電解時,移向陰極的離子有Cu2+和H+,因為在這樣的實驗條件下Cu2+比H+容易得到電子,所以Cu2+在陰極上得到電子析出金屬銅。移向陽極的離子有OH-和Cl-,因為在這樣的實驗條件下,Cl-比OH-更容易失去電子,所以Cl-在陽極上失去電子,生成氯氣。
說明:
①陽離子得到電子或陰離子失去電子而使離子所帶電荷數目降低的過程又叫做放電。
②用石墨、金、鉑等還原性很弱的材料製做的電極叫做惰性電極,理由是它們在一般的通電條件下不發生化學反應。用鐵、鋅、銅、銀等還原性較強的材料製做的電極又叫做活性電極,它們做電解池的陽極時,先於其他物質發生氧化反應。
③在一般的電解條件下,水溶液中含有多種陽離子時,它們在陰極上放電的先後順序是:Ag+>Hg2+>Fe3+>Cu2+>Pb2+>Sn2+>Fe2+>Zn2+>H+>Al3+>Mg2+>Na+>Ca2+>K+;水溶液中含有多種陰離子時,它們的惰性陽極上放電的先後順序是:S2->I->Br->Cl->OH->含氧酸根>F-。
分析步驟
①分析電解質水溶液的組成,找全離子並分為陰、陽兩組;
②分別對陰、陽離子排出放電順序,寫出兩極上的電極反應式;
③合併兩個電極反應式得出電解反應的總化學方程式或離子方程式。
 電解法
電解法電解廣泛套用於冶金工業中,如從礦石或化合物提取金屬(電解冶金)或提純金屬(電解提純),以及從溶液中沉積出金屬(電鍍)。金屬鈉和氯氣是由電解溶融氯化鈉生成的;電解氯化鈉的水溶液則產生氫氧化鈉和氯氣。電解水產生氫氣和氧氣。水的電解就是在外電場作用下將水分解為H2(g)和O2(g)。電解是一種非常強有力的促進氧化還原反應的手段,許多很難進行的氧化還原反應,都可以通過電解來實現。例如:可將熔融的氟化物在陽極上氧化成單質氟,熔融的鋰鹽在陰極上還原成金屬鋰。電解工業在國民經濟中具有重要作用,許多有色金屬(如鈉、鉀、鎂、鋁等)和稀有金屬(如鋯、鉿等)的冶煉及金屬(如銅、鋅、鉛等)的精煉,基本化工產品(如氫、氧、燒鹼、氯酸鉀、過氧化氫、乙二腈等)的製備,還有電鍍、電拋光、陽極氧化等,都是通過電解實現的。質在水溶液里或熔融狀態下能導電的化合物叫電解質。化合物導電的前提:其內部存在著自由移動的陰陽離子。
離子化合物在水溶液中或熔化狀態下能導電;共價化合物:某些也能在水溶液中導電(如HC,其它為非電解質)
強電解質一般有:強酸強鹼,大多數鹽,活潑金屬的氧化物、氫化物;弱電解質一般有:(水中只能部分電離的化合物)弱酸(可逆電離,分步電離<多元弱酸>,弱鹼(如NH3·H2O)。另外,水是極弱電解質。
導電的性質與溶解度無關
註:能導電的不一定是電解質判斷某化合物是否是電解質,不能只憑它在水溶液中導電與否,還需要進一步考察其晶體結構和化學鍵的性質等因素。例如,判斷硫酸鋇、碳酸鈣和氫氧化鐵是否為電解質。硫酸鋇難溶於水(20℃時在水中的溶解度為2.4×10-4g),溶液中離子濃度很小,其水溶液不導電,似乎為非電解質。但溶於水的那小部分硫酸鋇卻幾乎完全電離(20℃時硫酸鋇飽和溶液的電離度為97.5%)。因此,硫酸鋇是電解質。碳酸鈣和硫酸鋇具有相類似的情況,也是電解質。從結構看,對其他難溶鹽,只要是離子型化合物或強極性共價型化合物,儘管難溶,也是電解質。
氫氧化鐵的情況則比較複雜,Fe3+與OH-之間的化學鍵帶有共價性質,它的溶解度比硫酸鋇還要小(20℃時在水中的溶解度為9.8×10-5g);而落於水的部分,其中少部分又有可能形成膠體,其餘亦能電離成離子。但氫氧化鐵也是電解質。
判斷氧化物是否為電解質,也要作具體分析。非金屬氧化物,如SO2、SO3、P2O5、CO2等,它們是共價型化合物,液態時不導電,所以不是電解質。有些氧化物在水溶液中即便能導電,但也不是電解質。因為這些氧化物與水反應生成了新的能導電的物質,溶液中導電的不是原氧化物,如SO2本身不能電離,而它和水反應,生成亞硫酸,亞硫酸為電解質。金屬氧化物,如Na2O,MgO,CaO,Al2O3等是離子化合物,它們在熔化狀態下能夠導電,因此是電解質。需要注意的是,氯化鋁(AlCl3)是電解質,但是是共價化合物而不是離子化合物。
可見,電解質包括離子型或強極性共價型化合物;非電解質包括弱極性或非極性共價型化合物。電解質水溶液能夠導電,是因電解質可以離解成離子。至於物質在水中能否電離,是由其結構決定的。因此,由物質結構識別電解質與非電解質是問題的本質。
另外,有些能導電的物質,如銅、鋁等不是電解質。因它們並不是能導電的化合物,而是單質,不符合電解質的定義。
電解質是指在水溶液中或熔融狀態下能夠導電的化合物,例如酸、鹼和鹽等。凡在上述情況下不能導電的化合物叫非電解質,例如蔗糖、酒精等。
生成物規律
十六字要訣:
陰得陽失:電解時,陰極得電子,發生還原反應,陽極失電子,發生氧化反應;
陰精陽粗:精煉銅過程中,陰極使用精銅,陽極使用粗銅,最後陽極逐漸溶解,且產生陽極泥;
陰鹼陽酸:在電解反應之後,不活潑金屬的含氧酸鹽會在陽極處生成酸,而活潑金屬的無氧酸鹽會在陰極處生成鹼;
陰固陽氣:電解反應之後,陰極產生固體及還原性氣體,而陽極則生成氧化性強的氣體。

