簡介
氯氣,是具有異臭和強烈刺激性的黃綠色氣體,有窒息性氣味。其遇水生成次氯酸和鹽酸,與一氧化碳在高熱條件下,可生成光氣。
氯氣在日光下與易燃氣體混合時會發生燃燒爆炸,在高壓下液化為液態氯。氯氣易溶於水和鹼溶液,也易溶於二硫化碳和四氯化碳等有機溶劑。其遇水首先生成次氯酸和鹽酸,次氯酸又可再分解為氯化氫和新生態氧,因此它是強氧化劑和漂白劑。
氯氣是有毒氣體,它主要通過呼吸道侵入人體並溶解在黏膜所含的水分里,生成次氯酸和鹽酸,會對上呼吸道黏膜造成有害的影響。
發現歷史
 氯氣
氯氣氯氣的發現應歸功於瑞典化學家舍勒。舍勒是18世紀中後期歐洲的一位相當出名的科學家,他從少年時代起就在藥房當學徒,他迷戀實驗室工作,在儀器、設備簡陋的實驗室里他做了大量的化學實驗,涉及內容非常廣泛,發明也非常多。他以其短暫而勤奮的一生,對化學做出了突出的貢獻,贏得了人們的尊敬。
舍勒發現氯氣是在1774年,當時他正在研究軟錳礦(二氧化錳)。當他使軟錳礦與濃鹽酸混合併加熱時,產生了一種黃綠色的氣體,這種氣體的強烈的刺激性氣味使舍勒感到極為難受。
舍勒製備出氯氣以後,把它溶解在水裡,發現這種水溶液對紙張、蔬菜和花都具有永久性的漂白作用;他還發現氯氣能與金屬或金屬氧化物發生化學反應。從1774年舍勒發現氯氣以後,到1810年,許多科學家先後對這種氣體的性質進行了研究。這期間,氯氣一直被當作一種化合物。直到1810年,戴維經過大量實驗研究,才確認這種氣體是由一種化學元素組成的物質。他將這種元素命名為chlorine。這個名稱來自希臘文,有“綠色的”意思。中國早年的譯文將其譯作“綠氣”,後改為氯氣。
自然分布
自然界中游離狀態的氯存在於大氣層中,是破壞臭氧層的主要單質之一。氯氣受紫外線分解成兩個氯原子(自由基)。大多數通常以氯化物(Cl)的形式存在,常見的主要是氯化鈉(食鹽,NaCl)。
物理性質
狀態
 氯氣的電子式
氯氣的電子式通常情況下為有強烈刺激性氣味的
黃綠色的有毒氣體。
密度
氯氣密度是空氣密度的2.5倍,標況下ρ=3.21kg/m³。
易液化
熔沸點較低,常溫常壓下,熔點為-101.00℃,沸點-34.05℃,常溫下把氯氣加壓至600~700kPa或在常壓下冷卻到-34℃都可以使其變成液氯,液氯即Cl₂,液氯是一種油狀的液體,其與氯氣物理性質不同,但化學性質基本相同。
溶解性
 氯原子結構示意圖
氯原子結構示意圖可溶於水,且易溶於有機溶劑
(例如:四氯化碳),難溶於飽和食鹽水。1體積水在常溫下可溶解2體積氯氣,形成黃綠色氯水,密度為 3.170g/L,比空氣密度大。
結構
原子結構:氯原子最外層有7個電子,反應中易得到1個電子或共用一個電子對達到穩定結構(共價鍵)
分子結構:氯分子為雙原子分子,分子式Cl₂。
離子結構:氯離子最外層有8個電子,因而很穩定。
化學性質
毒性
氯氣是一種有毒氣體,它主要通過呼吸道侵入人體並溶解在黏膜所含的水分里,生成次氯酸和鹽酸,對上呼吸道黏膜造成損傷:次氯酸使組織受到強烈的氧化;鹽酸刺激黏膜發生炎性腫脹,使呼吸道黏膜浮腫,大量分泌黏液,造成呼吸困難,所以氯氣中毒的明顯症狀是發生劇烈的咳嗽。症狀重時,會發生肺水腫,使循環作用困難而致死亡。由食道進入人體的氯氣會使人噁心、嘔吐、胸口疼痛和腹瀉。1L空氣中最多可允許含氯氣0.001mg,超過這個量就會引起人體中毒。
金屬
1、金屬鈉在氯氣中燃燒生成氯化鈉。
現象:鈉在氯氣里劇烈燃燒,產生大量的白煙,放熱。
2、銅在足量氯氣中燃燒生成氯化銅。
現象:紅熱的銅絲在氯氣里劇烈燃燒,瓶里充滿棕黃色的煙,加少量水後,溶液呈藍綠色(綠色較明顯),加足量水後,溶液完全顯藍色。
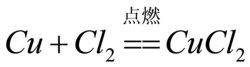 氯氣
氯氣3、鐵在氯氣中燃燒生成三氯化鐵。
 氯氣與鐵的反應演示
氯氣與鐵的反應演示現象:鐵絲在氯氣里劇烈燃燒,瓶里充滿棕紅色煙,加少量水後,溶液呈黃色。
4.鎂帶在氯氣中燃燒生成氯化鎂。
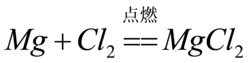 氯氣
氯氣註:氯氣具有強氧化性,加熱下可以與所有金屬反應,如金、鉑在熱氯氣中燃燒,而與Fe、Cu等變價金屬反應則生成高價金屬氯化物。
常溫下,乾燥氯氣或液氯不與鐵反應,只能在加熱情況下反應,所以可用鋼瓶儲存氯氣(液氯)。
非金屬
1、與氫氣的反應
H₂+Cl₂=點燃=2HCl(工業製鹽酸方法,工業先電解飽和食鹽水,生成的氫氣和氯氣燃燒生成氯化氫氣體。)
現象:H₂在Cl₂中安靜地燃燒,發出蒼白色火焰,瓶口處出現白霧。
H₂+Cl₂=光照=2HCl
現象:見光爆炸,有白霧產生。
需要注意的是:將點燃的氫氣放入氯氣中,氫氣只在管口與少量的氯氣接觸,產生少量的熱;點燃氫氣與氯氣的混合氣體時,大量氫氣與氯氣接觸,迅速化合放出大量熱,使氣體急劇膨脹而發生爆炸。工業上製鹽酸使氯氣在氫氣中燃燒。氫氣在氯氣中爆炸極限是9.8%~52.8%
2、與磷的反應
2P+3Cl₂(少量)==2PCl₃(液體農藥,霧)
2P+5Cl₂(過量)==2PCl(固體農藥,煙)
現象:產生白色煙霧.
3、與其他非金屬的反應
實驗證明,在一定條件下,氯氣還可與S、Si等非金屬直接化合。
2S+Cl₂=點燃=S₂Cl₂
水
在該反應中,氧化劑是Cl₂,還原劑也是Cl₂,本反應是歧化反應。
氯氣遇水會產生次氯酸,次氯酸具有淨化(漂白)作用,用於消毒——溶於水生成的HClO具有強氧化性。
化學方程式是:
Cl₂+H₂O=HCl+HClO(可逆反應)
家用84消毒液與潔廁液混用會導致氯氣中毒的原理就是此反應的逆反應。因為84消毒液的主要成分為NaClO,潔廁液的主要成分為鹽酸,兩者相遇會產生大量熱,並放出氯氣。
二氧化硫與水
SO₂+Cl₂+2H₂O=H₂SO₄+2HCl
鹼溶液
Cl2+2NaOH=NaCl+NaClO+H2O
2Cl2+2Ca(OH)2=CaCl₂+Ca(ClO)2+2H2O
Cl2+ 2OH-(冷) = ClO-+ Cl-+ H2O
3Cl2+ 6OH-(熱) = ClO3-+ 5Cl-+ 3H2O
鹽溶液
Cl2+2FeCl2=2FeCl3
Cl2+Na2S=2NaCl+S (中學階段用來證明氯氣非金屬性和氧化性比硫強。)
氣體
Cl的化學性質比較活潑,容易與多種可燃性氣體發生反應。
如:CH、H₂、C₂H₂等。
有機物
甲烷的取代反應:
CH₄+Cl₂=光照=CH₃Cl+HCl
CH₃Cl+Cl₂==CH₂Cl₂+HCl
CH₂Cl₂+Cl₂==CHCl₃+HCl
CHCl₃+Cl₂==CCl₄+HCl
加成反應:
CH₂=CH₂+Cl₂==CH₂ClCH₂Cl(1,2-二氯乙烷)
和二硫化碳反應:
CS+3Cl=95~100℃=CCl+SCl
主要用途
用途概述
①消毒(自來水常用氯氣消毒,1L水裡約通入0.002g氯氣,消毒原理是其與水反應生成了次氯酸,它的強氧化性能殺死水裡的病菌。而之所以不直接用次氯酸為自來水殺菌消毒,是因為次氯酸易分解難保存、成本高、毒性較大,則用氯氣消毒可使水中次氯酸的溶解、分解、合成達到平衡,濃度適宜,水中殘餘毒性較少。)
②製鹽酸
③工業用於制漂白粉或漂粉精。
④制多種農藥(如六氯環己烷,俗稱666。)
⑤制氯仿、四氯化碳等有機溶劑
⑥制塑膠(如聚氯乙烯塑膠)等 Cl₂可用來製備多種消毒劑,含Cl的消毒劑有ClO₂,NaClO,Ca(ClO)₂。
⑦常用於將FeCl₂氧化成FeCl₃
⑧工業用於海水提溴(Cl₂+2NaBr==Br₂+2NaCl)
漂白
Cl製成的漂白物很多,一般生活中涉及兩種,NaClO和Ca(ClO)₂
一般來說,消毒液是NaClO,因為其穩定,所以是液態,一般用氯氣通入氫氧化鈉中製得。但其價格較高,工業漂白不用,常見於84。
消毒粉則是Ca(ClO)₂,因為其不夠穩定一般為固體,是氯氣通入石灰乳中製得,價格低廉,用於工業漂白,使用方法是加水溶解有效成分是次氯酸鈣,從而漂白。
保存以上漂白劑時,注意密封乾燥,避免陽光直射。因為次氯酸鹽在空氣中會與二氧化碳、水發生反應,產生次氯酸,次氯酸在光照下分解,從而導致漂白劑失效。
製取方法
電解
1.工業生產中用直流電電解飽和食鹽水法來製取氯氣:
2NaCl+2H₂O=通電= H₂↑+Cl₂↑+2NaOH
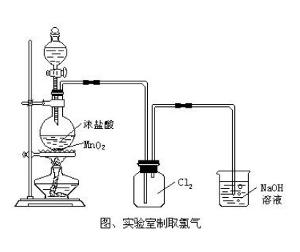
2.實驗室通常用氧化濃鹽酸的方法來製取氯氣:
常見的氧化劑有:MnO₂、K₂Cr₂O₇(重鉻酸鉀)、KMnO₄、Ca(ClO)₂、CoO
發生的反應分別是:
4HCl(濃)+MnO₂ =加熱=MnCl₂+Cl₂↑+2H₂O
14HCl+K₂Cr₂O₇=2KCl+2CrCl₃+7H₂O+3Cl₂↑
16HCl+2KMnO₄=2KCl+2MnCl₂+8H₂O+5Cl₂↑
[這兩個反套用的鹽酸比較稀的話,微熱即可反應,沒有鹽酸可用一種非還原性酸和氯化鈉的混合物代替,也可產生氯氣。]
4HCl+Ca(ClO)₂=CaCl₂+2H₂O+2Cl₂↑{此反應需要的鹽酸很稀,1mol/L便可以劇烈反應。}
H++ClO-+Cl-=H2O+Cl2↑
{只要能電離出H的酸即可參加並且發生此歸中反應;如:草酸。但由於參加反應的酸電離出的H能力的不同,反應的速率也會不同。如果此酸為有機酸,且易揮發,那么要注意不能在強光照的照射下反應,不然氯氣可能會和揮發出來的有機酸發生取代反應發生爆炸或生成有毒物質,如:冰醋酸會和氯氣發生取代反應生成氯醋酸(劇毒固體)、二氯醋酸(固體)、三氯醋酸(固體)}
如不用濃鹽酸,亦可用NaCl(固體)跟濃硫酸來代替.如:
2NaCl+3H₂SO₄(濃)+MnO₂=加熱=2NaHSO₄+MnSO₄+2H₂O+Cl₂↑
注意:切勿被網路上的無知言論欺騙
,,因為會生成大量難以分離且易爆炸的ClO。
 氯氣實驗
氯氣實驗總之,實驗室制氯氣的辦法都圍繞著一個核心:氯離子+氧化劑+酸性環境,氧化劑的氧化性不強的話還需不同程度加熱。
相關口訣
二氧化錳鹽酸逢,隔網熱瓶氯氣生。
鹽水硫酸除雜質,吸收通入火鹼中。
解釋
(1)二氧化錳鹽酸逢,隔網熱瓶氯氣生:這句的意思是說在實驗室中是用二氧化錳與濃鹽酸在燒瓶中隔石棉網加熱的方法來製取氯氣。
(2)鹽水硫酸除雜質:“鹽水”指飽和食鹽水,“雜質”指混在氯氣中的氯化氫和水蒸氣。這句的意思是說使氣體依次通過飽和食鹽水和濃硫酸分別除掉混在氯氣中的氯化氫和水蒸氣。
(3)吸收通入火鹼中:的意思是說多餘的氯氣必須通入火鹼溶液中吸收掉(因為氯氣有毒)。
尾氣處理及離子反應
用NaOH溶液。
2OH + Cl₂ =Clˉ+ ClOˉ + H₂O
第一個瓶子內的是飽和食鹽水是為了除鹽酸。
第二個是濃硫酸是為了除水蒸氣。
物質特性
物理性質
①顏色\氣味\狀態:通常情況下為有刺激性氣味的黃綠色的氣體,劇毒。
②密度:比空氣密度大,密度為3.170g/L
③易液化。熔沸點較低,壓強為101kPa、溫度為-34.6℃時易液化。液態氯為金黃色。如果將溫度繼續冷卻到-101℃時,液氯變成固態氯。
④溶解性:易溶於有機溶劑,難溶於飽和食鹽水。1體積水在常溫下可溶解2體積氯氣,形成氯水。
化學性質
化學式:Cl2
①毒性
氯氣是一種有毒氣體,它主要通過呼吸道侵入人體並溶解在黏膜所含的水分里,生成次氯酸和鹽酸,對上呼吸道黏膜造成有害的影響:次氯酸使組織受到強烈的氧化;鹽酸刺激黏膜發生炎性腫脹,使呼吸道黏膜浮腫,大量分泌黏液,造成呼吸困難,所以氯氣中毒的明顯症狀是發生劇烈的咳嗽。症狀重時,會發生肺水腫,使循環作用困難而致死亡。由食道進入人體的氯氣會使人噁心、嘔吐、胸口疼痛和腹瀉。1L空氣中最多可允許含氯氣0.001毫克,超過這個量就會引起人體中毒。
②助燃性
在一些反應中,氯氣可以支持燃燒
銅在氯氣中燃燒生成氯化銅
化學方程式:Cu+Cl2=CuCl2(條件:點燃)
現象:銅劇烈燃燒並生成棕黃色煙
鐵在氯氣中燃燒生成氯化鐵
化學方程式:2Fe+3Cl2=2FeCl3(條件:點燃)
現象:劇烈燃燒並生成棕褐色煙
 製取氯氣
製取氯氣氫氣在氯氣中燃燒生成氯化氫
化學方程式:H2+Cl2=2HCl(條件:點燃)
現象:劇烈燃燒產生蒼白色火焰
註:氯氣具有強氧化性,因此,產物中像Fe、Cu這樣的變價金屬的化合價表現為最高價。
③與金屬反應
鈉在氯氣中燃燒生成氯化鈉
化學方程式:2Na+Cl2=2NaCl(條件:點燃)
現象:鈉劇烈燃燒並產生白煙
註:氯氣具有強氧化性,因此,產物中像Fe、Cu這樣的變價金屬的化合價表現為最高價。
④與非金屬反應
氫氣在氯氣中燃燒或受到光照生成氯化氫氣體
化學方程式:H2+Cl2=2HCl(條件:點燃或光照)
現象:燃燒發出蒼白色火焰,光照時會發生爆炸現象
⑤與水反應
在該反應中,氧化劑是Cl2,還原劑是Cl2,在水中有歧化現象。
化學方程式是:Cl2+H2O=HCl+HClO
⑥與鹼溶液反應
Cl2+2NaOH=NaCl+NaClO+H2O
2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
上述兩反應中,Cl2作氧化劑和還原劑,有歧化現象。
物質毒性
文獻、期刊報導的毒性作用試驗數據
編號 | 毒性類型 | 測試方法 | 測試對象 | 使用劑量 | 毒性作用 |
|---|---|---|---|---|---|
| 1 | 急性毒性 | 吸入 | 人類 | 500,ppb/2D-I | 1,行為毒性——容忍 |
| 2 | 急性毒性 | 吸入 | 人類 | 2530,mg/m3/30M | 1,肺部,胸部或者呼吸毒性——氣管,支氣管的結構,功能發生變化2,肺部,胸部或者呼吸毒性——肺氣腫3,肺部,胸部或者呼吸毒性——慢性肺水腫 |
| 3 | 急性毒性 | 吸入 | 人類 | 500,ppm/5M | 詳細作用沒有報告除致死劑量以外的其他值 |
| 4 | 急性毒性 | 吸入 | 人類 | 66,ppm/1H | 1,行為毒性——頭痛2,肺部,胸部或者呼吸毒性——咳嗽3,肺部,胸部或者呼吸毒性——呼吸困難 |
| 5 | 急性毒性 | 吸入 | 大鼠 | 293,ppm/1H | 詳細作用沒有報告除致死劑量以外的其他值 |
| 6 | 急性毒性 | 吸入 | 小鼠 | 137,ppm/1H | 詳細作用沒有報告除致死劑量以外的其他值 |
| 7 | 急性毒性 | 吸入 | 狗 | 800,ppm/30M | 1,行為毒性——肌肉無力2,胃腸道毒性——噁心,嘔吐3,肺部,胸部或者呼吸毒性——呼吸困難 |
| 8 | 急性毒性 | 吸入 | 豚鼠 | 3200,ppm/3H | 詳細作用沒有報告除致死劑量以外的其他值 |
| 9 | 急性毒性 | 吸入 | 哺乳動物 | 500,ppm/5M | 詳細作用沒有報告除致死劑量以外的其他值 |
| 10 | 慢性毒性 | 口服 | 大鼠 | 3312,mg/kg/92D-C | 1,血液毒性——凝血因子發生變化 |
| 11 | 慢性毒性 | 口服 | 大鼠 | 109,mg/kg/2Y-C | 1,內分泌毒性——脾臟重量發生變化2,血液毒性——血細胞計數發生變化3,生化毒性——凝血功能異常 |
| 12 | 慢性毒性 | 吸入 | 大鼠 | 9,ppm/6H/6W-I | 1,腎,輸尿管和膀胱毒性——其他變化2,血液毒性——白細胞計數發生變化3,生化毒性——抑制或誘導磷酸酶 |
| 13 | 慢性毒性 | 口服 | 大鼠 | 7568,mg/kg/28D-C | 1,行為毒性——影響食物攝入量,(動物)2,肝毒性——肝重量發生變化3,腎,輸尿管和膀胱毒性——膀胱重量發生變化 |
| 14 | 慢性毒性 | 口服 | 大鼠 | 42,mg/kg/2W-C | 1,大腦毒性——腦重量發生變化2,肝毒性——肝重量發生變化3,腎,輸尿管和膀胱毒性——膀胱重量發生變化 |
| 15 | 慢性毒性 | 吸入 | 大鼠 | 9100,ppb/6H/5D-I | 1,嗅覺毒性——未報告2,肺部,胸部或者呼吸毒性——氣管,支氣管的結構,功能發生變化3,營養和代謝系統毒性——體重下降或體重增加速率下降 |
| 16 | 慢性毒性 | 吸入 | 大鼠 | 400,ppb/6H/2Y-I | 1,嗅覺毒性——未報告 |
| 17 | 慢性毒性 | 口服 | 小鼠 | 153,mg/kg/73W-C | 1,心臟毒性——心臟重量發生變化2,腎,輸尿管和膀胱毒性——膀胱重量發生變化3,慢性病相關毒性——卵巢重量變化 |
| 18 | 慢性毒性 | 吸入 | 小鼠 | 9100,ppb/6H/5D-I | 1,嗅覺毒性——未報告2,肺部,胸部或者呼吸毒性——氣管,支氣管的結構,功能發生變化3,營養和代謝系統毒性——體重下降或體重增加速率下降 |
| 19 | 慢性毒性 | 吸入 | 小鼠 | 400,ppb/6H/2Y-I | 1,嗅覺毒性——未報告 |
| 20 | 慢性毒性 | 吸入 | 猴 | 2300,ppb/6H/1Y-I | 1,嗅覺毒性——未報告2,眼毒性——結膜刺激3,肺部,胸部或者呼吸毒性——其他變化 |
| 21 | 突變毒性 | 鼠傷寒沙門氏菌 | 1800,ug/L | ||
| 22 | 突變毒性 | 人類淋巴細胞 | 20, ppm | ||
| 23 | 突變毒性 | 口服 | 小鼠 | 20,mg/kg/5D,(持續) | |
| 24 | 致癌性 | 口服 | 大鼠 | 5096,mg/kg/2Y-C | 1,致癌性——可能致癌(根據RTECS標準)2,血液毒性——白血病 |
| 25 | 致癌性 | 吸入 | 猴 | 2300,ppb/6H/1Y-I | 1,致癌性——腫瘤(根據RTECS標準)2,肺部,胸部或者呼吸毒性——腫瘤 |
| 26 | 生殖毒性 | 口服 | 大鼠 | 565,mg/kg,雄性配種,8, 周前 | 1,生殖毒性——影響新生兒的生化和代謝 |
生產技術
技術發展史
氯氣的生產方法經歷了漫長的發展過程.1774年瑞典化學家舍勒用軟錳礦(含有二氧化錳)和濃鹽酸作用,首先製得了氯氣:
4HCl(濃)+MnO₂=加熱= MnCl₂+2H₂O+Cl₂↑
然而,由於當時還不能夠大量製得鹽酸,故這種方法只限於實驗室內製取氯氣.後來法國化學家貝托雷把氯化鈉、軟錳礦和濃硫酸的混合物裝入鉛蒸餾器中,經過加熱製得了氯氣:
2NaCl+3H₂SO₄(濃)+MnO₂=加熱=2NaHSO₄+MnSO₄+2H₂O+Cl₂↑
因為此法原料易得,所以,自1774年舍勒製得氯氣到1836年止,人們一直沿用貝托雷發明的方法來生產氯氣。
1836年古薩格發明了一種焦化塔,用來吸收路布藍法生產純鹼(Na₂CO₃)的過程中排出的氯化氫氣體(以前這種含氯化氫的氣體被認為是一種廢氣,從古薩格開始,才得到了充分利用)得到鹽酸,從此鹽酸才成為一種比較便宜的酸,可以廣為利用.舍勒發明的生產氯氣的方法,經過改進,到此時才成為大規模生產氯氣的方法.
1868年狄肯和洪特發明了用氯化銅作催化劑,在加熱時,用空氣中的氧氣來氧化氯化氫氣體製取氯氣的方法:
4HCl+O₂=2H₂O+2Cl₂↑
這種方法被稱為狄肯法(又譯為地康法).
上面這些生產氯氣的方法,雖然在歷史上都起過一定的作用,但是它們與電解法生產氯氣相比,無論從經濟效益還是從生產規模上,都大為遜色.當電解法在生產上付諸實用時,上述生產氯氣的方法就逐漸被淘汰了.
電解法的誕生要追溯到1833年.法拉第經過一系列的實驗,發現當把電流作用在氯化鈉的水溶液時,能夠獲得氯氣:
2NaCl+2H₂O =2NaOH+H₂↑+Cl₂↑
後來,科英國學家瓦特也發現了這種方法,並在1851年獲得了一份關於生產氯氣的英國專利.但是由於當時沒有實用的直流發電機以產生足夠的電流,所以電解法也只能停留在實驗室規模,不能付諸工業生產,而被束之高閣.一直到十九世紀七十至八十年代,出現了比較好的直流發電機,電解法才得到廣泛的套用。從此,氯氣的工業生產跨入了一個新紀元。然而當時電解氯氣所使用的電極為汞,致使電解得到的氯氣、氫氣中混有相當多的汞蒸氣。這種“汞法制氯”對環境危害很大,所以新的“離子交換膜法”製取氯氣,更環保,更節能。(汞法制氯至今仍是製取氯氣的主流方法,如2010年中國有46%的氯氣,2000年西歐50.1%的氯氣都為此法生產的)
氯氣液化
 液氯鋼瓶
液氯鋼瓶氯氣通常可直接利用,但為了製取純淨的氯氣,並考慮貯運的方便,而把一部分氯氣進行液化製成液氯,用鋼瓶或槽車運往用戶。生產中,將從電解槽出來的熱氯氣(其中含有少量氫、氧和二氧化碳等雜質),用冷水洗滌或在換熱器內冷凝脫水,再用硫酸乾燥(必要時可以液氯洗滌以除去水分和雜質),然後送去液化。因濕氯對鐵有腐蝕作用,液化前氯中水分應低於50ppm。
氯氣液化的溫度和壓力範圍很大,工業生產上分為低壓法、中壓法和高壓法。低壓法在氯氣為0.078~0.147MPa(表壓),冷卻溫度為-35~-40℃下進行液化。中壓法在氯氣為0.245~0.49MPa,冷卻溫度為-15~-20℃下進行液化。高壓法的氯氣為0.98~1.17MPa,用15~25℃水冷卻即可液化。高壓法比低壓法能耗低,循環水用量少,但設備費用較高,適於大規模生產使用,中、小型氯鹼廠多採用中壓法。液化率由氯中含氫量來決定。液化尾氣中含氫不得超過4%(體積)。尾氣含60%~70%的氯氣可作為合成鹽酸、氯苯、次氯酸鹽的原料氣,也可經過深度淨化精製,使液化率達到98%~99%。
安全貯運
 氯氣泄漏處理
氯氣泄漏處理液氯在生產和貯運中易發生下列問題:
①液化尾氣中氯氣、氫氣與空氣的混合氣爆炸;
②包裝容器中殘存有機物雜質與氯氣反應爆炸;
③水和食鹽水溶液中銨鹽帶入液化系統,會使液氯中三氯化氮積累而引起爆炸。
當液氯蒸發用完後,所用容器均須用水和鹼水沖洗,以除去被三氯化氮污染的液氯後,方能修理和使用。氯是劇毒物,生產中對受壓容器等設備應嚴格要求,防止氯氣泄漏。空氣中氯氣允許濃度不大於1ppm。
毒理學
人吸入LCLo: 500 ppm/5M。
大鼠吸入LC50: 293 ppm/1H。小鼠吸入LC50: 137 ppm/1H。
氯氣吸入後,主要作用於氣管、支氣管、細支氣管和肺泡,導致相應的病變,部分氯氣又可由呼吸道呼出。人體對氯的嗅閾為0.06mg/m³; 90mg/m³,可致劇咳; 120~180mg/m³,30~60min可引起中毒性肺炎和肺水腫; 300mg/m³時,可造成致命損害; 3000mg/m³時,危及生命; 高達30000mg/m³時,一般濾過性防毒面具也無保護作用。
中毒機理:
氯氣吸入後與黏膜和呼吸道的水作用形成氯化氫和新生態氧。氯化氫可使上呼吸道黏膜炎性水腫、充血和壞死; 新生態氧對組織具有強烈的氧化作用,並可形成具細胞原漿毒作用的臭氧。氯濃度過高或接觸時間較久,常可致深部呼吸道病變,使細支氣管及肺泡受損,發生細支氣管炎、肺炎及中毒性肺水腫。由於刺激作用使局部平滑肌痙攣而加劇通氣障礙,加重缺氧狀態; 高濃度氯吸入後,還可刺激迷走神經引起反射性的心跳停止。氯氣中毒不可以進行人工呼吸。
臨床表現
急性中毒主要為呼吸系統損害的表現。
a. 起病及病情變化一般均較迅速。
b. 可發生咽喉炎、支氣管炎、肺炎或肺水腫,表現為咽痛、嗆咳、咳少量痰、氣急、胸悶或咳粉紅色泡沫痰、呼吸困難等症狀,肺部可無明顯陽性體徵或有乾、濕性羅音。有時伴有噁心、嘔吐等症狀。
c. 重症者尚可出現急性呼吸窘迫綜合徵,有進行性呼吸頻速和窘迫、心動過速,頑固性低氧血症,用一般氧療無效。
d. 少數患者有哮喘樣發作,出現喘息,肺部有哮喘音。
e. 極高濃度時可引起聲門痙攣或水腫、支氣管痙攣或反射性呼吸中樞抑制而致迅速窒息死亡。
f. 病發症主要有肺部繼發感染、心肌損害及氣胸、縱隔氣腫等。
g. X線檢查:可無異常,或有兩側肺紋理增強、點狀或片狀邊界模糊陰影或雲霧狀、蝶翼狀陰影。
h. 血氣分析:病情較重者動脈血氧分壓明顯降低。
i.心電圖檢查:中毒後由於缺氧、肺動脈高壓以及植物神經功能障礙等,可導致心肌損害及心律失常。
眼損害:氯可引起急性結膜炎,高濃度氯氣或液氯可引起眼灼傷。
皮膚損害:液氯或高濃度氯氣可引起皮膚暴露部位急性皮炎或灼傷。
處理
吸入氣體者立即脫離現場至空氣新鮮處,保持安靜及保暖。眼或皮膚接觸液氯時立即用清水徹底沖洗。
吸入後有症狀者至少觀察12小時,對症處理。吸入量較多者應臥床休息,吸氧,給舒喘靈氣霧劑、喘樂寧(Ventolin)或5%碳酸氫鈉加地塞米松等霧化吸入。
急性中毒時需合理氧療; 早期、適量、短程套用腎上腺糖皮質激素; 維持呼吸道通暢; 防治肺水腫及繼發感染。參見《急性刺激性氣體中毒性肺水腫的治療》
其他對症處理。
眼及皮膚灼傷按酸灼傷處理,參見《化學性眼灼傷的治療》和《化學性皮膚灼傷的治療》。
衛生標準
車間空氣衛生標準:中國MAC 1 mg/m³;美國ACGIH TLV-STEL 2.9 mg/m³ (1 ppm); TLV-TWA 1.5 mg/m³ (0.5 ppm)
中國職業病診斷國家標準:職業性急性氯氣中毒診斷標準及處理原則GB4866-1996。
危規:GB2.3類23002(液化的)。原鐵規:劇毒氣體,31001。UN NO.1017。IMDG CODE 2028頁,2類。副危險6.1。
相關儀器
 鈉在氯氣中燃燒
鈉在氯氣中燃燒1、泵吸式氯氣檢測儀
CY-CL2泵吸式氯氣檢測儀採用內置吸氣泵,可快速檢測工作環境中氯氣濃度。泵吸式氯氣檢測儀採用進口電化學感測器,具有非常清晰的大液晶顯示屏,聲光報警提示,保證在非常不利的工作環境下也可以檢測危險氣體並及時提示操作人員預防。
2、攜帶型氯氣檢測儀
HFPCY-CL2攜帶型氯氣泄漏檢測儀可連續檢測作業環境中氯氣濃度。氯氣泄漏檢測儀為自然擴散方式檢測氣體濃度,採用進口電化學感測器,具有極好的靈敏度和出色的重複性;氯氣檢測儀採用嵌入式微控制技術,選單操作簡單,功能齊全,可靠性高,整機性能居國內領先水平。檢測儀外殼採用高強度工程材料、複合彈性橡膠材料精製而成,強度高、手感好。
3、線上式氯氣檢測報警器
HFTCY-CL2線上式氯氣檢測報警器由氣體檢測報警控制器和固定式氯氣檢測器組成,氣體檢測報警控制器可放置於值班室內,對各監測點進行監測控制,氯氣檢測器安裝於氣體最易泄露的地點,其核心部件為氣體感測器。氯氣檢測器將感測器檢測到的氯氣濃度轉換成電信號,通過線纜傳輸到氣體檢測報警控制器,氣體濃度越高,電信號越強,當氣體濃度達到或超過報警控制器設定的報警點時,氣體檢測報警控制器發出報警信號,並可啟動電磁閥、排氣扇等外聯設備,自動排除隱患。線上式氯氣檢測報警器廣泛套用於石油、化工、冶金、電力、煤礦、水廠等環境,有效防止中毒事故的發生。
你身邊的化學(一)
| 世界是由物質構成的,在我們的周圍,衣食住行各個方面都涉及到形形色色,各種各樣的物質。這些物質的組成結構和性質怎樣?物質的變化規律有哪些?化學正是研究這些問題的一門科學。可以說化學物質無處不在,正是化學才使世界變得更加絢麗多彩,魅力無限! |

