發現簡史
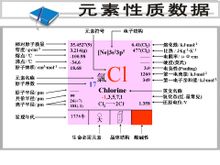 元素性質數據
元素性質數據1774年,瑞典化學家舍勒在從事軟錳礦的研究時發現:軟錳礦與鹽酸混合後加熱就會生成一種令人窒息的黃綠色氣體。當時,大化學家拉瓦錫認為氧是酸性的起源,一切酸中都含有氧。舍勒及許多化學家都堅信拉瓦錫的觀點,認為這種黃綠色的氣體是一種化合物,是由氧和另外一種未知的基所組成的,所以舍勒稱它為“氧化鹽酸”。
但英國化學家戴維卻持有不同的觀點,他想盡了一切辦法也不能從氧化鹽酸中把氧奪取出來,均告失敗。他懷疑氧化鹽酸中根本就沒有氧存在。1810年,戴維以無可辯駁的事實證明了所謂的氧化鹽酸不是一種化合物,而是一種化學元素的單質。他將這種元素命名為“Chlorine”。它的希臘文原意是“綠色”。中文譯名為氯。
自然分布
自然界中游離狀態的氯存在於大氣層中,是破壞臭氧層的主要單質之一。氯氣受紫外線分解成兩個氯原子(自由基)。大多數通常以氯化物(Cl-)的形式存在,常見的主要是氯化鈉(食鹽,NaCl)。
單質Cl₂
氯單質由兩個氯原子構成,化學式為Cl₂。氣態氯單質俗稱氯氣,液態氯單質俗稱液氯。
名稱由來
英文名稱chlorine來自於希臘文khlros(χλωρó',淡綠色),中文取該氣體為綠色之意造了“氯”字,日文與韓文則因為氯是鹽的主要成分之一而稱為“鹽素”(日本漢字寫作“塩素”)。
化合物
無機(括弧內為化合價):氯化物(-1)、次氯酸(+1)、次氯酸鹽(+1)、亞氯酸(+3)、亞氯酸鹽(+3)、氯酸(+5)、氯酸鹽(+5)、高氯酸(+7)、高氯酸鹽(+7)
有機氯化合物。
同位素
氯元素有35Cl和37Cl兩種穩定同位素。核外電子構型都為3S23P5。相對原子質量分別為34.968 852和36.965 903。天然豐度分別為75.77%和24.23%。
氯離子的檢驗
檢驗水中是否含有氯離子可以向其中加入硝酸酸化的銀離子(如硝酸銀)(加入酸性硝酸銀可以排除其他離子干擾),銀離子和氯離子反應會生成氯化銀白色沉澱,反應式:
(Ag+)+(Cl-)→AgCl↓
操作處置與儲存
1、操作注意事項
嚴加密閉,提供充分的局部排風和全面通風。操作人員必須經過專門培訓,嚴格遵守操作規程。建議操作人員佩戴空氣呼吸器,穿帶面罩式膠布防毒衣,戴橡膠手套。遠離火種、熱源,工作場所嚴禁吸菸。遠離易燃、可燃物。防止氣體泄漏到工作場所空氣中。避免與醇類接觸。搬運時輕裝輕卸,防止鋼瓶及附屬檔案破損。配備相應品種和數量的消防器材及泄漏應急處理設備。
2、儲存注意事項
儲存於陰涼、通風的庫房。遠離火種、熱源。庫溫不超過30℃,相對濕度不超過80%。應與易燃物(可燃物)、醇類、食用化學品分開存放,切忌混儲。儲區應備有泄漏應急處理設備。應嚴格執行極毒物品“五雙”管理制度。
物理性質
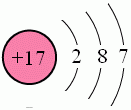 氯原子結構示意圖
氯原子結構示意圖氯氣為黃綠色氣體,密度比空氣大(3.214g/L),熔點−101.0℃,沸點−34.4℃,有強烈的刺激性氣味。
氯氣分子由兩個氯原子組成,微溶於水,易溶於鹼液,易溶於四氯化碳、二硫化碳等有機溶劑。
氯有26種同位素,其中只有Cl和Cl是穩定的,其餘同位素均具有放射性。
原子半徑:100pm
核外電子排布:[Ne]3s3p化合價:±1, 3, 5, 7
晶體結構:斜方晶系
電負性:3.16 (鮑林標度)
第一電離能:1251.2 kJ/mol
營養功能
參與光合作用
在光合作用中,氯作為錳的輔助因子參與水的光解反應。水光解反應是光合作用最初的光化學反應,氯的作用位點在光系統II。研究工作表明,在缺氯條件下,植物細胞的增殖速度降低,葉面積減少,生長量明顯下降(大約60%),但氯並不影響植物體中光合速率。由此可見,氯對水光解放O2反應的影響不是直接作用,氯可能是錳的配合基,有助於穩定錳離子,使之處於較高的氧化狀態。氯不僅為希爾反應放O2所必需,它還能促進光合磷酸化作用。
調節氣孔運動
氯對氣孔的開張和關閉有調節作用。當某些植物葉片氣孔開張時,K+流入是由有機酸陰離子(主要是蘋果酸根)作為陪伴離子,這些離子在代謝過程中是靠消耗澱粉產生的;但是對某些澱粉含量不多的作物(如洋蔥),當K+流入保衛細胞時,由於缺少蘋果酸根則需由Cl-作為陪伴離子。缺氯時,洋蔥的氣孔就不能自如地開關,而導致水分過多地損失。由於氯在維持細胞膨壓、調節氣孔運動方面的明顯作用,從而能增強植物的抗旱能力。
激活H+-泵ATP酶
以往人們了解較多的是原生質上的H+-ATP酶,它受K+的激活。而在液泡膜上也存在有H+-ATP酶。與原生質上的H+-ATP酶不同,這種酶不受一價陽離子的影響,而專靠氯化物激活。該酶可以把原生質中的H+轉運到液泡內,使液泡膜內外產生pH梯度(胞液,pH>7;液泡,pH<<6)。缺氯時,植物根的伸長嚴重受阻,這可能和氯的上述功能有關。因為缺氯時,影響活性溶質滲入液泡內,從而使根的伸長受到抑制(Hagerh和Helrnle,1981)。
抑制病害發生
施用含氯肥料對抑制病害的發生有明顯作用。據報導,2013以前年至少有10種作物的15個品種,其葉、根病害可通過增施含氯肥料而明顯減輕。例如冬小麥的全蝕病、條鏽病,春小麥的葉鏽病、枯斑病,大麥的根腐病,玉米的莖枯病,馬鈴薯的空心病、褐心病等。根據研究者的推論,氯能抑制土壤中銨態氮的硝化作用。當施入銨態氮肥時,氯使大多數銨態氮不能被轉化,而迫使作物吸收更多的銨態氮;在作物吸收銨態氮肥的同時,根系釋放出H+離子,使根際酸度增加。許多土壤微生物由於適宜在酸度較大的環境中大量繁衍,從而抑制了病菌的滋生,如小麥因施用含氯肥料而減輕了全蝕病病害的發生。還有一些研究者從C1-和NO3-存在吸收上的競爭性來解釋。施含氯肥料可降低作物體內NO3-的濃度,一般認為NO3-含量低的作物很少發生嚴重的根腐病。
其他作用
在許多陰離子中,Cl-是生物化學性質最穩定的離子,它能與陽離子保持電荷平衡,維持細胞內的滲透壓。植物體內氯的流動性很強,輸送速度較快,能迅速進入細胞內,提高細胞的滲透壓和膨壓。滲透壓的提高可增強細胞吸水,並提高植物細胞和組織束縛水分的能力。這就有利於促進植物從外界吸收更多的水分。在乾旱條件下,也能減少植物丟失水分。提高膨壓後可使葉片直立,延長功能期。作物缺氯時,葉片往往失去膨壓而萎蔫。氯對細胞液緩衝體系也有一定的影響。氯在離子平衡方面的作用,可能有特殊的意義。
氯對酶活性也有影響。氯化物能激活利用谷氨醯胺為底物的天冬醯胺合成酶,促進天冬醯胺和谷氨酸的合成。氯在氮素代謝過程中有重要作用。
適量的氯有利於碳水化合物的合成和轉化。
化學性質
 集氣瓶中的氯氣
集氣瓶中的氯氣氯氣遇水歧化為鹽酸和次氯酸,次氯酸不穩定易分解放出遊離氧,所以氯氣具有漂白性(比SO強且加熱不恢復原色)。
氯氣也能和很多有機物發生加成或取代反應,在生活中有廣泛套用。
氯氣具有較大的毒性,曾被用作軍用毒氣。
Cl-檢驗
檢驗水中是否含有氯離子可以向其中加入可溶的銀離子(硝酸銀)(加入酸性硝酸銀可以排除其他離子干擾),銀離子和氯離子反應會生成氯化銀白色沉澱。再取白色沉澱,加入稀硝酸,沉澱不溶解,則說明含氯離子。
含氧酸
1.次氯酸(HClO)及其鹽(1) 製備
①通氯氣於冰水中:Cl₂ + H₂O = HClO + HCl
②通氯於鹼液中可得次氯酸鹽:Cl₂+ 2NaOH → NaClO + NaCl + H₂O
③工業上用電解冷濃食鹽水並劇烈攪拌來製備NaClO
(2)性質
①是弱酸,但為很強的氧化劑,且具有漂白性
②受熱易發生氧化還原反應3ClO→ ClO₃ + 2Cl
(3) 用途
製造漂白粉Ca(ClO)₂
漂白粉:Cl₂與Ca(OH)₂反應 2Cl₂ + 2Ca(OH)₂ = Ca(ClO)₂ +CaCl₂ +2H₂O)
2.亞氯酸(HClO₂)及其鹽
亞氯酸是唯一的亞鹵酸,非常不穩定。
(1) 製備
①ClO₂在水中分解:2ClO₂+H₂O=HClO₂+HClO₃
②通ClO₂於Na₂O₂或NaOH與H₂O₂可得亞氯酸鹽 2ClO₂+Na₂O₂=2NaClO₂+O₂;2ClO₂+H₂O₂+OH2ClO=2-+O₂+H₂O
(2) 性質與用途
①非常不穩定的化合物,但亞氯酸鹽較穩定。
②具有漂白性
3.氯酸(HClO₃)及其鹽
濃度高於40%則不穩定
(1) 製備
①次氯酸根水溶液加熱,產生自身氧化還原反應(歧化反應):3ClO→ ClO₃ + 2Cl
②電解熱氯化鈉水溶液並加以攪拌:3Cl₂ + 6OH → ClO₃ + 5Cl + 3H₂O
(2) 性質及用途
①氯酸和氯酸鹽皆為強氧化劑
③KClO₃受熱反應
A.無催化劑,微熱:4KClO₃ =3KClO₄ + KCl (約100℃)
B.催化劑(MnO₂):2KClO₃ =2KCl + 3O₂↑ (約300℃)
4.高氯酸(HClO₄)及其鹽
(1) 製備
①低壓蒸餾KClO₄與H₂SO₄的混合液:KClO₄ + H₂SO₄ = HClO₄ + KHSO₄
②電解食鹽水時,陽極產生的氯氣被氧化:1/2Cl₂ + 4H₂O =ClO₄+ 8H + 7e
③氯酸鹽受熱分解:4KClO₃ = 3KClO₄ + KCl
(2) 性質與用途
①氯最穩定的含氧酸,不易分解
②非常強的酸(高中範圍內最強的酸,強於100%硫酸,但弱於氟銻酸等超強酸)
主要用途
工業
氯主要用於化學工業尤其是有機合成工業上,以生產塑膠、合成橡膠、染料及其他化學製品或中間體,還用於漂白劑、消毒劑、合成藥物等。氯氣亦用作製造漂白粉、漂白紙漿和布匹、合成鹽酸、製造氯化物、飲水消毒、合成塑膠和農藥等。提煉稀有金屬等方面也需要許多氯氣。
生理
氯是人體必需常量元素之一,是維持體液和電解質平衡中所必需的,也是胃液的一種必需成分。自然界中常以氯化物形式存在,最普通形式是食鹽。氯在人體含量平均為1.17g/kg,總量約為82~100g,占體重的0.15%,廣泛分布於全身。主要一氯離子形式與鈉、鉀化合存在。其中氯化鉀主要在細胞內液,而氯化鈉主要在細胞外液中。
膳食氯幾乎完全來源於氯化鈉,僅少量來自氯化鉀。因此食鹽及其加工食品醬油、醃製肉或煙燻食品、醬菜類以及鹹味食品等都富含氯化物。一般天然食品中氯的含量差異較大;天然水中也幾乎都含有氯。
主要生理功能:
1.維持體液酸鹼平衡。
 氯離子分析儀
氯離子分析儀2.氯離子與鈉離子是細胞外液中維持滲透壓的主要離子,二者約占總離子數的80%左右,調節與控制著細胞外液的容量和滲透壓。
3.參與血液CO二價離子運輸。
4.氯離子還參與胃液中胃酸形成,胃酸促進維生素B12和鐵的吸收;激活唾液澱粉酶分解澱粉,促進食物消化;刺激肝臟功能,促使肝中代謝廢物排出;氯還有穩定神經細胞膜電位的作用等。
安全防護
氯氣對眼、呼吸道黏膜有刺激作用,能引起流淚、咳嗽、咳少量痰、胸悶、氣管炎和支氣管炎、肺水腫等呼吸道症狀,嚴重的會導致休克、死亡。一戰時曾經被用作化學武器(窒息性毒劑)
氯氣對環境有嚴重危害,對水體可造成污染。
同時,氯氣可助燃,濕潤的氯氣具有強腐蝕性。
所以接觸氯氣時,需注意全身嚴格防護,嚴禁直接嗅聞、接觸氯氣,不得將含氯氣的廢氣直接排放到大氣中。
生命元素
化學元素周期表
| 族→ | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 電子層 | 0族電子數 | |
| 周期↓ | I A | 0 | |||||||||||||||||||
| 1 | 1 H 氫 | 2 He 氦 | K | 2 | |||||||||||||||||
| II A | III A | IV A | V A | VI A | VII A | ||||||||||||||||
| 2 | 3 Li 鋰 | 4 Be 鈹 | 5 B 硼 | 6 C 碳 | 7 N 氮 | 8 O 氧 | 9 F 氟 | 10 Ne 氖 | L K | 8 2 | |||||||||||
| 3 | 11 Na 鈉 | 12 Mg 鎂 | 13 Al 鋁 | 14 Si 矽 | 15 P 磷 | 16 S 硫 | 17 Cl 氯 | 18 Ar 氬 | M L K | 8 8 2 | |||||||||||
| III B | IV B | V B | VI B | VII B | VIII | I B | II B | ||||||||||||||
| 4 | 19 K 鉀 | 20 Ca 鈣 | 21 Sc 鈧 | 22 Ti 鈦 | 23 V 釩 | 24 Cr 鉻 | 25 Mn 錳 | 26 Fe 鐵 | 27 Co 鈷 | 28 Ni 鎳 | 29 Cu 銅 | 30 Zn 鋅 | 31 Ga 鎵 | 32 Ge 鍺 | 33 As 砷 | 34 Se 硒 | 35 Br 溴 | 36 Kr 氪 | N M L K | 8 18 8 2 | |
| 5 | 37 Rb 銣 | 38 Sr 鍶 | 39 Y 釔 | 40 Zr 鋯 | 41 Nb 鈮 | 42 Mo 鉬 | 43 Tc 鎝 | 44 Ru 釕 | 45 Rh 銠 | 46 Pd 鈀 | 47 Ag 銀 | 48 Cd 鎘 | 49 In 銦 | 50 Sn 錫 | 51 Sb 銻 | 52 Te 碲 | 53 I 碘 | 54 Xe 氙 | O N M L K | 8 18 18 8 2 | |
| 6 | 55 Cs 銫 | 56 Ba 鋇 | 57- 71 鑭系 | 72 Hf 鉿 | 73 Ta 鉭 | 74 W 鎢 | 75 Re 錸 | 76 Os 鋨 | 77 Ir 銥 | 78 Pt 鉑 | 79 Au 金 | 80 Hg 汞 | 81 Tl 鉈 | 82 Pb 鉛 | 83 Bi 鉍 | 84 Po 釙 | 85 At 砹 | 86 Rn 氡 | P O N M L K | 8 18 32 18 8 2 | |
| 7 | 87 Fr 鍅 | 88 Ra 鐳 | 89- 103 錒 | 104 Rf 鑪 | 105 Db | 106 Sg | 107 Bh | 108 Hs | 109 Mt | 110 Ds 鐽 | 111 Rg 錀 | 112 Uub | 113 Uut | 114 Uuq | 115 Uup | 116 Uuh | 117 Uus | 118 Uuo | |||
| 鑭系元 素 | 57 La 鑭 | 58 Ce 鈰 | 59 Pr 鐠 | 60 Nd 釹 | 61 Pm 鉕 | 62 Sm 釤 | 63 Eu 銪 | 64 Gd 釓 | 65 Tb 鋱 | 66 Dy 鏑 | 67 Ho 鈥 | 68 Er 鉺 | 69 Tm 銩 | 70 Yb 鐿 | 71 Lu 鑥 | ||||||
| 錒系元 素 | 89 Ac 錒 | 90 Th 釷 | 91 Pa 鏷 | 92 U 鈾 | 93 Np 鎿 | 94 Pu 鈽 | 95 Am 鎇 | 96 Cm 鋦 | 97 Bk 錇 | 98 Cf 鐦 | 99 Es 鑀 | 100 Fm 鐨 | 101 Md 鍆 | 102 No 鍩 | 103 Lr 鐒 | ||||||
化學元素(一)
人體所需礦物質
拼音是lu的漢字
| 拼音是lu的漢字共有160個,如下: |
| 慮|蘆|盧|碌|陸|露|路|錄|鹿|爐|魯|鹵|顱|廬|擄|綠|虜|賂|戮|潞|祿|麓|鱸|櫨|淥|瀘|轤|氌|簏|櫓|壚|臚|嚕|鑥|轆|漉|擼|璐|鸕|鷺|艫|侓|勎|勠|嚕|嚧|圥|坴|塶|塷|壚|娽|峍|廘|廬|彔|挔|捋|捛|攄|摝|擄|擼|攄|攎|枦|椂|樐|櫓|櫨|氌|淕|淥|濾|滷|瀂|濾|瀂|瀘|爐|獹|玈|琭|瓐|甪|盝|睩|矑|硉|磠|磠|祿|稑|籙|簬|簵|簶|籙|籚|粶|緑|纑|罏|膟|臚|舮|艣|艪|艫|菉|蓾|蕗|蘆|虂|虜|螰|蠦|觮|賂|趢|踛|蹗|轆|轤|醁|鈩|錄|録|錴|鏀|鏴|鐪|鑥|鑪|顱|騄|騼|髗|魯|魲|鯥|鱸|鴼|鵦|鵱|鷺|鸕|鹵|黸|率|鋁|驢|旅|屢|呂|律|氯|縷|侶|履 |

