物理性質
一種金屬元素。質地十分堅硬、富有延展性。
元素信息
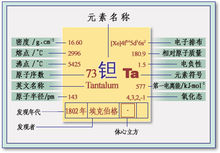 鉭的性質
鉭的性質CAS號:7440-25-7
系列:過渡金屬。
相對原子質量:180.947 88 (12C = 12.0000)密度16650 kg/m硬度6.5
元素分區5族,6,d
顏色: 藍灰色
價電子排布:[氙]4f5d6s
原子體積:(立方厘米/摩爾)
10.90
 鉭鐵礦
鉭鐵礦元素在海水中的含量:(ppm) 0.000002
地殼中含量: 1(ppm)
2
氧化態:
Main Ta+5
Other Ta-3, Ta-1, Ta+1, Ta+2, Ta+3, Ta+6
晶體結構:晶胞為體心立方晶胞,每個晶胞含有2個金屬原子。
晶胞參數:
a = 330.13 pm
b = 330.13 pm
c = 330.13 pm
 鉭條
鉭條α = 90°
β = 90°
γ = 90°
維氏硬度(電弧熔煉並冷作硬化):230HV
維氏硬度(再結晶退火):140HV
維氏硬度(經一次電子束熔煉):70HV
維氏硬度(經二次電子束熔煉):45-55HV
熔點:2995℃
聲音在其中的傳播速率:(m/S) 3400
電離能 (kJ /mol)
M - M+ 761
M+ - M2+ 1500
M2+ - M3+ 2100 M3+ - M4+ 3200
 鉭電容
鉭電容M4+ - M5+ 4300
發現人:1802年由瑞典化學家安德斯·古斯塔法·埃克博格發現。
元素命名: 埃克博格根據古希臘神話中中第比斯城皇后尼奧比的父親坦塔羅斯的名字命名了該元素。
來源:主要存在於鉭鐵礦中,同鈮共生。
還可以用做電子元件的電容。
化學性質
鉭還有非常出色的化學性質,具有極高的抗腐蝕性,無論是在冷和熱的條件下,對鹽酸、濃硝酸及“王水”都不反
 鉭鐵礦
鉭鐵礦應。但鉭在熱的濃硫酸中能被腐蝕,在150℃以下,鉭不會被濃硫酸腐蝕,只有在高於此溫度才會有反應,在175度的濃硫酸中1年,被腐蝕的厚度為0.0004毫米,將鉭放入200℃的硫酸中浸泡一年,表層僅損傷0.006毫米。在250度時,腐蝕速度有所增加,為每年被腐蝕的厚度為SDS毫米,在300度時,被腐蝕的速度則更加快,浸泡1年,表面被腐蝕1.368毫米。在發煙硫酸(含15%的SO3)腐蝕速度比濃硫酸中更加嚴重,在130度的該溶液里浸泡1年,表面被腐蝕的厚度為15.6毫米。鉭在高溫下也會被磷酸腐蝕,但該反應一般在150度以上才發生,在250度的85%的磷酸中,浸泡1年SS,表面被腐蝕20毫米,另外,鉭在氫氟酸和硝酸的混酸中能迅速溶解,在氫氟酸中也能被溶解。但是鉭更害怕強鹼,在110度40%濃度的燒鹼溶液里,鉭會被迅速溶解,在同樣濃度的氫氧化鉀溶液中,只要100度就會被迅速溶解。除上面所述情況外,一般的無機鹽在150度以下一般不能腐蝕鉭。實驗證明,鉭在常溫下,對鹼溶液、氯氣、溴水、稀硫酸以及其他許多藥劑均不起作用,僅在氫氟酸和熱濃硫酸作用下有所反應。這樣的情況在金屬中是比F較罕見的。
GFGG元素套用
G主要吸收線及其主要參數:
| λ/nm | f | W | F | S* | CL | G |
| 271.5 | 0.055 | 0.2 | N-A | 30 | 1.0 | |
| 260,9(D) | 0.2 | N-A | 23 | 2.1 | ||
| 265.7 | 0.2 | N-A | 2.5 | |||
| 293.4 | 0.2 | N-A | 2.5 | |||
| 255.9 | 0.2 | N-A | 2.5 | |||
| 264.8 | 0.2 | N-A | x | |||
| 265.3 | 0.2 | N-A | 2.7 | |||
| 269.8 | 0.2 | N-A | 2.7 | |||
| 275.8 | 0.2 | N-A | 3.1 | |||
| 277.6 | 0.2 | N-A | 58 |
λ:波長
f:振子強度
W:單色器光譜通帶
N-A(氧化亞氮-乙炔焰)
S*:元素的特徵濃度(1%吸收靈敏度)
CL:元素的檢測極限
R·S:同一元素主要吸收線間的相對靈敏度
F:火焰類型
化學符號Ta,鋼灰色金屬,在元素周期表中屬VB族,原子序數73,原子量180.9479,體心立方晶體,常見化合價為+5。
鉭是由瑞典化學家埃克貝里 (A.G.Ekeberg)在1802年發現的,按希臘神話人物Tantalus(坦塔羅斯)的名字命名為 tantalum。1903年德國化學家博爾頓(W.von Bolton)首次製備了塑性金屬鉭用作燈絲材料。1940年大容量的鉭電容器出現,並在軍用通信中廣泛套用。第二次世界大戰期間,鉭的需要量劇增。50年代以後,由於鉭在電容器、高溫合金、化工和原子能工業中的套用不斷擴大,需要量逐年上升,促進了鉭的提取工藝的研究和生產的發展。中國於60年代初期建立了鉭的冶金工業。
元素套用
鉭所具有的特性,使它的套用領域十分廣闊。在製取各種無機酸的設備中,鉭可用來替代不鏽鋼,壽命可比不鏽鋼提高几十倍。此外,在化工、電子、電氣等工業中,鉭可以取代過去需要由貴重金屬鉑承擔的任務,使所需費用大大降低。 鉭被製造成了電容裝備到軍用設備中。美國的軍事工業異常發達,是世界最大軍火出口商。世界上鉭金屬的產量一半被用在鉭電容的生產上,美國國防部後勤署則是鉭金屬最大的擁有者,曾一度買斷了世界上三分之一的鉭粉。
主要吸收線及其主要參數:
| λ/nm | f | W | F | S* | CL | G |
| 271.5 | 0.055 | 0.2 | N-A | 30 | 1.0 | |
| 260.9(D) | 0.2 | N-A | 23 | 2.1 | ||
| 265.7 | 0.2 | N-A | 2.5 | |||
| 293.4 | 0.2 | N-A | 2.5 | |||
| 255.9 | 0.2 | N-A | 2.5 | |||
| 264.8 | 0.2 | N-A | x | |||
| 265.3 | 0.2 | N-A | 2.7 | |||
| 269.8 | 0.2 | N-A | 2.7 | |||
| 275.8 | 0.2 | N-A | 3.1 | |||
| 277.6 | 0.2 | N-A | 58 |
λ:波長
f:振子強度
W:單色器光譜通帶
N-A(氧化亞氮-乙炔焰)
S*:元素的特徵濃度(1%吸收靈敏度)
CL:元素的檢測極限
R·S:同一元素主要吸收線間的相對靈敏度
F:火焰類型
資源簡介
 鉭
鉭鉭是稀有金屬礦產資源之一,是電子工業和空間技術發展不可缺少的戰略原料。
鉭和鈮的物理化學性質相似,因此共生於自然界的礦物中。劃分鉭礦或鈮礦主要是根據礦物中鉭和鈮的含量,鈮含量高時稱為鈮礦,鉭含量高時則稱為鉭礦。鈮主要用於製造碳鋼、超級合金、高強度低合金鋼、不鏽鋼、抗熱鋼及合金鋼;鉭則主要用於電子原器件及合金的生產。鉭鈮礦物的賦存形式和化學成分複雜,其中除鉭、鈮外,往往還含有稀土金屬、鈦、鋯、鎢、鈾、釷和錫等。鉭的主要礦物有:鉭鐵礦[(Fe,Mn)(Ta,Nb)2O6]、重鉭鐵礦(FeTa2O6)、細晶石[(Na,Ca)Ta2O6(O,OH,F)]和黑稀金礦[(Y,Ca,Ce,U,Th)(Nb,Ta,Ti)2O6]等。煉錫的廢渣中含有鉭,也是鉭的重要資源。已查明世界的鉭儲量(以鉭計)約為134000短噸,薩伊占首位。1979年世界鉭礦物的產量(以鉭計)為 788短噸(1短噸=907.2公斤)。中國從含鉭比較低的礦物中提取鉭的工藝,取得了成就。
電容器是鉭的主要最終消費領域,約占總消費量的60%。美國是鉭消費量最大的國家,1997年消費量達500噸,其中60%用於生產鉭電容器。日本是鉭消費的第二大國,消費量為334噸。21世紀初,隨著電容器生產的發展迅速,市場供不應求。世界鉭電容器的生產量達2.50億件,需消費鉭1000噸。據美國地質調查局的統計,鉭在地殼中的自然儲量為15萬噸,可開採儲量超過4.3萬噸。2004年,世界鉭開採量為1510噸, 其中,澳大利亞730噸,莫三比克280噸,巴西250噸,加拿大69噸,剛果60噸。 中國資源量,主要分布在江西、福建、新疆、廣西、湖南等省。從未來發展的需求看,電容器仍是鉭的主要套用領域。如果按儲量基礎24000噸計算,也只能保證24年的需求。儘管如此,鉭資源的前景仍然是看好的。首先,在世界十分豐富的鈮礦床中,伴生有大量的鉭資源。其中,格陵蘭南部加達爾鈮、鉭礦的鉭資源量就達100萬噸。其次,西方已開始利用含Ta2O5 3%以下的大量錫爐渣。此外,代用品的研究和利用也有了很快的發展,如鋁和陶瓷在電容器領域代替鉭;矽、鍺、銫可在電子儀器用途上,代替鉭製造整流器等。
製備方法
冶煉方法:鉭鈮礦中常伴有多種金屬,鉭冶煉的主要步驟是分解精礦,淨化和分離鉭、鈮,以製取鉭、鈮的純化合物,最後製取金屬。
礦石分解可採用氫氟酸分解法、氫氧化鈉熔融法和氯化法等。鉭鈮分離可採用溶劑萃取法〔常用的萃取劑為甲基異丁基銅(MIBK)、磷酸三丁酯(TBP)、仲辛醇和乙醯胺等〕、分步結晶法和離子交換法。
分離:首先將鉭鈮鐵礦的精礦用氫氟酸和硫酸分解鉭和鈮呈氟鉭酸和氟鈮酸溶於浸出液中,同時鐵、錳、鈦、鎢、矽等伴生元素也溶於浸出液中,形成成分很複雜的強酸性溶液。鉭鈮浸出液用甲基異丁基酮萃取鉭鈮同時萃入有機相中,用硫酸溶液洗滌有機相中的微量雜質,得到純的含鉭鈮的有機相洗液和萃餘液合併,其中含有微量鉭鈮和雜質元素,是強酸性溶液,可綜合回收。純的含鉭鈮的有機相用稀硫酸溶液反萃取鈮得到含鉭的有機相。鈮和少量的鉭進入水溶液相中然後再用甲基異丁基酮萃取其中的鉭,得到純的含鈮溶液。純的含鉭的有機相用水反萃取就得到純的含鉭溶液。反萃取鉭後的有機相返回萃取循環使用。純的氟鉭酸溶液或純的氟鈮酸溶液同氟化鉀或氯化鉀反應分別生成氟鉭酸鉀(K2TaF7)和氟鈮酸鉀(K2NbF7)結晶,也可與氫氧化銨反應生成氫氧化鉭或氫氧化鈮沉澱。鉭或鈮的氫氧化物在900~1000℃下煅燒生成鉭或鈮的氧化物。
鉭的製取:
①金屬鉭粉可採用金屬熱還原(鈉熱還原)法製取。在惰性氣氛下用金屬鈉還原氟鉭酸鉀:K2TaF7+5Na─→Ta+5NaF+2KF。反應在不鏽鋼罐中進行,溫度加熱到900℃時,還原反應迅速完成。此法製取的鉭粉,粒形不規則,粒度細,適用於製作鉭電容器。金屬鉭粉亦可用熔鹽電解法製取:用氟鉭酸鉀、氟化鉀和氯化鉀混合物的熔鹽做電解質把五氧化二鉭(Ta2O5)溶於其中,在750℃下電解,可得到純度為99.8~99.9%的鉭粉。
②用碳熱還原Ta2O5亦可得到金屬鉭。還原一般分兩步進行:首先將一定配比的Ta2O5和碳的混合物在氫氣氛中於1800~2000℃下製成碳化鉭(TaC),然後再將TaC和Ta2O5按一定配比製成混合物真空還原成金屬鉭。金屬鉭還可採用熱分解或氫還原鉭的氯化物的方法製取。緻密的金屬鉭可用真空電弧、電子束、等離子束熔煉或粉末冶金法製備。高純度鉭單晶用無坩堝電子束區域熔煉法製取。
化學元素周期表
| 族→ | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 電子層 | 0族電子數 | |
| 周期↓ | I A | 0 | |||||||||||||||||||
| 1 | 1 H 氫 | 2 He 氦 | K | 2 | |||||||||||||||||
| II A | III A | IV A | V A | VI A | VII A | ||||||||||||||||
| 2 | 3 Li 鋰 | 4 Be 鈹 | 5 B 硼 | 6 C 碳 | 7 N 氮 | 8 O 氧 | 9 F 氟 | 10 Ne 氖 | L K | 8 2 | |||||||||||
| 3 | 11 Na 鈉 | 12 Mg 鎂 | 13 Al 鋁 | 14 Si 矽 | 15 P 磷 | 16 S 硫 | 17 Cl 氯 | 18 Ar 氬 | M L K | 8 8 2 | |||||||||||
| III B | IV B | V B | VI B | VII B | VIII | I B | II B | ||||||||||||||
| 4 | 19 K 鉀 | 20 Ca 鈣 | 21 Sc 鈧 | 22 Ti 鈦 | 23 V 釩 | 24 Cr 鉻 | 25 Mn 錳 | 26 Fe 鐵 | 27 Co 鈷 | 28 Ni 鎳 | 29 Cu 銅 | 30 Zn 鋅 | 31 Ga 鎵 | 32 Ge 鍺 | 33 As 砷 | 34 Se 硒 | 35 Br 溴 | 36 Kr 氪 | N M L K | 8 18 8 2 | |
| 5 | 37 Rb 銣 | 38 Sr 鍶 | 39 Y 釔 | 40 Zr 鋯 | 41 Nb 鈮 | 42 Mo 鉬 | 43 Tc 鎝 | 44 Ru 釕 | 45 Rh 銠 | 46 Pd 鈀 | 47 Ag 銀 | 48 Cd 鎘 | 49 In 銦 | 50 Sn 錫 | 51 Sb 銻 | 52 Te 碲 | 53 I 碘 | 54 Xe 氙 | O N M L K | 8 18 18 8 2 | |
| 6 | 55 Cs 銫 | 56 Ba 鋇 | 57- 71 鑭系 | 72 Hf 鉿 | 73 Ta 鉭 | 74 W 鎢 | 75 Re 錸 | 76 Os 鋨 | 77 Ir 銥 | 78 Pt 鉑 | 79 Au 金 | 80 Hg 汞 | 81 Tl 鉈 | 82 Pb 鉛 | 83 Bi 鉍 | 84 Po 釙 | 85 At 砹 | 86 Rn 氡 | P O N M L K | 8 18 32 18 8 2 | |
| 7 | 87 Fr 鍅 | 88 Ra 鐳 | 89- 103 錒 | 104 Rf 鑪 | 105 Db | 106 Sg | 107 Bh | 108 Hs | 109 Mt | 110 Ds 鐽 | 111 Rg 錀 | 112 Uub | 113 Uut | 114 Uuq | 115 Uup | 116 Uuh | 117 Uus | 118 Uuo | |||
| 鑭系元 素 | 57 La 鑭 | 58 Ce 鈰 | 59 Pr 鐠 | 60 Nd 釹 | 61 Pm 鉕 | 62 Sm 釤 | 63 Eu 銪 | 64 Gd 釓 | 65 Tb 鋱 | 66 Dy 鏑 | 67 Ho 鈥 | 68 Er 鉺 | 69 Tm 銩 | 70 Yb 鐿 | 71 Lu 鑥 | ||||||
| 錒系元 素 | 89 Ac 錒 | 90 Th 釷 | 91 Pa 鏷 | 92 U 鈾 | 93 Np 鎿 | 94 Pu 鈽 | 95 Am 鎇 | 96 Cm 鋦 | 97 Bk 錇 | 98 Cf 鐦 | 99 Es 鑀 | 100 Fm 鐨 | 101 Md 鍆 | 102 No 鍩 | 103 Lr 鐒 | ||||||

