發現簡史
 硼
硼硼化合物的發現和使用最早可以追述到古埃及,如古代埃及製造玻璃時已使用硼砂作熔劑,古代煉丹家也使用過硼砂,但是硼酸的化學成分直到19世紀初還是個謎。
1808年,英國化學家戴維在用電解的方法發現鉀後不久,又用電解熔融的三氧化二硼的方法製得棕色的硼,同年法國化學家蓋·呂薩克和泰納用金屬鉀還原無水硼酸製得單質硼。
實際上,他們都沒有生產出純淨的硼元素,而極純的硼幾乎不可能獲得。更純淨的硼是由亨利·穆瓦桑於1892年提取的。最終,美國的E·Weintraub點燃了氯化硼蒸氣和氫的混合物,生產出了完全純淨的硼。這種物質獲取的硼被發現性質和以前的報告有很大的不同。
硼被命名為Boron,它的命名源自阿拉伯文,原意是“焊劑”的意思。說明古代阿拉伯人就已經知道了硼砂具有熔融金屬氧化物的能力,在焊接中用做助熔劑。直至1981年,人們才認識到硼不僅是植物,也且是動物與人類所必須的元素。當時報導的一項早期研究結果提示了硼的必要性,在這項研究中發現,給雛雞餵飼維生素D不足但並不完全缺乏的飼料時,硼能夠改善其骨骼鈣化。
含量分布
硼約占地殼組成的0.001%,它在自然界中主要礦石是硼砂和白硼鈣石等。中國西藏自治區許多含硼鹽湖,蒸發乾涸後有大量硼砂晶體堆積。
硼在自然界中的含量相當豐富。天然產的硼砂(Na₂B₄O₇·10H₂O),在中國古代就已作為藥物,叫做蓬砂或盆砂,可能是從西藏傳到印度,再從印度傳到歐洲去的。
理化性質
物理性質
 硼
硼單質硼為黑色或深棕色粉末,在空氣中氧化時由於三氧化二硼膜的形成而阻礙內部硼繼續氧化。常溫時能與氟反應,不受鹽酸和氫氟酸水溶液的腐蝕。硼不溶於水,粉末狀的硼能溶於沸硝酸和硫酸,以及大多數熔融的金屬如銅、鐵、錳、鋁和鈣。熔點2076℃。沸點3927℃。硼在常溫時為弱電導體,而在高溫時導電良好。單質硼有多種同素異形體,無定形硼為棕色粉末,晶體硼呈灰黑色。單質硼的硬度近似於金剛石,有很高的電阻,但它的導電率卻隨著溫度的升高而增大。晶態硼較惰性,無定形硼則比較活潑。硼共有14種同位素,其中只有兩個是穩定的。
室溫時為弱導電體;高溫時則為良導體。在自然界中主要以硼酸和硼酸鹽的形式存在。
晶體結構
晶態單質硼有多種變體,它們都以B12正二十面體為基本的結構單元。這個二十面體由12個B原子組成,20個接近等邊三角形的棱面相交成30條棱邊和12個角頂,每個角頂為一個B原子所占據。
由於B12二十面體的連線方式不同,鍵也不同,形成的硼晶體類型也不同。其中最普通的一種為α-菱形硼。
α-菱形硼是由B12單元組成的層狀結構,α-菱形硼晶體中既有普通的σ鍵,又有三中心兩電子鍵。許多B原子的成鍵電子在相當大的程度上是離域的,這樣的晶體屬於原子晶體,因此晶態單質硼的硬度大,熔點高,化學性質也不活潑。
在α-菱形硼晶格中,每個二十面體通過處在腰部的6個B原子以三中心兩電子鍵與在同一平面內的相鄰的6個二十面體連線起來(其中虛線三角形表示三中心兩電子鍵,鍵距203pm)。這種二十面體組成的片層,層面結合靠的是二十面體的上下各3個B原子以6個正常的B-B共價鍵(即兩中心兩電子鍵,鍵長171pm)同上下兩層的6個附近的二十面體相連線,3個在上一層,3個在下一層。
在硼的二十面體結構單元中,B12的36個電子是如下分配的:在二十面體內有13個分子軌道,用去26個電子;每個二十面體同上下相鄰的6個二十面體形成6個兩中心兩電子共價鍵,用去了6個電子;在二十面體腰部的6個B原子與同平面上周圍相鄰的6個三中心兩電子鍵,用去了6×2/3=4個電子,結果總電子數是26+6+4=36。所有的電子都已用於形成複雜的多面體結構。
成鍵特徵
 硼
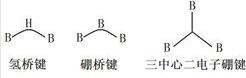
硼硼是周期表第三主族唯一的非金屬元素,B原子的價電子結構是2s²2p¹,它能提供成鍵的電子是2s²p,還有一個空軌道。這種B原子的價電子少於價軌道數的缺電子情況,但硼與同周期的金屬元素鋰、鈹相比原子半徑小,電離能高,電負性大,以形成共價鍵分子為特徵。
在硼原子以sp²雜化形成的共價分子中,餘下的一個空軌道可以作為路易斯酸,接受外來的孤對電子,形成以sp³雜化的四面體構型的配合物。例如三氟化硼與氨氣分子形成的配合物;若沒有合適的外來電子,可以自相聚合形成缺電子多中心鍵,例如三中心二電子氫橋鍵、三中心二電子硼橋鍵、三中心二電子硼鍵。
需要注意的是橋鍵與三中心二電子間的不同。硼橋鍵中心的硼原子是P軌道與兩個雜化軌道的重疊,氫橋鍵中心的氫原子是S軌道與兩個雜化軌道的重疊,而三中心二電子硼鍵為三個雜化軌道的組合重疊。
化學性質
化學元素周期表第Ⅲ族(類)主族元素,符號B,原子序數5。
1、與非金屬作用
高溫下B能與N₂、O₂、S、X₂等單質反應,例如它能在空氣中燃燒生成B₂O₃和少量BN,在室溫下即能與F₂發生反應,但它不與H₂、稀有氣體等作用。
2、B能從許多穩定的氧化物(如SiO₂,P₂O₅,H₂O等)中奪取氧而用作還原劑。例如在赤熱下,B與水蒸氣作用生成硼酸和氫氣:
2B+6H₂O=高溫=2H₃BO₃+3H₂
3、與酸作用
硼不與鹽酸作用,但與熱濃H₂SO₄,熱濃HNO₃作用生成硼酸:
2B+3H₂SO₄(濃)==2H₃BO₃+3SO₂↑
B+3HNO₃(濃)==H₃BO₃+ 3NO₂↑
4、與強鹼作用
在氧化劑存在下,硼和強鹼共熔得到偏硼酸鹽:
2B+2NaOH+3KNO₃==2NaBO₂+3KNO₂+H₂O
5、與金屬作用
高溫下硼幾乎能與所有的金屬反應生成金屬硼化物。它們是一些非整比化合物,組成中B原子數目越多,其結構越複雜。
製備方法
1、首先用濃鹼液分解硼鎂礦得偏硼酸鈉,將NaBO₂在強鹼溶液中結晶出來,使之溶於水成為較濃的溶液,通入CO₂調節鹼度,濃縮結晶即得到四硼酸鈉(硼砂)。將硼砂溶於水,用硫酸調節酸度,可析出溶解度小的硼酸晶體。加熱使硼酸脫水生成三氧化二硼,經乾燥處理後,用鎂或鋁還原B₂O₃得到粗硼。將粗硼分別用鹽酸、氫氧化鈉和氟化氫處理,可得純度為95~98%的棕色無定形硼。2、最純的單質硼用氫還原法製得:使氫和三溴化硼的混合氣體經過鉭絲,電熱到1500K,三溴化硼在高溫下被氫還原,生成的硼在鉭絲上成片狀或針狀結構。
3、由鎂粉或鋁粉加熱還原氧化硼而得。
主要用途
構成生命
硼元素是核糖核酸形成的必需品,而核糖核酸是生命的重要基礎構件。夏威夷大學宇航局天體生物學研究所的博士後研究員詹姆斯-史蒂芬森稱:“硼對於地球上生命的起源可能很重要,因為它可以使核酸穩定,核酸是核糖核酸的重要成分。在早期生命中,核糖核酸被認為是脫氧核糖核酸的信息前體。”工業用途
硼是一種用途廣泛的化工原料礦物,主要用於生產硼砂、硼酸和硼的各種化合物以及元素硼,是冶金、建材、機械、電器、化工、輕毛、核工業、醫藥、農業等部門的重要原料。時下,硼的用途超過300種,其中玻璃工業、陶瓷工業、洗滌劑和農用化肥是硼的主要用途,約占全球硼消費量的3/4。中國硼礦資源雖然豐富,但是硼礦產品不能滿足國內經濟建設需求,2007年國內硼砂產量約為40萬噸,進口硼礦產品64.87萬噸,大量依賴進口,因此充分了解世界硼礦產品市場情況就顯得相當重要。單質硼用作良好的還原劑,氧化劑,溴化劑,有機合成的摻合材料,高壓高頻電及等離子弧的絕緣體,雷達的傳遞窗等。
硼是微量合金元素,硼與塑膠或鋁合金結合,是有效的中子禁止材料;硼鋼在反應堆中用作控制棒;硼纖維用於製造複合材料等;含硼添加劑可以改善冶金工業中燒結礦的質量,降低熔點、減小膨脹,提高強度硬度。硼及其化合物也是冶金工業的助溶劑和冶煉硼鐵硼鋼的原料,加入硼化鈦、硼化鋰、硼化鎳,可以冶煉耐熱的特種合金;建材。硼酸鹽、硼化物是搪瓷、陶瓷、玻璃的重要組分,具有良好的耐熱耐磨性,可增強光澤,調高表面光潔度等。
硼酸,硼酸鋅可用於防火纖維的絕緣材料,是很好的阻燃劑,也套用於漂白、媒染等方面;偏硼酸鈉用於織物漂白。此外,硼及其化合物可用於油漆乾燥劑,焊接劑,造紙工業含汞污水處理劑等。
硼做為微量元素存在於石英礦中,在高純石英砂的提純工藝中,如何儘量的降低B含量成為工藝關鍵。B的存在使得石英的熔點降低,製得的石英坩堝使用次數降低,使得單晶矽生產成本升高。
生理功能
有關硼的吸收代謝科學界了解得並不充分,硼在膳食中很容易吸收,並大部分由尿排出,在血液中是與氧結合,為HBO或B(OH)一,硼酸與有機化合物的羥基形成酯化物。動物與人的血液中硼的含量很低,並與膳食中鎂的攝入有關,鎂攝入低時,血液中硼的含量就增加。硼可在骨中蓄積,但尚不清楚是何種形式。硼普遍存在於蔬果中,是維持骨的健康和鈣、磷、鎂正常代謝所需要的微量元素之一。對停經後婦女防止鈣質流失、預防骨質疏鬆症具有功效,硼的缺乏會加重維生素D的缺乏;另一方面,硼也有助於提高男性睪丸甾酮分泌量,強化肌肉,是運動員不可缺少的營養素。硼還有改善腦功能,提高反應能力的作用。雖然大多數人並不缺硼,但老年人有必要適當注意攝取。
硼的生理功能還未確定,存在兩種假說解釋硼缺乏時出現的明顯而不同的反應,以及已知硼的生化特性。一種假說是,硼是一種代謝調節因子,通過競爭性抑制一些關鍵酶的反應,來控制許多代謝途徑。另一種是,硼具有維持細胞膜功能穩定的作用,因而,它可以通過調整調節性陰離子或陽離子的跨膜信號或運動,來影響膜對激素和其他調節物質的反應。
植物生理
硼是高等植物特有的必需元素,而動物、真菌與細菌均不需要硼。硼能與游離狀態的糖結合,使糖容易跨越質膜,促進糖的運輸。植物各器官間硼的含量以花最高,花中又以柱頭和子房最高。硼對植物的生殖過程有重要的影響,與花粉形成、花粉管萌發和受精有密切關係。缺硼時,花葯和花絲萎縮,花粉發育不良。油菜和小麥出現的“花而不實”現象與植物硼酸缺乏有關。缺硼時根尖、莖尖的生長點停止生長,側根、側芽大量發生,其後側根、側芽的生長點又死亡,從而形成簇生狀。甜菜的褐腐病、馬鈴薯卷葉病和蘋果的縮果病等都是缺硼所致。失調危害
硼缺乏症
1、生長發育緩慢可能與硼的缺乏有關。
2、缺硼可能引起骨質疏鬆。
過量表現
硼、硼酸、硼砂都是低毒類蓄積性毒物,每天口服100mg,可引起慢性中毒,肝、腎臟受到損壞,腦和肺出現水腫。
食物來源
黃豆、葡萄(葡萄食品)乾、杏仁、花生、榛子、棗、葡萄酒、蜂密,酒類,例如蘋果(蘋果食品)酒和啤酒。
生命元素
化學元素周期表
| 族→ | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 電子層 | 0族電子數 | |
| 周期↓ | I A | 0 | |||||||||||||||||||
| 1 | 1 H 氫 | 2 He 氦 | K | 2 | |||||||||||||||||
| II A | III A | IV A | V A | VI A | VII A | ||||||||||||||||
| 2 | 3 Li 鋰 | 4 Be 鈹 | 5 B 硼 | 6 C 碳 | 7 N 氮 | 8 O 氧 | 9 F 氟 | 10 Ne 氖 | L K | 8 2 | |||||||||||
| 3 | 11 Na 鈉 | 12 Mg 鎂 | 13 Al 鋁 | 14 Si 矽 | 15 P 磷 | 16 S 硫 | 17 Cl 氯 | 18 Ar 氬 | M L K | 8 8 2 | |||||||||||
| III B | IV B | V B | VI B | VII B | VIII | I B | II B | ||||||||||||||
| 4 | 19 K 鉀 | 20 Ca 鈣 | 21 Sc 鈧 | 22 Ti 鈦 | 23 V 釩 | 24 Cr 鉻 | 25 Mn 錳 | 26 Fe 鐵 | 27 Co 鈷 | 28 Ni 鎳 | 29 Cu 銅 | 30 Zn 鋅 | 31 Ga 鎵 | 32 Ge 鍺 | 33 As 砷 | 34 Se 硒 | 35 Br 溴 | 36 Kr 氪 | N M L K | 8 18 8 2 | |
| 5 | 37 Rb 銣 | 38 Sr 鍶 | 39 Y 釔 | 40 Zr 鋯 | 41 Nb 鈮 | 42 Mo 鉬 | 43 Tc 鎝 | 44 Ru 釕 | 45 Rh 銠 | 46 Pd 鈀 | 47 Ag 銀 | 48 Cd 鎘 | 49 In 銦 | 50 Sn 錫 | 51 Sb 銻 | 52 Te 碲 | 53 I 碘 | 54 Xe 氙 | O N M L K | 8 18 18 8 2 | |
| 6 | 55 Cs 銫 | 56 Ba 鋇 | 57- 71 鑭系 | 72 Hf 鉿 | 73 Ta 鉭 | 74 W 鎢 | 75 Re 錸 | 76 Os 鋨 | 77 Ir 銥 | 78 Pt 鉑 | 79 Au 金 | 80 Hg 汞 | 81 Tl 鉈 | 82 Pb 鉛 | 83 Bi 鉍 | 84 Po 釙 | 85 At 砹 | 86 Rn 氡 | P O N M L K | 8 18 32 18 8 2 | |
| 7 | 87 Fr 鍅 | 88 Ra 鐳 | 89- 103 錒 | 104 Rf 鑪 | 105 Db | 106 Sg | 107 Bh | 108 Hs | 109 Mt | 110 Ds 鐽 | 111 Rg 錀 | 112 Uub | 113 Uut | 114 Uuq | 115 Uup | 116 Uuh | 117 Uus | 118 Uuo | |||
| 鑭系元 素 | 57 La 鑭 | 58 Ce 鈰 | 59 Pr 鐠 | 60 Nd 釹 | 61 Pm 鉕 | 62 Sm 釤 | 63 Eu 銪 | 64 Gd 釓 | 65 Tb 鋱 | 66 Dy 鏑 | 67 Ho 鈥 | 68 Er 鉺 | 69 Tm 銩 | 70 Yb 鐿 | 71 Lu 鑥 | ||||||
| 錒系元 素 | 89 Ac 錒 | 90 Th 釷 | 91 Pa 鏷 | 92 U 鈾 | 93 Np 鎿 | 94 Pu 鈽 | 95 Am 鎇 | 96 Cm 鋦 | 97 Bk 錇 | 98 Cf 鐦 | 99 Es 鑀 | 100 Fm 鐨 | 101 Md 鍆 | 102 No 鍩 | 103 Lr 鐒 | ||||||
化學元素(一)
飲用水地表水源地的特定監測項目
| 對於生活飲用水地表水源地水質的監測是對水源地保護的一項基礎工作。我國的地表水環境標準中規定,除了要監測地表水環境質量標準基本項目外,還要監測80項特定監測項目。 |
| 三氯甲烷| 四氯化碳| 三溴甲烷| 二氯乙烷| 1,2-二氯乙烷| 環氧氯丙烷| 1,1-二氯乙烯| 1,2-二氯乙烯| 四氯乙烯| 氯丁二烯| 六氯丁二烯| 二甲苯| 異丙苯| 乙醛| 丙烯醛| 三氯乙醛| 1,2-二氯苯| 1,4二氯苯| 三氯苯| 四氯苯| 六氯苯| 硝基苯、二硝基苯 | 2,4-二硝基甲苯| 三硝基甲苯| 硝基氯苯| 2,4二硝基氯苯| 2,4-二氯苯酚| 2,4,6-三氯苯酚| 五氯苯酚| 苯胺| 聯苯胺| 丙烯醯胺| 水合肼| 四乙基鉛| 吡啶| 苦味酸| 丁基黃原酸| 活性氯| 滴滴涕| 環氧七氯| 對硫磷| 馬拉硫磷| 內吸磷 | 百菌清| 甲萘威| 溴氰菊酯| 阿特拉津| 苯並[A]芘| 甲基汞| 微囊藻毒素| 黃磷| 鉬| 硼| 鈦 |

