概述
簡介
 鋰
鋰性質
銀白色的金屬。密度0.534克/厘米3。熔點180.54℃。沸點1317℃。是最輕的金屬。可與大量無機試劑和有機試劑發生反應。與水的反應非常劇烈。在500℃左右容易與氫發生反應,是唯一能生成穩定得足以熔融而不分解的氫化物的鹼金屬,電離能5.392電子伏特,與氧、氮、硫等均能化合,是唯一的與氮在室溫下反應,生成氮化鋰(Li3N)的鹼金屬。由於易受氧化而變暗,故應存放於液體石蠟中。存在
鋰在自然界中豐度較大,居第27位,在海水中大約2600億噸鋰,在地殼中約含0.0065%。鋰僅以化合物的形式廣泛存在於自然界中。鋰的礦物有30於種,主要存在於鋰輝石(LiAlSi2O6)和鋰雲母以及透鋰長石((LiNa)AlSi4O10)和磷鋁石中。在人和動物的有機體、土壤和礦泉水、可可粉、菸葉、海藻中都有鋰的存在。人和動物體內也有極少的鋰存在。體重70公斤的正常人體中,鋰的含量為2.2毫克。發現
 鋰
鋰發現年代:1817年
發現過程:從金屬與酸作用所得的氣體中發現氫。1817年,瑞典的阿爾費德森,最先在分析透鋰長石時發現了鋰。
鋰是繼鉀和鈉後發現的又一鹼金元素。發現它的是瑞典化學家貝齊里烏斯的學生阿爾費特森。1817年,他在分析透鋰長石時,最終發現一種新金屬,貝齊里烏斯將這一新金屬命名為lithium,元素符號定為Li。該詞來自希臘文lithos(石頭)。鋰發現的第二年,得到法國化學家伏克蘭重新分析肯定。到1855的年本生和馬奇森採用電解熔化氯化鋰的方法才製得它,工業化制鋰是在1893年由根莎提出的,鋰從被認定是一種元素到工業化製取前後歷時76年。鋰在地殼中的含量比鉀和鈉少的多,它的化合物不多見,是它比鉀和鈉發現的晚的必然因素。現在電解LiCl製取鋰,仍要消耗大量的電能,每煉一噸鋰就耗電高達六、七萬度。
綜合性質
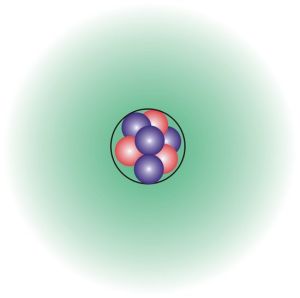 鋰原子結構
鋰原子結構元素英文名稱:Lithium
來由:希臘文:lithos(石)
元素類型:鹼金屬
相對原子質量:6.941
氧化態:MainLi+1
OtherLi-1(inliquidNH3)
電離能(kJ/mol)
M-M+513.3
M+-M2+7298.0
M2+-M3+11814.8
原子序數:3
元素符號:Li
相對原子質量:6.941
核內質子數:3
核外電子數:3
核電核數:3
質子質量:5.019E-27
質子相對質量:3.021
所屬周期:2
所屬族數:IA
 鋰原子
鋰原子晶胞參數:
a=351pm
b=351pm
c=351pm
α=90°
β=90°
γ=90°
熱導率:W/(m·K)
84.8
聲音在其中的傳播速率:(m/S)
6000
莫氏硬度:0.6
摩爾質量:7g/mol
性質與狀態
鋰是一種柔軟的,銀灰色,極易反應的鹼金屬元素。它在金屬中比重最輕。鋰在空氣中易被氧化,所以須貯存於固體石蠟或惰性氣體中。它能與水和酸作用放出氫氣,易與氧、氮、硫等化合。鋰鹽在水中的溶解度與鎂鹽類似,而不同於其他的鹼金屬鹽。鋰不但是既輕又軟、比熱最大的金屬,而且還是在通常溫度下呈固體狀態的一般材料中最輕的一種,通常貯藏於煤油或液體石蠟中。純鋰的比重跟乾燥的木材差不多,等於一般稱作輕金屬的鋁的密度的五分之一,幾乎只有同體積水的重量的一半。即使把鋰放到汽油中,它也會象軟木塞一樣輕輕地浮起來。在室溫條件下,鋰能和空氣中的氮氣和氧氣發生強烈的化學反應。由於鋰具有和氫、氧、氮、碳及氧化物、矽酸鹽等物質結合的能力,冶金工業部門把鋰作為“捕氣劑”、“脫流劑”,可以消除金屬鑄件中的孔隙氣泡、雜質和其他缺陷。物理性質
鋰的密度非常小,僅有0.534g/cm3,為非氣態單質中最小的一個。因為鋰原子半徑小,故其比起其他的鹼金屬,壓縮性最小,硬度最大,熔點最高。溫度高於-117℃時,金屬鋰是典型的體心立方結構,但當溫度降至-201℃時,開始轉變為面心立方結構,溫度越低,轉變程度越大,但是轉變不完全。在20℃時,鋰的晶格常數為3.50Å[3],電導約為銀的五分之一。鋰可以很容易的與除鐵以外的任意一種金屬熔合[4]。化學性質
 鋰電池
鋰電池塊狀鋰可以與水發生反應,粉末狀鋰與水發生爆炸性反應。鹽酸、稀硫酸、硝酸能與鋰劇烈反應,濃硫酸僅與鋰緩慢反應。
鋰能同很多有機化合物發生反應,很多反應在有機合成上有重要的意義。
同位素與核性質
在自然界中,鋰是以兩種同位素組成,6Li和7Li,豐度分別為7.42%和92.58%。通過人工製備,已得到鋰的四种放射性同位素5Li、8Li、9Li、11Li。他們的衰變方式如下:
鋰的同位素可以發生下列反應,放出熱量。也可以用來製作氚。
套用領域
將質量數為6的同位素(6Li)放於原子反應堆中,用中子照射,可以得到氚。氚能用來進行熱核反應,有著重要的用途。鋰主要以硬脂酸鋰的形式用作潤滑脂的增稠劑。這種潤滑劑兼有高抗水性、耐高溫和良好的低溫性能。鋰化物用於陶瓷製品中,以起到助溶劑的作用。在冶金工業中也用來作脫氧劑或脫氯劑,以及鉛基軸承合金。鋰也是鈹、鎂、鋁輕質合金的重要成分。 鋰玻璃閃爍體
鋰玻璃閃爍體把含鋰的陶瓷塗到鋼鐵或鋁、鎂等金屬的表面,形成一層薄而輕、光亮而耐熱的塗層,可作噴氣發動機燃燒室和火箭、飛彈外殼的保護層。鋰與鋁、鎂、鈹等“合作”組成合:金,既輕又韌,已被大量用於飛彈、火箭、飛機等製造上。
潤滑劑中加進鋰的化合物,可以大大改善潤滑效能。此種潤滑劑適用於溫度在—50℃至200℃的範圍,因此被廣泛套用於航空、動力等部門的各種機械裝置和儀器儀表。
某些鋰的有機化合物,如硬脂酸鋰、軟脂酸鋰等,它們的物理姓能不隨環境溫度變化而改變,因此是二種安全可靠的潤滑劑,並具有“永久性”作用。如果在汽車的一些零件上加一次鋰潤滑劑,就足以用到汽車報廢為止。
氫化鋰遇水發生猛烈的化學反應,產生大量的氫氣。兩公斤氫化鋰分解後,可以放出氫氣566千升。氫化鋰的確是名不虛傳的“製造氫氣的工廠”。第二次世界大戰期間,美國飛行員備有輕便的氫氣源——氫化鋰丸作應急之用。飛機失事墜落在水面時,只要一碰到水,氫化鋰就立即與水發生反應,釋放出大量的氫氣,使救生設備(救生艇、救生衣、訊號氣球等)充氣膨脹。
鹼性蓄電池組的電解溶液里有氫氧化鈉溶液,現在加入幾克氫氧化鋰溶液,蓄電池的使用壽命可以增加兩倍,工作溫度範圍可加大到-20℃----40℃。
鋰—氯、鋰—硒之類的電池,已在手機、筆記本電腦以及某些國防軍事部門中得到套用。用鋰電池發電來開動汽車,行車費用只有普通汽油發動機汽車的三分之一。鋰高能電池是一種很有前途的動力電池。它重量輕,貯電能力大,充電速度快,適用範圍廣,生產成本低,工作時不會產生有害氣體,不至於造成大氣污染。由鋰製取氚,用來發動原子電池組,中間不需充電,可連續工作20年。
氫彈里裝的不是普通的氫,而是比普通氫幾乎要重一倍的重氫或重二倍的超重氫。用鋰能夠生產出超重氫——氚,還能製造氫化鋰、氘化鋰、氚化鋰。早期的氫彈都用氘和氚的混和物作“炸藥”,當今的氫彈里的“爆炸物”多數是鋰和氘的化合物——氘化鋰。我國1967年6月l7日成功地爆炸的第一顆氫彈,其中的“炸藥”就是氫化鋰和氘化鋰。1公斤氘化鋰的爆炸力相當於5萬噸烈性梯恩梯炸藥。據估計,l公斤鈾的能量若都釋放出來可以使一列火車運行4萬公里;l公斤氘和氚的混和物卻可以使一列火車從地球開到月球;而I公斤鋰通過熱核反應放出的能量,相當於燃燒20000多噸優質煤,比1公斤鈾通過裂變產生的原子能人10倍。
合成原料
在許多反應中,鋰可以作為原料或中間物。在合成與鋰相關的無機化合物時,常常是將金屬鋰於其他單質反應。若要求純度較高,可以用鋰與氣態單質或化合物反應。例如用鋰和硫化氫合成硫化鋰。反應方程式如下:2Li+H2S=Li2S+H2
還原劑
主條目:Birch還原金屬鋰溶於液氨和乙醇的混合溶劑中形成一個良好的還原劑,可以用來還原含芳環的有機化合物。比較貴重的甾族化合物通常用這種辦法來還原。這個方法的優點是產率較高,缺點是比用鈉還原昂貴,所以僅限於還原一些貴重的化合物。
催化劑
鋰可用作丁二烯、異戊二烯等二烯烴聚合催化劑,也可以用來製造共聚物。電池工業
 鋰電池
鋰電池低於室溫的電池,通常使用有機溶劑作為電解質,其中添加一些無機鹽增加導電性,常用無機鹽包括高氯酸鋰、六氟磷酸鋰、六氟砷酸鋰和硫化鋰等。二次鋰電池中正極材料也為含鋰化合物,如鋰鈷氧化物、鋰鎳氧化物、鋰錳氧化物、鋰鐵氧化物等等,以及其幾元化合物。二次鋰電池中負極材料,也與鋰的作用明顯。
電池陽極是鋰,陰極常用金屬氯化物。例如鋰-氯化銀電池的電池反應為:
Li+AgCl=LiCl+Ag
高溫下的電池,通常使用熔融的無機鹽作為電解質,因此必須在該鹽的熔點以上方可使用。例如:
2Li+Cl2=2LiCl
合金
摻有鋰的合金一般有強度大,密度小,耐高溫等特性。也有人用鋰合成了Li-Pb液態半導體合金。其他用途
用鋰作為燃料發射的魚雷鋰還能用於:
原子能工業中製造核反應堆的載熱劑
製造特種合金、特種玻璃等
作冶金工業中的脫氧劑,脫硫劑和脫泡劑
作為燃料,可發射魚雷等武器
資源
鋰號稱“稀有金屬”,其實它在地殼中的含量不算“稀有”,地殼中約有0.0065%的鋰,鋰的地殼豐度為18x10-4%,居第二十七位,海水含鋰2x10-5%。已知含鋰的礦物有150多種,以鋰為主的礦物30種,具有工業價值的有六種,其中主要有鋰輝石(LiAlSi2O6)、鋰雲母[Li2(F,OH)2Al(SiO3)3]、透鋰長石等。海水中鋰的含量不算少,總儲量達2600億噸,可惜濃度太小,提煉實在困難。
某些礦泉水和植物機體裡,含有豐富的鋰。如有些紅色、黃色的海藻和菸草中,往往含有較多的鋰化合物,可供開發利用。世界鋰儲量約3670萬噸,美國是鋰資源最豐富的國家。中國鋰資源豐富,產地主要分布在新疆、江西、湖南、四川等省,世界屋脊青藏高原,鹽湖星羅棋布,其中鋰、銣、銫含量之高,甚為罕見。我國的鋰礦資源豐富,以目前我國的鋰鹽產量計算,僅江西雲母鋰礦就可供開採上百年。製備
鋰礦的提取法
硫酸鹽法 鋰
鋰2LiAl(SO3)2+K2SO4=Li2SO4+2KAl(SO3)2
硫酸鹽分解法在很長一段時間是工業製備鋰的唯一方法。此方法不僅適用於鋰灰石,也可以用來處理鋰雲母。
石灰法
將石灰或石灰石與鋰礦石一起燒結,然後用水處理,浸去液經過多次蒸發,既可以從中結晶析出氫氧化鋰。反應式如下,反應溫度為1000℃:
2LiAl(SiO3)2+9CaO=Li2O+CaO·Al2O3+4[2CaO·SiO2]
這個方法的優點是:
適用性強,能夠分解幾乎所有的鋰礦石。
反應不需要稀缺原料,石灰和石灰石均較便宜且容易獲得。
這個方法的缺點是:
要求精礦中含鋰量很高,因為在燒結時會使精礦貧化。
因為浸取後得到的是稀溶液,因此蒸發會消耗大量的熱量並且花費很多時間。
硫酸法
首先提出此方法的是R.B.Ellestad和K.M.Leute[4],此方法適用於β-鋰輝石和理雲母。原理如下,反應溫度為250-300℃:
2LiAl(SO3)2+H2SO4=Li2SO4+H2O·Al2O3·4SiO2
此反應的關鍵問題是只能與β-鋰輝石反應,對於α-鋰輝石,硫酸無法與之反應。用硫酸直接分解未經鍛燒的鋰輝石,提取出來的鋰僅占總量的4%[4]。
天然滷水的提取
鋰的來源也包括天然滷水和某些鹽湖水。加工過程是將鋰沉澱成Li2NaPO4,再將其轉變為碳酸鋰,即可以作為來源來加工其他鋰化合物了。加工天然滷水還可以得到硼砂、碳酸鉀、氯化鈉、硫酸鈉和氯化鎂等。金屬鋰的製備
電解法 鋰
鋰Li++e−→Li
2Cl−+2e−→Cl2
2LiCl(l)→2Li(s)+Cl2(g)
電解法製得的金屬鋰通常含有機械雜質(例如Na、K、Mg、Ca、Fe、Si和Al等),因此需要提純;雜質可以重新熔融在藉助比重不同除去,不容易除去的鈉和鉀可以通過氫化法除去。
熱還原法
3Li2O+2Al=6Li+Al2O3—33.6千卡
2Li2O+Si=4Li+SiO2—76.3千卡
因為還原氧化鋰是吸熱反應,再加上金屬鋰的性質十分活潑,所以反應只能在高溫和高真空中進行。
人體健康
 鋰
鋰鋰的生物必需性及人體健康效應。鋰是有效的情緒穩定劑。隨著新的情緒穩定劑的出現,對鋰治療的興趣和研究雖已減少,但鋰仍是治療急性躁狂症和躁狂-抑鬱病預防性管理的最有效措施。許多研究證明,鋰對動物和人具有必需功能或有益作用。動物缺鋰可導致壽命縮短、生殖異常、行為改變及其他異常。人類流行病學研究顯示,飲水鋰濃度與精神病住院率、殺人、自殺、搶劫、暴力犯罪和毒品犯罪率呈顯著負相關。毒品犯的營養性鋰補充研究證明鋰有改善和穩定情緒的作用。心臟病人、學習低能者和在押暴力犯發鋰含量顯著降低。碳酸鋰治療的臨床研究表明,鋰的主要反應器官為胃腸道、腎臟、神經、肌肉、內分泌和心血管系統。在170~228mgLi/d治療劑量範圍內,預期的血清鋰水平為0.4~0.8mEq/L(2.78~5.55mg/L),無毒性反應。在鋰的危險性評估中,對治療劑量採用10倍安全因子對孕婦和胎兒不造成危害,這相當於成人每天攝入2
mgLi。動物的NOAEL(無毒性作用水平)為10mgLi/kg/d,採用32倍安全因子,得到日允許攝入量(ADI)為0.31
mgLi/kg/d。基於動物實驗數據,鋰的表觀缺乏攝入量為:山羊:<1.5mgLi/kg,大鼠:<15μgLi/kg。人對鋰的飲食需要量約為60~100μg/d,典型的日攝入量為200~600μg。蛋類、牛奶、奶製品、魚類、土豆和蔬菜含有豐富的鋰。
用途
鋰的性質及用途
 鋰礦
鋰礦鋰在發現後一段相當長的時間裡,一直受到冷落,僅僅在玻璃、陶瓷和潤滑劑等部門,使用了為數不多的鋰的化合物。
鋰早先的主要工業用途是以硬脂酸理的形式用作潤滑劑的增稠劑,鋰基潤滑脂兼有高抗水性,耐高溫和良好的低溫性能。如果在汽車的一些零件上加一次錘潤滑劑,就足以用到汽車報廢為止。在冶金工業上,利用鋰能強烈地和O、N、Cl、S等物質反應的性質,充當脫氧劑和脫硫劑。在銅的冶煉過程中,加入十萬分之一到萬分之一的鋰,能改善銅的內部結構,使之變得更加緻密,從而提高銅的導電性。鋰在鑄造優質銅鑄件中能除去有害的雜質和氣體。在現代需要的優質特殊合金鋼材中,鋰是清除雜質最理想的材料。1kg鋰燃燒後可釋放42998kJ的熱量,因此理是用來作為火箭燃料的最佳金屬之一。1kg鋰通過熱核反應放出的能量相當於二萬多噸優質煤的燃燒。若用鋰或鋰的化合物製成固體燃料來代替固體推進劑,用作火箭、飛彈、宇宙飛船的推動力,不僅能量高、燃速大,而且有極高的比衝量,火箭的有效載荷直接取決於比衝量的大小。
如果在玻璃製造中加入鋰,鋰玻璃的溶解性只是普通玻璃的1/100(每一普通玻璃杯熱茶中大約有萬分之一克玻璃),加入鋰後使玻璃成為“永不溶解”,並可以抗酸腐蝕。
純鋁太軟,當在鋁中加入少量的Li、Mg、Be等金屬熔成合金,既輕便,又特別堅硬,用這種合金來製造飛機,能使飛機減輕2/3的重量,一架鋰飛機兩個人就可以抬走。Li-Pb合金是一種良好的減摩材料。真正使鋰成為舉世矚目的金屬,還是在它的優異的核性能被發現之後。由於它在原子能工業上的獨特性能,人們稱它為“高能金屬”。
6Li捕捉低速中子能力很強,可以用來控制鈾反應堆中核反應發生的速度,同時還可以在防輻射和延長核飛彈的使用壽命方面及將來在核動力飛機和宇宙飛船中得到套用。6Li在原子核反應堆中用中子照射後可以得到氚,而氚可用來實現熱核反應。
6Li在核裝置中可用作冷卻劑。
鋰電池是本世紀三、四十年代才研製開發的優質能源,它以開路電壓高,比能量高,工作溫度範圍寬,放電平衡,自放電子等優點,已被廣泛套用於各種領域,是很有前途的動力電池。用鋰電池發電來開動汽車,行車費只有普通汽油發動機車的1/3。由鋰製取氚,用來發動原子電池組,中間不需要充電,可連續工作20年。目前,要解決汽車的用油危機和排氣污染,重要途徑之一就是發展向鋰電池這樣的新型電池。
鋰的化合物用途
 金屬鋰
金屬鋰LiF對紫外線有極高的透明度,用它製造的玻璃可以洞察隱蔽在銀河系最深處的奧秘。鋰玻璃可用來製造電視機顯象管。
二戰期間,美國飛行員備有輕便應急的氫氣源—氫化鋰丸。當飛機失事墜落在水面時,只要一碰到水,氫化鋰就立即溶解釋放出大量的氫氣,使救生設備充氣膨脹。
當狼吃下含有鋰化合物的肉食後,能引起消化不良,食慾大減,從而改變狼食肉的習性,這種習性還具有遺傳性。
鋰鹽可治療癲狂病,己在臨床上得到套用。動脈硬化性心臟病的發病率,與該地區飲食中鋰的含量成反比。北京積水潭醫院利用鋰製劑治療急性痢疾,療效近90%。北京同仁醫院採用鋰製劑,醫治再生障礙性貧血也有一定的療效。
用氘化鋰和氮化鋰來代替氘和氚裝在氫彈里充當炸藥,達到氫彈爆炸的目的。我國於1967年6月17日成功爆炸的第一顆氫彈里就是利用氘化鋰。
LiBH4和LiAlH4,在有機化學反應中被廣泛用做還原劑,LiBH4能還原醛類、酮類和酯類等。LiAlH4,是製備藥物、香料和精細有機化學藥品等中重要的還原劑。LiAlH4,也可用作噴氣燃料。LiAlH4是對複雜分子的特殊鍵合的強還原劑,這種試劑已成為許多有機合成的重要試劑。
有機鋰化合物與有機酸反應,得到能水解成酮的加成產物,這種反應被用於維生素A合成的一步。有機鋰化物加成到醛和酮上,得到水解時能產生醇的加成產物。
由鋰和氨反應製得的氨基鋰被用來引入氨基,也被用作脫鹵試劑和催化劑。
人類對金屬鋰的套用目前已有了良好的開端,但由於鋰的生產工藝比較複雜,成本很高。如果人們一旦解決了這些問題,鋰的優良性能將得到進一步的發揮,從而擴大它的套用範圍。
儲存方法
與鉀、鈉類似,金屬鋰很活潑,需隔絕空氣儲存。
貯存和使用都要注意安全,由金屬鋰引起的火災,不能用水或泡沫滅火劑撲滅,而要用碳酸鈉乾粉。鋰也對皮膚有很強的腐蝕性。
化學元素周期表
| 族→ | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 電子層 | 0族電子數 | |
| 周期↓ | I A | 0 | |||||||||||||||||||
| 1 | 1 H 氫 | 2 He 氦 | K | 2 | |||||||||||||||||
| II A | III A | IV A | V A | VI A | VII A | ||||||||||||||||
| 2 | 3 Li 鋰 | 4 Be 鈹 | 5 B 硼 | 6 C 碳 | 7 N 氮 | 8 O 氧 | 9 F 氟 | 10 Ne 氖 | L K | 8 2 | |||||||||||
| 3 | 11 Na 鈉 | 12 Mg 鎂 | 13 Al 鋁 | 14 Si 矽 | 15 P 磷 | 16 S 硫 | 17 Cl 氯 | 18 Ar 氬 | M L K | 8 8 2 | |||||||||||
| III B | IV B | V B | VI B | VII B | VIII | I B | II B | ||||||||||||||
| 4 | 19 K 鉀 | 20 Ca 鈣 | 21 Sc 鈧 | 22 Ti 鈦 | 23 V 釩 | 24 Cr 鉻 | 25 Mn 錳 | 26 Fe 鐵 | 27 Co 鈷 | 28 Ni 鎳 | 29 Cu 銅 | 30 Zn 鋅 | 31 Ga 鎵 | 32 Ge 鍺 | 33 As 砷 | 34 Se 硒 | 35 Br 溴 | 36 Kr 氪 | N M L K | 8 18 8 2 | |
| 5 | 37 Rb 銣 | 38 Sr 鍶 | 39 Y 釔 | 40 Zr 鋯 | 41 Nb 鈮 | 42 Mo 鉬 | 43 Tc 鎝 | 44 Ru 釕 | 45 Rh 銠 | 46 Pd 鈀 | 47 Ag 銀 | 48 Cd 鎘 | 49 In 銦 | 50 Sn 錫 | 51 Sb 銻 | 52 Te 碲 | 53 I 碘 | 54 Xe 氙 | O N M L K | 8 18 18 8 2 | |
| 6 | 55 Cs 銫 | 56 Ba 鋇 | 57- 71 鑭系 | 72 Hf 鉿 | 73 Ta 鉭 | 74 W 鎢 | 75 Re 錸 | 76 Os 鋨 | 77 Ir 銥 | 78 Pt 鉑 | 79 Au 金 | 80 Hg 汞 | 81 Tl 鉈 | 82 Pb 鉛 | 83 Bi 鉍 | 84 Po 釙 | 85 At 砹 | 86 Rn 氡 | P O N M L K | 8 18 32 18 8 2 | |
| 7 | 87 Fr 鍅 | 88 Ra 鐳 | 89- 103 錒 | 104 Rf 鑪 | 105 Db | 106 Sg | 107 Bh | 108 Hs | 109 Mt | 110 Ds 鐽 | 111 Rg 錀 | 112 Uub | 113 Uut | 114 Uuq | 115 Uup | 116 Uuh | 117 Uus | 118 Uuo | |||
| 鑭系元 素 | 57 La 鑭 | 58 Ce 鈰 | 59 Pr 鐠 | 60 Nd 釹 | 61 Pm 鉕 | 62 Sm 釤 | 63 Eu 銪 | 64 Gd 釓 | 65 Tb 鋱 | 66 Dy 鏑 | 67 Ho 鈥 | 68 Er 鉺 | 69 Tm 銩 | 70 Yb 鐿 | 71 Lu 鑥 | ||||||
| 錒系元 素 | 89 Ac 錒 | 90 Th 釷 | 91 Pa 鏷 | 92 U 鈾 | 93 Np 鎿 | 94 Pu 鈽 | 95 Am 鎇 | 96 Cm 鋦 | 97 Bk 錇 | 98 Cf 鐦 | 99 Es 鑀 | 100 Fm 鐨 | 101 Md 鍆 | 102 No 鍩 | 103 Lr 鐒 | ||||||
化學元素(一)
拼音是li的漢字
| 拼音是li的漢字共有244個,如下: |
| 厘|離|莉|隸|里|力|立|李|例|哩|理|利|梨|禮|歷|麗|吏|礫|漓|傈|荔|俐|痢|狸|粒|瀝|栗|璃|鯉|厲|勵|犁|黎|籬|酈|鸝|笠|壢|藶|鱧|縭|躒|蜊|鋰|澧|糲|蘺|櫪|蠡|嚦|礪|嫠|篥|癘|癧|猁|藜|溧|鱺|戾|櫟|唳|醴|轢|詈|罹|邐|儷|喱|靂|蒞|俚|蠣|娌|儮|儷|凓|刕|剓|剺|劙|勵|厤|厯|叓|叕|唎|嚟|嚦|囄|囇|塛|壢|娳|婯|孋|孷|屴|岦|峛|峲|巁|廲|悡|悧|悷|慄|捩|搮|擽|攊|攦|攭|斄|暦|曆|曞|朸|栃|栛|栵|梸|棃|棙|檪|櫔|櫟|櫪|欐|欚|歴|歷|氂|沴|沵|浬|涖|濼|濿|瀝|灑|灕|爄|爏|犂|犛|犡|珕|珞|琍|瑮|瓅|瓈|瓑|瓥|癘|癧|盠|盭|睝|矖|砅|磿|礪|礫|礰|禮|禲|秝|穲|竰|筣|籬|粴|糎|糲|綟|縭|纅|纚|艃|茘|荲|菞|蒚|蒞|蔾|藶|蘺|蚸|蛠|蜧|蝕|蝷|蟍|蟸|蠇|蠣|蠫|裏|裡|褵|觻|謧|讈|貍|赲|躒|轢|轣|邐|酈|醨|釃|鉝|鋫|鋰|錅|鏫|鑗|鑠|鑠|隷|隸|靂|靋|颯|颯|鬁|鯉|鯏|鯬|鱧|鱱|鱳|鱺|鳨|鴗|鵹|鷅|鸝|麗|麜 |

