概述
氙(舊譯作氠、氥)是一種化學元素,它的元素符號是Xe,它的原子序數是54,是一種無色無味的稀有氣體, 氙
氙性質
物理性質
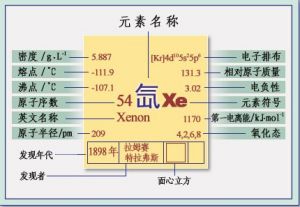
氙在常溫常壓下為無色無臭無毒的惰性氣體,在放電管中為藍色至綠色的氣體。原子半徑:4.05Å
共價半徑:209pm;1.31Å
沸點:-108.10℃(101.325kpa)
三相點:16.130K
氣體密度:5.89kg·m-3(273.15K,101.325kpa)
液體密度:3057kg·m-3(-108.10℃,101.325kpa)
氣液體積比:518.9
介電常數:1.001238(298K,101.325kpa)
磁化率:-43×10-1cgs·mol-1(298K,101.325kpa)
折射率:1.000702(g,273K,101.325KPa,5893A)
比容:0.180m3·kg-1(294.3K,101.325kPa)
臨界溫度:289.74K
臨界壓力:5764kPa
臨界密度:1100.0kg·m-3
熔化熱:17.49kJ·kg-1(161.4K,81.6kPa)
氣化熱:96.30KJ·kg-1(165.1K,101.325kpa)
 氙的性質
氙的性質比熱容:Cp=160.03J/(kg·K)(g,298K,101.325kpa);Cv=96.41J/(kg·K)(g,298K,101.325kpa)
比熱比:Cp/Cv=1.67(g,298K,101.325kpa)
蒸氣壓:2634kPa(253K);4175kPa(273K);5147kPa(283K)
粘度:0.02110mPa·S(g,273K,101.325kPa);0.528mPa·S(l,289.74k)
表面張力:18.7mN·m-1(163K)
導熱係數:0.005192W·m-1·K-1(273K,101.325kPa);165.014kh0.07322W·m-1·K-1
1962年以前,科學家只能在放電管裡面觀察到短壽命的化合物和不穩定的水合物、包合物。包合物是稀有氣體原子被有機或無機化合物包含在晶體間隙之中,比如醌醇能把氙包含在晶體中。
一直到1962年,英國氟化學家巴特利特(N.Bartlett)在研究六氟化鉑(PtF6)時發現,它的強氧化性能把氧氣分子氧化為二氧基陽離子(O2+ ),形成O2+ [PtF6]。考慮到氧分子的第一電離能與氙的第一電離能接近(氧為1175.7kJ/mol,氙為1171.5kJ/mol),氙有可能像氧氣一樣發生類似的化合反應。於是,他把PtF6蒸汽與過量的氙在室溫下混合,立即產生了紅色的晶體:經X射線分析,證明這是氙的化合物,XePtF6(在一些資料寫作Xe+ PtF6− ,比如現在人民教育出版社出版的高中化學教材)。然而有點諷刺的是,後來有人直接把氟氣和氙氣直接混合,在紫外線下就產生了最簡單的氟化物:XeF2。
化學性質
電子排布:[Kr]5s25p6電負性:2.60(泡林標度)
化學鍵能:Xe-O:84kJ·mol-1
氧化態:Xe(0),Xe(II),Xe(IV),Xe(VI),Xe(VIII)
晶體結構:面心立方晶胞;a=620.23pm
電離能(kJ/mol):I1:1170.4;I2:2046;I3:3097;I4:4300;I5:5500;I6:6600;I7:9300;I8:10600;I9:19800;I10:23000
氙的電子構型非常穩定,且它的電離能相對較大,因此在化學上顯惰性,只與強的氧化劑反應。
化合物
氟化反應與氟化氙
氙氣與氟氣直接混合,可以得到無色的XeF2,XeF4與XeF6晶體[6],氙與氟的比例不同,得到的主產物不同[6]:Xe:F2=2:1,1273K,1.03×105Pa[7]或298K,紫外線光照[6]:;
Xe:F2=1:5,873K,6.18×105Pa:;
Xe:F2=1:20,573K,6.18×105Pa:;
若使用鎳、鈷和鈣的氟化物作為催化劑能顯著提高上述反應速率,使用Ag2O或Ni2O3則可以在零度時引起氟和氙的爆炸反應。一些氟化物則對反應催化具有選擇性,例如在Xe:F2=1:10,溫度為120℃時,使用氟化鎂作為催化劑,產物只有XeF2,若使用二氟化鎳作為催化劑,產物則只有XeF6。
氙的三種氟化物在室溫下都能穩定存在。
若將XeF2溶於水中,則與水緩慢反應,又得到氙氣:
XeF4與水反應時,一半發生反應,另一半則歧化為Xe(0)與Xe(VI):,反應過程中有疑似XeOF2的黃色中間產物。
XeF6與水發生的是水解反應:,生成的XeOF4則進一步與水反應,直到完全水解:。生成的XeO3可以溶解於水並穩定存在,不會進一步氧化水。鹼性時,XeF6會歧化為不溶解的高氙酸鹽與氙氣。
氙的氟化物都是強的氧化劑與氟化劑,在工業生產上有實際用途,例如一些有機物的氟化,使用的就是XeF2。
含氧化合物
氙的氧化物有XeO3與XeO4,對應的酸根為氙酸根(HXeO4-)與高氙酸根(XeO64-)。 元素周期表 氙
元素周期表 氙XeO3可用XeF4或XeF6與水反應製得[6],XeO3在酸性與中性溶液中穩定,在鹼性溶液中以HXeO4-形式存在,並且不穩定,易分解或歧化。
XeO4可由高氙酸鋇與硫酸複分解製得[6]:,XeO4是一種穩定性差,易爆炸的黃色固體,氧化性極強 。
除上邊所述的XeF6歧化製法,高氙酸鹽亦可通過XeO3的鹼溶液與臭氧反應製得。
複合氟化物
在氙的化合物的發現史上,複合氟化物占有重要的地位。氙的第一個真正意義上的化合物正是複合氟化物氟鉑酸氙(Xe+PtF6-),它是用Xe與強氧化劑PtF6混合產生的:。隨著Xe與PtF6的用量的不同,氟鉑酸氙的組成可以在Xe+:PtF6-=0.5:1之間變化。氟鉑酸氙是一種發粘的橙黃色固體,在室溫下穩定,遇水分解出氙,氧氣,氟化氫和二氧化鉑(IV)。其他一些金屬的六氟化物也可以與氙反應生成形如XeMF6的化合物。將氙、氟和固態PF5混合併輝光放電,可以生成不穩定的XePF6,同時氙、氟和玻璃儀器反應產生Xe2SiF6。將二氟化氙和一些金屬的五氟化物反應也可以生成XeMF6型的化合物。
其它化合物
含有Xe-N鍵與Xe-C的化合物均被發現,典型代表是FXeN(SO2F)2與[Xe(C6F5)]·[C6F5BF3] 。氙還有氫醌包合物形式的化合物,其中氙被捕集至氫醌的晶格之中。
研究歷史
氙於1898年7月由拉姆齊(WilliamRamsay)和特拉維斯(MorrisW.Travers)在倫敦大學學院發現。在此之前,他們從液態空氣中提取了氖,氬和氪,並且疑惑它是否包含其它氣體。工業家LudwigMond給了他們一台新的液態空氣機,他們用它提取了更多的稀有氣體氪。經過多次蒸餾,他們終於分離出了一種更重的氣體,在真空管中它發出漂亮的藍色光芒。他們意識到它是氣體元素“惰性”組的又一個成員,因為其在化學上是惰性的。他選擇“ξένος(xenos)”這個希臘文命名氙,意為“陌生的”[6]。
在“惰性氣體”中,氙的化合物(含有化學鍵的)是最先被發現的。巴特列(NeilBartlett)於1962年將PtF6蒸汽與Xe混合,得到了橙黃色的XePtF6晶體,打破了化學界中持續60年之久的“稀有氣體對化學反應完全惰性”的神話。[1][6]21世紀,超過100種氙的化合物已經被製造出來。
同位素
氙的同位素中,110Xe至147Xe均被實驗室製得,其中能穩定存在的是124Xe,126Xe,128Xe~132Xe,134Xe與136Xe,自然界中豐度最大的是132Xe。製備方法
氙在空氣中的儲量達到19.5億噸,因此通過分餾液態空氣是製取氙的良好途徑。氙是空分工業的副產物。首先液化空氣,分餾出液氧,稀有氣體即富集於其中,通過進一步分餾,提純可分離出稀有氣體的混合液。173K時使用活性炭吸附,Ar,Kr與Xe被吸附,通過改變溫度及其他條件,可以獲得氙。套用領域
 氙霓虹燈
氙霓虹燈廣泛用於電子、光電源工業,還用於氣體雷射器和等離子流中。
用氙氣充的燈泡與相同功率的充氬燈泡相比具有發光率高、體積小、壽命長、省電等優點。
有極高的發光強度,充填的長弧氙燈俗稱“小太陽”,光的色彩好,用於拍攝彩色電影;又由於透霧能力特彆強,可用作有霧導航燈,廣泛用於機場、車站、碼頭。
氙燈凹面聚光後可生成2500℃高溫,可用於焊接或切割難熔金屬,如鈦、鉬等。
還是一種沒有副作用的深度麻醉劑,X光攝影的造影劑。
也被用作禁止X射線。此外,在原子核反應堆和高能物理方面也有很多用途。
元素分布
空氣中含量:約90ppm;地殼中含量:2×10-6ppm;
元素在海水中的含量:1×10-4ppm ;
大氣中的Xe主要來自原始生成,岩石圈、小行星、隕石通過風化作用釋放出其中的稀有氣體。宇宙射線和其他高能粒子的核反應也能產生少量Xe。
氣體危害
健康危害
侵入途徑:吸入。
健康危害:對人的危害與氬相似。人吸入混有70%氙氣的氧,引起輕度麻醉,約經3分鐘即意識喪失。
毒理學資料及環境行為
危險特性:若遇高熱,容器內壓增大,有開裂和爆炸的危險。
化學元素周期表
| 族→ | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 電子層 | 0族電子數 | |
| 周期↓ | I A | 0 | |||||||||||||||||||
| 1 | 1 H 氫 | 2 He 氦 | K | 2 | |||||||||||||||||
| II A | III A | IV A | V A | VI A | VII A | ||||||||||||||||
| 2 | 3 Li 鋰 | 4 Be 鈹 | 5 B 硼 | 6 C 碳 | 7 N 氮 | 8 O 氧 | 9 F 氟 | 10 Ne 氖 | L K | 8 2 | |||||||||||
| 3 | 11 Na 鈉 | 12 Mg 鎂 | 13 Al 鋁 | 14 Si 矽 | 15 P 磷 | 16 S 硫 | 17 Cl 氯 | 18 Ar 氬 | M L K | 8 8 2 | |||||||||||
| III B | IV B | V B | VI B | VII B | VIII | I B | II B | ||||||||||||||
| 4 | 19 K 鉀 | 20 Ca 鈣 | 21 Sc 鈧 | 22 Ti 鈦 | 23 V 釩 | 24 Cr 鉻 | 25 Mn 錳 | 26 Fe 鐵 | 27 Co 鈷 | 28 Ni 鎳 | 29 Cu 銅 | 30 Zn 鋅 | 31 Ga 鎵 | 32 Ge 鍺 | 33 As 砷 | 34 Se 硒 | 35 Br 溴 | 36 Kr 氪 | N M L K | 8 18 8 2 | |
| 5 | 37 Rb 銣 | 38 Sr 鍶 | 39 Y 釔 | 40 Zr 鋯 | 41 Nb 鈮 | 42 Mo 鉬 | 43 Tc 鎝 | 44 Ru 釕 | 45 Rh 銠 | 46 Pd 鈀 | 47 Ag 銀 | 48 Cd 鎘 | 49 In 銦 | 50 Sn 錫 | 51 Sb 銻 | 52 Te 碲 | 53 I 碘 | 54 Xe 氙 | O N M L K | 8 18 18 8 2 | |
| 6 | 55 Cs 銫 | 56 Ba 鋇 | 57- 71 鑭系 | 72 Hf 鉿 | 73 Ta 鉭 | 74 W 鎢 | 75 Re 錸 | 76 Os 鋨 | 77 Ir 銥 | 78 Pt 鉑 | 79 Au 金 | 80 Hg 汞 | 81 Tl 鉈 | 82 Pb 鉛 | 83 Bi 鉍 | 84 Po 釙 | 85 At 砹 | 86 Rn 氡 | P O N M L K | 8 18 32 18 8 2 | |
| 7 | 87 Fr 鍅 | 88 Ra 鐳 | 89- 103 錒 | 104 Rf 鑪 | 105 Db | 106 Sg | 107 Bh | 108 Hs | 109 Mt | 110 Ds 鐽 | 111 Rg 錀 | 112 Uub | 113 Uut | 114 Uuq | 115 Uup | 116 Uuh | 117 Uus | 118 Uuo | |||
| 鑭系元 素 | 57 La 鑭 | 58 Ce 鈰 | 59 Pr 鐠 | 60 Nd 釹 | 61 Pm 鉕 | 62 Sm 釤 | 63 Eu 銪 | 64 Gd 釓 | 65 Tb 鋱 | 66 Dy 鏑 | 67 Ho 鈥 | 68 Er 鉺 | 69 Tm 銩 | 70 Yb 鐿 | 71 Lu 鑥 | ||||||
| 錒系元 素 | 89 Ac 錒 | 90 Th 釷 | 91 Pa 鏷 | 92 U 鈾 | 93 Np 鎿 | 94 Pu 鈽 | 95 Am 鎇 | 96 Cm 鋦 | 97 Bk 錇 | 98 Cf 鐦 | 99 Es 鑀 | 100 Fm 鐨 | 101 Md 鍆 | 102 No 鍩 | 103 Lr 鐒 | ||||||
拼音是xian的漢字
| 拼音是xian的漢字共有156個,如下: |
| 涎|纖|險|餡|限|掀|先|線|縣|現|顯|閒|獻|嫌|陷|鮮|弦|銜|鹹|杴|仙|腺|賢|憲|舷|羨|蘚|峴|癇|秈|嫻|蜆|獫|祆|躚|醯|暹|氙|鷳|筅|仚|伭|佡|僊|僩|僲|僴|咞|哯|啣|嘕|垷|奾|妶|姭|娨|娹|婱|嫺|嫻|尟|尠|屳|峴|嶮|嶮|幰|廯|忺|憪|憲|憸|撏|揱|搟|撊|撏|攇|晛|枮|櫶|毨|澖|瀗|灦|烍|獮|獫|獮|玁|玹|珗|現|甉|癇|癎|県|睍|礥|禒|秈|箲|粯|絃|絤|綖|綫|線|縣|繊|線|羨|胘|臔|臽|苮|蘚|蚿|蛝|蜆|衘|褼|誢|誸|譣|豏|賢|贒|赻|蹮|躚|軐|銜|鋧|鍁|鍌|鑦|閑|陥|険|韅|韯|韱|顕|顯|馦|鮮|鱻|鶱|鷳|鷴|鷼|麙|麲|黹|鼸 |

