簡介
 氬的原子光譜
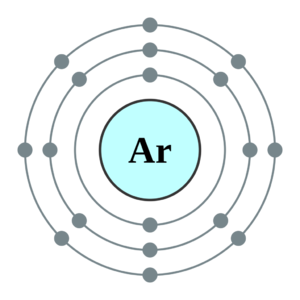
氬的原子光譜 氬(Argon)是一種化學元素,在希臘語有“不活潑”的意思,由它的特性而來。它的化學符號是Ar,它的原子序數是18,在室溫下是無色無味氣體。由於原子外層軌道充滿電子,因此它不容易發生化學反應,是一種惰性氣體。把它放電時呈紫色。已知的氬的同位素共有14種,包括氬33至氬46。氬占大氣體積的0.93%,是地球大氣中第三多的氣體,也是在大氣中含量最多的惰性氣體。它的三相點以國際實用溫標定義為83.8058K。
發現歷史

氬曾經在1785年由亨利·卡文迪什製備出來,但卻沒發現這是一種新的元素;直到1894年,約翰·威廉·斯特拉斯和蘇格蘭的化學家威廉·拉姆齊才通過實驗確定氬是一種新元素。他們主要是先從空氣樣本中去除氧、二氧化碳、水汽等後得到的氮氣與從氨分解出的氮氣比較,結果發現從氨里分解出的氮氣比從空氣中得到的氮氣輕1.5%。雖然這個差異很小,但是已經大到誤差的範圍之外。所以他們認為空氣中應該含以一種不為人知的新氣體,而那個新氣體就是氬氣。
另外1882年H.F.紐厄爾和W.N.哈特萊從兩個獨立的實驗中觀測空氣的顏色光譜時,發現光譜中存在已知元素光譜無法解釋的譜線,但並沒有意識到那就是氬氣。由於在自然界中含量很多,氬是目前最早發現的稀有氣體,它的符號為Ar(在1957年以前,它的符號為A)。[2]
氬的發現解釋了為什麼氮從空氣中提取的密度不同於分解氨獲取的。
Ramsay在空氣中提取的氬中移除了所有氮,由其和熱的鎂反應實現的,形成固態的氮化鎂。他之後得到了一種不發生反應的氣體,當他檢查其光譜後,他看到了一組新的紅色和綠色的線,從而確認了這是一種新的元素。
19世紀末期,英國物理學家瑞利勳爵發現利用空氣除雜製得的氮氣和從氨製得的氮氣的密度有大約是千分之一的差別。他在當時很有名望的英國《自然》雜誌上發表了他的發現,並請大家幫他分析其中的原因。倫敦大學化學教授萊姆塞推斷空氣中的氮氣里可能含有一種較重的未知氣體。他們兩人又各自做了大量的實驗,終於發現了在空氣中還存在一種密度幾乎是氮氣密度一倍半的未知氣體。
1894年8月13日,英國科學協會在牛津開會,瑞利作報告,根據馬丹主席的建議,把新的氣體叫做argon(希臘文意思就是“不工作”、“懶惰”)。元素符號Ar。當然,當時發現的氬,實際上是氬和其他惰性氣體的混合氣體,正是因為氬在空氣中存在的惰性氣體的含量占絕對優勢,所以它作為惰性氣體的代表被發現。氬的發現是從千分之一微小的差別開始的,是從小數點右邊第三位數字的差別引起的,不少化學元素的發現,許多科學技術的發明創造,都是從這種微小的差別開始的。
性質
物理性質
氬在通常條件下位無色、無味氣體。有24種同位素,氬40、氬36、氬38是穩定的,其中氬40占99.6%。氬通電之後發出紅紫色的光。
| 熔點 | -189.2°C |
| 沸點 | -185.7°C |
| 氣體密度 | 1.784g/L |
| 水中溶解度 | 33.6cm 3/L |
| 在大氣中的含量 | 0.934% |
化學性質
化學元素周期表零族(類)主族元素,符號Ar或A,原子序數18。化學性質極不活躍,一般不生成化合物,但可與水、氫醌等形成籠狀化合物。氬的化學性質極其穩定,一般不與其它元素化合。至今僅在極端條件下製得唯一的氬化合物氟氬化氫(HArF)。這個氟、氫和氬的化合物在-265°C才能保持穩定。此外,氬還可以作為客體分子,與水形成包合物。除了以上基態的物質外,已經發現含氬的離子和激發態配合物(像ArH和ArF),而根據理論計算顯示氬應該可以形成在室溫下穩定的化合物,雖然還沒有發現它們存在的線索。
此外,2003年時有媒體報導ArF2的存在,但尚未證實。原子序18
原子量39.98
原子半徑1.54
特性
 一小塊正在熔化的固態氬
一小塊正在熔化的固態氬 氬,是一種稀有氣體。無論是氣態還是液態,都是無色、無味而且無毒。它在水中的溶解度比氮多出了2.5倍。雖然氬在一般的情況向都很穩定,不會與其它化合物或元素化合,但是科學家還是有辦法在極端的條件下形成一些氬化合物,像是2000年8月由芬蘭化學家馬庫·拉薩能(MarkkuRäsänen)領導的小組發現的氟氬化氫(HArF)。這個氟、氫和氬的化合物在−265°C才能保持,此外,氬還可以作為客體分子,與水形成包合物。除了以上基態的物質外,目前已經發現含氬的離子和激發態配合物(像ArH+ 和ArF),而根據理論計算顯示氬應該可以形成在室溫下穩定的化合物,雖然目前還沒有發現它們存在的線索。
氬氣常被注入燈泡內,因為氬即使在高溫下也不會與燈絲髮生化學作用,從而延長燈絲的壽命,在不鏽鋼、錳、鋁、鈦和其它特種金屬電弧焊接時、鋼鐵生產時,氬也用作保護氣體。
天然含量
氬在地球大氣中的含量以體積計算為0.934%,而以質量計算為1.29%,在地殼中,由於氬在自然情況下不與其他化合物反應,而無法形成固態物質,但可以被“困在”放射性岩石中。鑒於空氣中的氬更易得,工業用的氬大多就直接從空氣中提取。主要是用分餾法提取,而像是氮、氧、氖、氪、氙等氣體也都是這樣從空氣中提取的。而在火星的大氣中,氬-40以體積計算的話占有1.6%,而氬-36的濃度為5ppm;另外1973年水手號計畫的太空探測器飛過水星時,發現它稀薄的大氣中占有70%氬氣,科學家相信這些氬氣是從水星岩石本身的放射性同位素衰變而成的。卡西尼-惠更斯號在土星最大的衛星,也就是泰坦上,也發現少量的氬。
同位素
氬穩定的同位素有氬-40(40 Ar)天然含量99.6%、氬-36(36 Ar)天然含量0.34%和氬-38(38 Ar)天然含量0.06%。一般來說穩定的氬-40是由地殼中的鉀-40(40 K)經由電子俘獲或正子發射衰變來的。鉀-40以這兩種方式衰變成氬只占所有的11.2%,另外還有88.8%的氬經由鈣-40(40 Ca)的β衰變而來。這個特性可以被用來測定岩石的年齡。
在地球大氣中,不穩定的氬-39(39 Ar)可經由宇宙射線轟擊氬-40而生成,另外也可以經由鉀-39(39 K)的中子俘獲而來。至於氬-37,則可以從(37 Ar)核試驗中形成的鈣的人造同位素衰變而來,氬-37的壽命非常短,半衰期只有35天。
化合物
由於氬氣擁有的八個價電子,占滿了其原子軌道的最外層,因此不容易與其他的原子結合,化學性質非常不活潑。在1962年以前,一般認為氬和其他的惰性氣體是完全無法與其他物質產生化學反應,但不久之後比氬重的氙和氪的化合物就陸續被合成,因此也激勵了科學家發現新的稀有氣體化合物。在2000年8月,第一個氬的化合物在芬蘭的赫爾辛基大學由馬庫·拉薩能領導的小組首先被製備出來,他們利用紫外線照射含有微量氟化氫的氬氣冰塊,形成了氟氬化氫,分子式為HArF,這種化合物可以在40K(−233°C)的低溫下保持穩定。另外在2003年發現了一種新氬化合物存在的蹤跡,二氟化氬(ArF2),但目前還沒有任何可靠的證據可以證實。
製備方法
工業上
目前在工業上得到氬的方法就是把空氣蒸餾。用冷凝器可以先把沸點90.2K的氧液化,移除液氧之後繼續冷卻就可以液化沸點為87.3K的氬氣,最後留下沸點77.35K的氮氣。目前以這種方法製造的氬氣在全世界高達七十萬噸/年。
其他方法
另外用鉀-40的衰變也可以製造氬氣,但這種製備法的效率並不高,因為鉀-40的半衰期長達1.26×109 年,所以並不常用。如果要製造氬的放射性同位素的話,就必須要靠回旋加速器和重離子加速器來將其他元素轉換成氬的同位素。
主要用途
 裝有氬和汞蒸氣的能霓虹燈。
裝有氬和汞蒸氣的能霓虹燈。 因為氬氣具有惰性、低傳熱率等性質,因此它被廣泛地運用在許多方面。
氬氣最主要的用處就是它的惰性,可以保護一些容易與周遭物質發生反應的東西。雖然其他的惰性氣體也有這些特性,但是氬氣在空氣中的含量最多,也是最容易取得,因此相對就比較便宜,具有經濟效益。另外氬氣便宜的原因還有它是製造液氧和液氮的副產品,而由於它們兩個都是工業上重要的原料,生產很多,所以每年都有很多的液氬副產品。
以氬惰性的用途主要有:
1.電燈泡里的填充氣體,由於氬氣不會與燈芯產生化學反應,而又能保持氣壓減緩鎢絲升華,可延長燈絲使用壽命。
2.氬可當作焊接時所用的保護氣體,其中包括MIG焊接、GTA焊接與GMA焊接等,在這時氬通常會和二氧化碳混合在一起使用。
3.可用於滅火,用氬氣滅火的好處是幾乎不會破壞任何火場的物品,通常使在火場有特殊儀器時才使用。
4.是用於感應耦合等離子的氣體之一。
5.用於保護加工中的鈦和其他容易發生反應的金屬。
6.保護成長中的矽晶體和鍺晶體,這晶體主要用於半導體學。
7.在博物館里,會在一些重要文物的玻璃專櫃裡填充氬氣,避免氧化。
8.在啤酒罐中的填充物,雖然也可以用氮氣代替。
9.在釀酒的過程中,啤酒桶里的填充物,它可以把氧氣置換,以避免啤酒桶里的原料被氧化成乙酸。
10.在藥學里,氬可以用於保護一些靜脈內的治療的藥物,舉個例子,像是對乙醯氨基酚。一樣的,這也是防止藥物受到氧氣的破壞。
11.用於冷卻AIM-9響尾蛇飛彈的追蹤器,氬當時都是以高壓儲存,然後當釋放氣體後就可以帶走一些熱量。
12.為石墨電熔爐中的保護氣體,以免它被氧化。
另外氬氣的低傳熱率也是它的特性之一,像它可以作為隔熱窗戶中兩層玻璃之間的填充物。因為它的低傳熱率和惰性,氬氣在水肺潛水可以用來作為膨脹潛水衣的氣體。氬氣還可以在水肺中代替氮氣(吸收純氧對身體不好,因此水肺中要添加其他氣體),因為氮氣在高壓下會溶進血液里而造成氮麻醉,氬氣則可以減輕這種症狀(雖然一般來說,惰性氣體也會造成這種症狀)。
使用特定的方法可以使氬氣離子化並且發光,這種功能可用於等離子燈和粒子物理學中的能量器。以氬作成的氬雷射會發出藍光,它在醫學外科中可用於連線動脈、去除腫瘤和治療眼睛的缺陷等。氬氣還可以用於濺鍍。另外氬-39有269年的半衰期,可以用於測定地下水和冰層的年齡,而鉀-氬年代測定法適用鉀-40衰變成氬-40的過程來用於測定火成岩的年齡。
危害
一般來說,氬氣是對身體毫無危害的,但是如果長期暴露在高濃度的氬氣中會因為缺氧而窒息,液態氬則可能造成爆炸及凍傷。
泄露事故
2014年6月30日凌晨4點50,南鋼煉鋼廠轉爐車間一鋼包底吹用氬氣的金屬軟管發生故障,協力檢修單位江都建設公司安排人員去現場更換金屬軟管,隨後發生兩名檢修人員在事故現場窒息,另一監護人員去救援時也發生窒息事故。三人後經醫院搶救無效死亡。
據南京鋼鐵廠新聞發言人黃姓部長介紹,氣體泄露事故發生後,已經被周圍員工第一時間堵漏,泄露氣體很少,基本不會對周邊大氣環境造成影響。
化學元素周期表
| 族→ | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 電子層 | 0族電子數 | |
| 周期↓ | I A | 0 | |||||||||||||||||||
| 1 | 1 H 氫 | 2 He 氦 | K | 2 | |||||||||||||||||
| II A | III A | IV A | V A | VI A | VII A | ||||||||||||||||
| 2 | 3 Li 鋰 | 4 Be 鈹 | 5 B 硼 | 6 C 碳 | 7 N 氮 | 8 O 氧 | 9 F 氟 | 10 Ne 氖 | L K | 8 2 | |||||||||||
| 3 | 11 Na 鈉 | 12 Mg 鎂 | 13 Al 鋁 | 14 Si 矽 | 15 P 磷 | 16 S 硫 | 17 Cl 氯 | 18 Ar 氬 | M L K | 8 8 2 | |||||||||||
| III B | IV B | V B | VI B | VII B | VIII | I B | II B | ||||||||||||||
| 4 | 19 K 鉀 | 20 Ca 鈣 | 21 Sc 鈧 | 22 Ti 鈦 | 23 V 釩 | 24 Cr 鉻 | 25 Mn 錳 | 26 Fe 鐵 | 27 Co 鈷 | 28 Ni 鎳 | 29 Cu 銅 | 30 Zn 鋅 | 31 Ga 鎵 | 32 Ge 鍺 | 33 As 砷 | 34 Se 硒 | 35 Br 溴 | 36 Kr 氪 | N M L K | 8 18 8 2 | |
| 5 | 37 Rb 銣 | 38 Sr 鍶 | 39 Y 釔 | 40 Zr 鋯 | 41 Nb 鈮 | 42 Mo 鉬 | 43 Tc 鎝 | 44 Ru 釕 | 45 Rh 銠 | 46 Pd 鈀 | 47 Ag 銀 | 48 Cd 鎘 | 49 In 銦 | 50 Sn 錫 | 51 Sb 銻 | 52 Te 碲 | 53 I 碘 | 54 Xe 氙 | O N M L K | 8 18 18 8 2 | |
| 6 | 55 Cs 銫 | 56 Ba 鋇 | 57- 71 鑭系 | 72 Hf 鉿 | 73 Ta 鉭 | 74 W 鎢 | 75 Re 錸 | 76 Os 鋨 | 77 Ir 銥 | 78 Pt 鉑 | 79 Au 金 | 80 Hg 汞 | 81 Tl 鉈 | 82 Pb 鉛 | 83 Bi 鉍 | 84 Po 釙 | 85 At 砹 | 86 Rn 氡 | P O N M L K | 8 18 32 18 8 2 | |
| 7 | 87 Fr 鍅 | 88 Ra 鐳 | 89- 103 錒 | 104 Rf 鑪 | 105 Db | 106 Sg | 107 Bh | 108 Hs | 109 Mt | 110 Ds 鐽 | 111 Rg 錀 | 112 Uub | 113 Uut | 114 Uuq | 115 Uup | 116 Uuh | 117 Uus | 118 Uuo | |||
| 鑭系元 素 | 57 La 鑭 | 58 Ce 鈰 | 59 Pr 鐠 | 60 Nd 釹 | 61 Pm 鉕 | 62 Sm 釤 | 63 Eu 銪 | 64 Gd 釓 | 65 Tb 鋱 | 66 Dy 鏑 | 67 Ho 鈥 | 68 Er 鉺 | 69 Tm 銩 | 70 Yb 鐿 | 71 Lu 鑥 | ||||||
| 錒系元 素 | 89 Ac 錒 | 90 Th 釷 | 91 Pa 鏷 | 92 U 鈾 | 93 Np 鎿 | 94 Pu 鈽 | 95 Am 鎇 | 96 Cm 鋦 | 97 Bk 錇 | 98 Cf 鐦 | 99 Es 鑀 | 100 Fm 鐨 | 101 Md 鍆 | 102 No 鍩 | 103 Lr 鐒 | ||||||
化學元素(一)
元素性質
| 為了方便閱讀者查閱元素周期表中各元素符號的性質及特點,比較系統的歸納和總結各元素的套用價值及注意事項,從而為需要相關知識的人們形成知識的鏈條,本次主要是對有些元素的內容進行補充及完善。 |