概述
簡介
 |
| 鋰 |
性質
銀白色的金屬。密度0.534克/厘米3。熔點180.54℃。沸點1317℃。是最輕的金屬。可與大量無機試劑和有機試劑發生反應。與水的反應非常劇烈。在500℃左右容易與氫發生反應,是唯一能生成穩定得足以熔融而不分解的氫化物的鹼金屬,電離能5.392電子伏特,與氧、氮、硫等均能化合,是唯一的與氮在室溫下反應,生成氮化鋰(Li3N)的鹼金屬。由於易受氧化而變暗,故應存放於液體石蠟中。存在
鋰在自然界中豐度較大,居第27位,在海水中大約2600億噸鋰,在地殼中約含0.0065%。鋰僅以化合物的形式廣泛存在於自然界中。鋰的礦物有30於種,主要存在於鋰輝石(LiAlSi2O6)和鋰雲母以及透鋰長石((LiNa)AlSi4O10)和磷鋁石中。在人和動物的有機體、土壤和礦泉水、可可粉、菸葉、海藻中都有鋰的存在。人和動物體內也有極少的鋰存在。體重70公斤的正常人體中,鋰的含量為2.2毫克。發現
發現人:阿爾費德森發現年代:1817年
發現過程:從金屬與酸作用所得的氣體中發現氫。1817年,瑞典的阿爾費德森,最先在分析透鋰長石時發現了鋰。
鋰是繼鉀和鈉後發現的又一鹼金元素。發現它的是瑞典化學家貝齊里烏斯的學生阿爾費特森。1817年,他在分析透鋰長石時,最終發現一種新金屬,貝齊里烏斯將這一新金屬命名為lithium,元素符號定為Li。該詞來自希臘文lithos(石頭)。鋰發現的第二年,得到法國化學家伏克蘭重新分析肯定。到1855的年本生和馬奇森採用電解熔化氯化鋰的方法才製得它,工業化制鋰是在1893年由根莎提出的,鋰從被認定是一種元素到工業化製取前後歷時76年。鋰在地殼中的含量比鉀和鈉少的多,它的化合物不多見,是它比鉀和鈉發現的晚的必然因素。現在電解LiCl製取鋰,仍要消耗大量的電能,每煉一噸鋰就耗電高達六、七萬度。
綜合性質
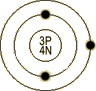 |
| 鋰電子模型 |
元素英文名稱:Lithium
來由:希臘文:lithos(石)
元素類型:鹼金屬
相對原子質量:6.941
氧化態:MainLi+1
OtherLi-1(inliquidNH3)
電離能(kJ/mol)
M-M+513.3
M+-M2+7298.0
M2+-M3+11814.8
原子序數:3
元素符號:Li
相對原子質量:6.941
核內質子數:3
核外電子數:3
核電核數:3
質子質量:5.019E-27
質子相對質量:3.021
所屬周期:2
所屬族數:IA
晶體結構:晶胞為體心立方晶胞,每個晶胞含有2個金屬原子。
晶胞參數:
a=351pm
b=351pm
c=351pm
α=90°
β=90°
γ=90°
熱導率:W/(m·K)
84.8
聲音在其中的傳播速率:(m/S)
6000
莫氏硬度:0.6
摩爾質量:7g/mol
性質與狀態
鋰是一種柔軟的,銀灰色,極易反應的鹼金屬元素。它在金屬中比重最輕。鋰在空氣中易被氧化,所以須貯存於固體石蠟或惰性氣體中。它能與水和酸作用放出氫氣,易與氧、氮、硫等化合。鋰鹽在水中的溶解度與鎂鹽類似,而不同於其他的鹼金屬鹽。鋰不但是既輕又軟、比熱最大的金屬,而且還是在通常溫度下呈固體狀態的一般材料中最輕的一種,通常貯藏於煤油或液體石蠟中。純鋰的比重跟乾燥的木材差不多,等於一般稱作輕金屬的鋁的密度的五分之一,幾乎只有同體積水的重量的一半。即使把鋰放到汽油中,它也會象軟木塞一樣輕輕地浮起來。在室溫條件下,鋰能和空氣中的氮氣和氧氣發生強烈的化學反應。由於鋰具有和氫、氧、氮、碳及氧化物、矽酸鹽等物質結合的能力,冶金工業部門把鋰作為“捕氣劑”、“脫流劑”,可以消除金屬鑄件中的孔隙氣泡、雜質和其他缺陷。
物理性質
鋰的密度非常小,僅有0.534g/cm3,為非氣態單質中最小的一個。因為鋰原子半徑小,故其比起其他的鹼金屬,壓縮性最小,硬度最大,熔點最高。溫度高於-117℃時,金屬鋰是典型的體心立方結構,但當溫度降至-201℃時,開始轉變為面心立方結構,溫度越低,轉變程度越大,但是轉變不完全。在20℃時,鋰的晶格常數為3.50Å[3],電導約為銀的五分之一。鋰可以很容易的與除鐵以外的任意一種金屬熔合[4]。化學性質
金屬鋰的化學性質十分活潑,在一定條件下,能與除稀有氣體外的大部分金屬與非金屬反應,但不像其他的鹼金屬那樣容易。鋰能同鹵素髮生反應生成鹵化鋰。常溫下,在除去二氧化碳的乾燥空氣中幾乎不與氧氣反應,但在100℃以上能與氧生成氧化鋰,發生燃燒,呈藍色火焰,但是其蒸汽火焰呈深紅色,反應如同點燃的鎂條一樣,十分激烈、危險;儘管它不如其他鹼金屬那樣容易燃燒,但是它燃燒起來的猛烈程度卻是其他鹼金屬所無法比的,就如同鎂燃燒比鈉燃燒更激烈一樣。氧族其它元素也能在高溫下與鋰反應形成相應的化合物。鋰與碳在高溫下生成碳化鋰。在鋰的熔點附近,鋰很容易與氫反應,形成氫化鋰。鋰還可以與水較快地發生作用,但是反應並不特別劇烈,不燃燒,也不熔化,其原因是它的熔點、著火點較高,且因生成物LiOH溶解度較小(20℃:12.3~12.8g/100gH2O),易附著在鋰的表面阻礙反應繼續進行。([5])鋰很軟,可以用小刀輕輕切開,新切開的鋰有金屬光澤,但是暴露在空氣中會慢慢失去光澤,表面變黑,若長時間暴露,最後會變為白色。主要是生成氧化鋰和氮化鋰,氫氧化鋰,最後變為碳酸鋰[6]。
塊狀鋰可以與水發生反應,粉末狀鋰與水發生爆炸性反應。鹽酸、稀硫酸、硝酸能與鋰劇烈反應,濃硫酸僅與鋰緩慢反應。
鋰能同很多有機化合物發生反應,很多反應在有機合成上有重要的意義。
同位素與核性質
在自然界中,鋰是以兩種同位素組成,6Li和7Li,豐度分別為7.42%和92.58%。通過人工製備,已得到鋰的四种放射性同位素5Li、8Li、9Li、11Li。他們的衰變方式如下[7]:
鋰的同位素可以發生下列反應,放出熱量。也可以用來製作氚。
用途
將質量數為6的同位素(6Li)放於原子反應堆中,用中子照射,可以得到氚。氚能用來進行熱核反應,有著重要的用途。鋰主要以硬脂酸鋰的形式用作潤滑脂的增稠劑。這種潤滑劑兼有高抗水性、耐高溫和良好的低溫性能。鋰化物用於陶瓷製品中,以起到助溶劑的作用。在冶金工業中也用來作脫氧劑或脫氯劑,以及鉛基軸承合金。鋰也是鈹、鎂、鋁輕質合金的重要成分。螢光屏是把螢光物質塗在玻璃上製成的。不過這不是普通的玻璃,而是加進了鋰的鋰玻璃。在玻璃中加進鋰或鋰的化合物,可以提高玻璃的強度和韌性。
把含鋰的陶瓷塗到鋼鐵或鋁、鎂等金屬的表面,形成一層薄而輕、光亮而耐熱的塗層,可作噴氣發動機燃燒室和火箭、飛彈外殼的保護層。鋰與鋁、鎂、鈹等“合作”組成合:金,既輕又韌,已被大量用於飛彈、火箭、飛機等製造上。
潤滑劑中加進鋰的化合物,可以大大改善潤滑效能。此種潤滑劑適用於溫度在—50℃至200℃的範圍,因此被廣泛套用於航空、動力等部門的各種機械裝置和儀器儀表。
某些鋰的有機化合物,如硬脂酸鋰、軟脂酸鋰等,它們的物理姓能不隨環境溫度變化而改變,因此是二種安全可靠的潤滑劑,並具有“永久性”作用。如果在汽車的一些零件上加一次鋰潤滑劑,就足以用到汽車報廢為止。
氫化鋰遇水發生猛烈的化學反應,產生大量的氫氣。兩公斤氫化鋰分解後,可以放出氫氣566千升。氫化鋰的確是名不虛傳的“製造氫氣的工廠”。第二次世界大戰期間,美國飛行員備有輕便的氫氣源——氫化鋰丸作應急之用。飛機失事墜落在水面時,只要一碰到水,氫化鋰就立即與水發生反應,釋放出大量的氫氣,使救生設備(救生艇、救生衣、訊號氣球等)充氣膨脹。
鹼性蓄電池組的電解溶液里有氫氧化鈉溶液,現在加入幾克氫氧化鋰溶液,蓄電池的使用壽命可以增加兩倍,工作溫度範圍可加大到-20℃----40℃。
鋰—氯、鋰—硒之類的電池,已在手機、筆記本電腦以及某些國防軍事部門中得到套用。用鋰電池發電來開動汽車,行車費用只有普通汽油發動機汽車的三分之一。鋰高能電池是一種很有前途的動力電池。它重量輕,貯電能力大,充電速度快,適用範圍廣,生產成本低,工作時不會產生有害氣體,不至於造成大氣污染。由鋰製取氚,用來發動原子電池組,中間不需充電,可連續工作20年。
氫彈里裝的不是普通的氫,而是比普通氫幾乎要重一倍的重氫或重二倍的超重氫。用鋰能夠生產出超重氫——氚,還能製造氫化鋰、氘化鋰、氚化鋰。早期的氫彈都用氘和氚的混和物作“炸藥”,當今的氫彈里的“爆炸物”多數是鋰和氘的化合物——氘化鋰。我國1967年6月l7日成功地爆炸的第一顆氫彈,其中的“炸藥”就是氫化鋰和氘化鋰。1公斤氘化鋰的爆炸力相當於5萬噸烈性梯恩梯炸藥。據估計,l公斤鈾的能量若都釋放出來可以使一列火車運行4萬公里;l公斤氘和氚的混和物卻可以使一列火車從地球開到月球;而I公斤鋰通過熱核反應放出的能量,相當於燃燒20000多噸優質煤,比1公斤鈾通過裂變產生的原子能人10倍。
合成原料
在許多反應中,鋰可以作為原料或中間物。在合成與鋰相關的無機化合物時,常常是將金屬鋰於其他單質反應。若要求純度較高,可以用鋰與氣態單質或化合物反應。例如用鋰和硫化氫合成硫化鋰。反應方程式如下:2Li+H2S=Li2S+H2
還原劑
主條目:Birch還原金屬鋰溶於液氨和乙醇的混合溶劑中形成一個良好的還原劑,可以用來還原含芳環的有機化合物。比較貴重的甾族化合物通常用這種辦法來還原。這個方法的優點是產率較高,缺點是比用鈉還原昂貴,所以僅限於還原一些貴重的化合物。
催化劑
鋰可用作丁二烯、異戊二烯等二烯烴聚合催化劑,也可以用來製造共聚物。電池工業
因為鋰的原子量很小,只有3,因此用鋰作陽極的電池具有很高的能量密度。鋰也能夠製造低於室溫或高溫下使用的電池[2]。低於室溫的電池,通常使用有機溶劑作為電解質,其中添加一些無機鹽增加導電性,常用無機鹽包括高氯酸鋰、六氟磷酸鋰、六氟砷酸鋰和硫化鋰等。二次鋰電池中正極材料也為含鋰化合物,如鋰鈷氧化物、鋰鎳氧化物、鋰錳氧化物、鋰鐵氧化物等等,以及其幾元化合物。二次鋰電池中負極材料,也與鋰的作用明顯。
電池陽極是鋰,陰極常用金屬氯化物。例如鋰-氯化銀電池的電池反應為:
Li+AgCl=LiCl+Ag
高溫下的電池,通常使用熔融的無機鹽作為電解質,因此必須在該鹽的熔點以上方可使用。例如:
2Li+Cl2=2LiCl
合金
摻有鋰的合金一般有強度大,密度小,耐高溫等特性。也有人用鋰合成了Li-Pb液態半導體合金[9]。其他用途
用鋰作為燃料發射的魚雷鋰還能用於:
原子能工業中製造核反應堆的載熱劑
製造特種合金、特種玻璃等
作冶金工業中的脫氧劑,脫硫劑和脫泡劑
作為燃料,可發射魚雷等武器
資源
鋰號稱“稀有金屬”,其實它在地殼中的含量不算“稀有”,地殼中約有0.0065%的鋰,鋰的地殼豐度為18x10-4%,居第二十七位,海水含鋰2x10-5%。已知含鋰的礦物有150多種,以鋰為主的礦物30種,具有工業價值的有六種,其中主要有鋰輝石(LiAlSi2O6)、鋰雲母[Li2(F,OH)2Al(SiO3)3]、透鋰長石等。海水中鋰的含量不算少,總儲量達2600億噸,可惜濃度太小,提煉實在困難。某些礦泉水和植物機體裡,含有豐富的鋰。如有些紅色、黃色的海藻和菸草中,往往含有較多的鋰化合物,可供開發利用。世界鋰儲量約3670萬噸,美國是鋰資源最豐富的國家。中國鋰資源豐富,產地主要分布在新疆、江西、湖南、四川等省,世界屋脊青藏高原,鹽湖星羅棋布,其中鋰、銣、銫含量之高,甚為罕見。我國的鋰礦資源豐富,以目前我國的鋰鹽產量計算,僅江西雲母鋰礦就可供開採上百年。製備
鋰礦的提取法
硫酸鹽法鋰輝石和硫酸鉀一起燒結,鉀將鋰置換出來,形成可溶於水的硫酸鋰。
2LiAl(SO3)2+K2SO4=Li2SO4+2KAl(SO3)2
硫酸鹽分解法在很長一段時間是工業製備鋰的唯一方法。此方法不僅適用於鋰灰石,也可以用來處理鋰雲母。
石灰法
將石灰或石灰石與鋰礦石一起燒結,然後用水處理,浸去液經過多次蒸發,既可以從中結晶析出氫氧化鋰。反應式如下,反應溫度為1000℃:
2LiAl(SiO3)2+9CaO=Li2O+CaO·Al2O3+4[2CaO·SiO2]
這個方法的優點是:
適用性強,能夠分解幾乎所有的鋰礦石。
反應不需要稀缺原料,石灰和石灰石均較便宜且容易獲得。
這個方法的缺點是:
要求精礦中含鋰量很高,因為在燒結時會使精礦貧化。
因為浸取後得到的是稀溶液,因此蒸發會消耗大量的熱量並且花費很多時間。
硫酸法
首先提出此方法的是R.B.Ellestad和K.M.Leute[4],此方法適用於β-鋰輝石和理雲母。原理如下,反應溫度為250-300℃:
2LiAl(SO3)2+H2SO4=Li2SO4+H2O·Al2O3·4SiO2
此反應的關鍵問題是只能與β-鋰輝石反應,對於α-鋰輝石,硫酸無法與之反應。用硫酸直接分解未經鍛燒的鋰輝石,提取出來的鋰僅占總量的4%[4]。
天然滷水的提取
鋰的來源也包括天然滷水和某些鹽湖水。加工過程是將鋰沉澱成Li2NaPO4,再將其轉變為碳酸鋰,即可以作為來源來加工其他鋰化合物了。加工天然滷水還可以得到硼砂、碳酸鉀、氯化鈉、硫酸鈉和氯化鎂等。
金屬鋰的製備
電解法鋰可由電解熔融的氯化鋰而製得。Guntz首先建議用電解熔融的氯化鋰和氯化鉀的混合物來製備金屬鋰[8],這樣可以把熔融溫度從單質鋰的610℃降低到400℃。以石墨為陽極,以低碳鋼為陰極,電解槽壓為6.0-6.5V。這樣就可以得到純度為99%的鋰。
Li++e−→Li
2Cl−+2e−→Cl2
2LiCl(l)→2Li(s)+Cl2(g)
電解法製得的金屬鋰通常含有機械雜質(例如Na、K、Mg、Ca、Fe、Si和Al等),因此需要提純;雜質可以重新熔融在藉助比重不同除去,不容易除去的鈉和鉀可以通過氫化法除去。
熱還原法
3Li2O+2Al=6Li+Al2O3—33.6千卡
2Li2O+Si=4Li+SiO2—76.3千卡
因為還原氧化鋰是吸熱反應,再加上金屬鋰的性質十分活潑,所以反應只能在高溫和高真空中進行。
鋰的生物必需性及人體健康效應
鋰能改善造血功能,提高人體免疫機能。鋰對中樞神經活動有調節作用,能鎮靜、安神,控制神經紊亂。鋰可置換替代鈉,防治心血管疾病。人體每日需攝入鋰0.1mg左右。鋰的生物必需性及人體健康效應。鋰是有效的情緒穩定劑。隨著新的情緒穩定劑的出現,對鋰治療的興趣和研究雖已減少,但鋰仍是治療急性躁狂症和躁狂-抑鬱病預防性管理的最有效措施。許多研究證明,鋰對動物和人具有必需功能或有益作用。動物缺鋰可導致壽命縮短、生殖異常、行為改變及其他異常。人類流行病學研究顯示,飲水鋰濃度與精神病住院率、殺人、自殺、搶劫、暴力犯罪和毒品犯罪率呈顯著負相關。毒品犯的營養性鋰補充研究證明鋰有改善和穩定情緒的作用。心臟病人、學習低能者和在押暴力犯發鋰含量顯著降低。碳酸鋰治療的臨床研究表明,鋰的主要反應器官為胃腸道、腎臟、神經、肌肉、內分泌和心血管系統。在170~228mgLi/d治療劑量範圍內,預期的血清鋰水平為0.4~0.8MEQ/L(2.78~5.55mg/L),無毒性反應。在鋰的危險性評估中,對治療劑量採用10倍安全因子對孕婦和胎兒不造成危害,這相當於成人每天攝入2
mgLi。動物的NOAEL(無毒性作用水平)為10mgLi/kg/d,採用32倍安全因子,得到日允許攝入量(ADI)為0.31
mgLi/kg/d。基於動物實驗數據,鋰的表觀缺乏攝入量為:山羊:<1.5mgLi/kg,大鼠:<15μgLi/kg。人對鋰的飲食需要量約為60~100μg/d,典型的日攝入量為200~600μg。蛋類、牛奶、奶製品、魚類、土豆和蔬菜含有豐富的鋰。
