基本概念
簡介
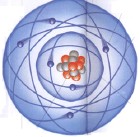
 核外電子 質子 中子 -內部結構模型圖
核外電子 質子 中子 -內部結構模型圖 核電荷數的測定
1913年, 莫斯萊(Henry Moseley)用不同元素作為產生x射線的靶子,測定其波長。他發現,每種元素能產生特徵x射線,不同元素的特徵x射線的波長不同。他從實驗數據中總結出一個 經驗公式:
1= λa (Z-b)2
式中λ為特徵x射線的波長,Z為原子序數,即元素在周期系中排列次序,a、b為常數。該式表明,λ倒數的平方根與原子序數成直線關係。
莫斯萊的研究成果
莫斯萊的研究成果揭示出,元素在周期系中的“位置”具有其內在根據,它是由元素的本性決定的,通過特徵x射線波長的定量數值表現出來。這項成果確定了元素周期系的嚴格順序,從氫到鈾依次排列92種元素;同時解決了按原子量順序排列的不協調問題,即揭開了元素排列順序中原子量倒置之謎。例如,碲的序號為52,碘的序號為53,碲理應排在碘的前面。發現歷史
荷蘭物理學家提出原子序數等於核電荷數
1913年, 荷蘭物理學家范登布洛夫提出,原子序數等於核電荷數。1920年, 查德威克(J·chadwick)做了不同元素的α散射實驗,測定核電荷,證明核電荷數等於原子序數。由此可以解釋一系列問題。首先,解釋了位移定則和 同位素現象。元素放射出α粒子,由於核電荷數減少α,相應的,原子序數減少α,元素在周期系中向左位移兩個位置;放射β粒子,核內一個中子轉變成一個質子,放射出一個電子,核電荷數增加一個單位,元素在周期系中向右移一個位置。原子核電荷相同,在周期系中即處於同一個位置,不論其原子量是多少,這就是說,同一元素核電荷數相同,原子量不同。其次,核電荷數可以確定元素原子的電子數。第三,核電荷數等於原子序數,使後者得到了物理解釋。元素周期系中的“位置”由核電荷數決定的
核電荷數等於原子序數,使元素周期系中的“位置”獲得了具體的物理意義;同時,它具體說明了“位置”是由什麼決定的問題,即由核電荷數決定的。因此,元素可以被理解為具有相同核電荷數的原子形式,或者說是具有相同核電荷數的一類原子。1919年, 盧瑟福(E·Rutherford)用α粒子轟擊氮,實現了人工核反應
放射性元素、非放射性元素都是可以轉化的
由此證明,元素,無論是 放射性元素還是非放射性元素都是可以轉化的,前者可天然轉化,後者可通過人工方式實現轉化。以前那種認為元素是絕對不變的、不可轉化的觀點,最終被證明是沒有根據的。現代化學中的元素概念的演變,是在19世紀元素周期系的元素概念的基礎上進行的,它表現為對周期系中“位置”的特徵的肯定、確證、充實和發展的過程。在這個演變中,元素是在周期系中占據一定位置的原子形式,這是在19世紀確立的,它作為一個基礎,是進一步演變的起點。天然放射性的發現沒有動搖這個基礎,相反,以元素天然轉化性說明了這個基礎的可靠性。同位素的發現進一步證明了這個基礎的牢固性。原子序數、核電荷數及兩者在數值上相等的發現,則進一步揭示了“位置”的本質,充實了它的內容。
相關定義
元素概念在歷史上演變的基本線索
總結以上所述,可以看出元素概念在歷史上演變的基本線索。最初,在化學確立為科學以前,元素是構成世界萬物的本原和基礎。在近代化學形成時期,繼承了本原、基礎的 思想,演變為物質可分解的限度,把元素看作不能分解或未能分解的物質。這種元素概念隨著分解物質的技術、方法的進步,其所包含的對象的範圍(元素概念的外延),先是大於實際存在的元素範圍,繼之等於、進而小於實際存在的元素範圍,到20世紀,一切元素都是可以分解的,這種元素概念再也不能反映元素的真實情況了。在近代化學發展時期,不可分解或未能分解這個特徵被承繼下來,並被轉移到原子上,以化學原子論為基礎,使 化學元素概念獲得了新的意義,化學元素表現為具有相同原子量的一類原子。 元素周期律發現以後,這一類原子在周期系中占據一定位置,從而使作為元素的物質內容的原子,具有了新的特徵,即除了原子量外,它在周期系中占有確定的位置,這個位置既包含了原子量又包含了化學性質。在現代化學中,原子量已被證明不是元素概念的基本特徵,而元素周期系中的位置仍保留了它的意義,而且以此為基礎,進一步充實、發展,揭示了化學元素的本質特徵,元素是具有相同核電荷數的原子形式。化學元素的含義通過概念的關係被揭示出來
在這個演變過程中,化學元素的含義是通過它與其他概念的關係獲得表現的,或者說是通過概念之間的關係被揭示出來的。具體地說有三種關係:第一種關係,元素和化合物的關係,元素是化合物的分解的限度,是組成化合物的成分,這個成分的具體物質形式是什麼呢?這就要求考察第二種關係,即元素和原子的關係,從這種關係來看,元素是一類原子,或原子種類,依據現代觀點,元素是具有相同核電荷數(核內質子數)的原子形式,或者說是核電荷數(核內質子數)相同的一類原子,在這個意義上,元素和原子具有相同點,每一化學元素符號既表示一種元素又表示該元素的一個原子。但是元素和原子又是有區別的,不能將二者混淆。從化學或科學的觀點說,元素是表示組成的概念,而原子可以表示組成,同時又能表示結構,表示物質的不連續性和顆粒性。從邏輯學角度來分析,元素概念是集合概念,原子概念是非集合概念。集合概念是以事物的集合體為反映對象的概念,非集合概念是不以事物的集合體為反映對象的概念,非集合概念既可適用於它所反映的類,也可以適用於該類中的分子①。元素是一類原子的總稱,它不能以個數相稱,原子可以表示原子這個類,也可表示其中的一個、兩個、三個原子,可用個數相數。除了上述兩種關係、兩種含義外,元素還以獨立的形式存在,這便涉及第三種關係即元素和單質的關係。從這種關係來說,元素是單質的成分,單質是元素在自由狀態(游離狀態)下的存在形式②;一些元素可以形成幾種單質,每一種單質都是元素在自由狀態下的存在形式;因此,元素和單質既相聯繫又相區別。三種關係、三種含義是密切聯繫的,其中,化學元素是原子形式、一定種類的原子,按現代觀點,是質子數(核電荷數)相同的原子,這是化學元素概念的核心,它指出了化學元素的物質內容,而其他兩種關係,則指出了元素的存在形式,化合物是不同元素共存的形式,單質是同種元素在游離狀態下的存在形式。元素和原子是有區別的
正如上面剛剛指出過的,元素和原子是有區別的,化學元素意義上的原子量和原子意義上的原子量也是有區別的。在發現氧的同位素以後,物理學中採用O16=16.00作為原子量的基準,化學中仍用天然氧原子量等於16.00作為基準。1960年,國際物理學會接受 德國質譜學家馬塔斯的建議,採用C12=12.00作為測定原子量的基準;1961年,國際化學會也採用這一基準。儘管如此,化學中的原子量和物理學中的原子量仍然是有區別的,或者說元素的原子量和原子的原子量是不同的。元素的原子量是該種元素各種同位素的平均值,例如,元素周期表中碳元素的原子量為12.01(碳有兩種同位素C12和C13,天然豐度分別為98.89%和1.11%,碳元素的原子量=12.00×98.8%+13.00×1.11%=12.01)。原子的原子量(或者說物理學中的原子量)在歷史上指的原子重量(atomic weight),但是,重量和質量是有區別的,重量是個可變數。國際原子能委員會認為,原子(重)量這一術語是歷史上形成的,已為使用者所理解,進而提出“原子質量”表示 核素的量,以區別於元素的原子量。核素和元素也是有區別的
核素和元素是有區別的。元素是指具有相同質子數的同一類原子的總稱,核素則是具有一定數目的質子和一定數目的中子的一種原子,每種元素都有一種或兩種或兩種以上的核素,現在已知元素109種,已知核素2000多種。核素和同位素也是有區別的。同位素指的是在元素周期表中占據同一位置、質子數相同中子數不同的同一元素的原子,核素指的是質子數相同、中子數也相同的原子。例如,對於鈉元素,我們不能說鈉只有一種同位素,(因為鈉元素沒有同位素,即沒有質子數相同中子數不同的原子),但可以說鈉元素只有一種核素,目前已知的單一核素的元素有20種。元素和同位素是化學概念,核素已超出了化學領域。從元素概念到核素概念,是認識向更深物質層次的發展。從發展的觀點看問題,過去常說的放射性“元素”,非放射性“元素”,應當用“核素”來代替。說成穩定核素、放射性核素。核電荷數=核內質子數=核外電子數
原子相對質量 約=質量數=質子數量+中子數量