穩定同位素
正文
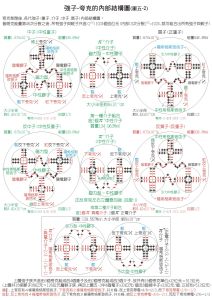 原子核/核子-內部結構模型圖
原子核/核子-內部結構模型圖 穩定性 通常以原子核的比結合能(每個核子的平均結合能)ε=EB/A作為穩定性的量度;EB為核的結合能,A為核子數。ε越大,體系的能量越低,也就越穩定。
自然界中,質子數Z的穩定範圍在1~83,例外的是沒有Z=43、61的穩定核素。A的穩定範圍在1~209, 但沒有A=5、8的穩定核素。中子數N的穩定範圍在0~126,其中沒有N=19、21、35、39、45、61、71、89、115、123的穩定核素。
將自然界存在的核素以N(N=A-Z)為縱坐標,Z為橫坐標作圖(圖1),
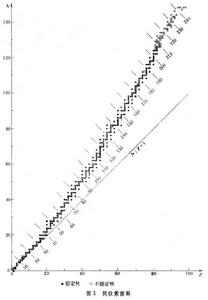 可見核素分布在一條很窄的帶上。在輕核部分,中子數與質子數相等或非常接近,當Z>20,即從鈣以後,N>Z,窄帶明顯的偏離N=Z的直線而向上發散,至Z=83,中質比為 1.52,以後就沒有穩定核素。這說明核的穩定性與中質比值有關,穩定核素的中子數和質子數有近似的對稱關係,而在穩定帶以外的核都是放射性的。這就是核穩定性的對稱規則。
可見核素分布在一條很窄的帶上。在輕核部分,中子數與質子數相等或非常接近,當Z>20,即從鈣以後,N>Z,窄帶明顯的偏離N=Z的直線而向上發散,至Z=83,中質比為 1.52,以後就沒有穩定核素。這說明核的穩定性與中質比值有關,穩定核素的中子數和質子數有近似的對稱關係,而在穩定帶以外的核都是放射性的。這就是核穩定性的對稱規則。 核素的穩定性還與核子數的偶奇性有密切聯繫。Z為偶數的元素比Z為奇數的元素有多得多的穩定同位素,而且偶Z和偶N的占大多數。事實上,奇Z的元素最多只有兩個穩定同位素,而且它們幾乎常是偶N的。對Z為偶數的元素,除元素鈹(Z=4)外,至少有2個穩定同位素,最多如元素錫,達到10個穩定同位素,而其中偶Z和奇N的核除錫有三個外,一般只有一個或兩個穩定同位素。這就是核穩定性的偶-奇規則,也即奧多-哈金斯規則。
組成 元素的同位素組成常用同位素豐度表示,同位素豐度是指一種元素的同位素混合物中,某特定同位素的原子數與該元素的總原子數之比。在天然物質中,甚至從地球外來的像隕石之類的物質中,大多數元素,特別是較重元素的同位素組成具有明顯的恆定性。但由於在自然條件下進行的多種物理、化學和生物等作用,對於同位素,特別是輕元素的同位素起著不斷的分離作用;另外,放射性衰變或誘發核反應,使某些元素的同位素還在繼續產生或消滅。因而,隨樣品來源環境的變遷,使元素的同位素組成又在某一範圍內漲落。一般,水中氫的氘含量,雪水的較小,河水比海水的低,而內陸鹽湖、油田水及死海水等則比海水的要高。大氣中氧的氧18含量比地表淡水中的高。甚至像硫那樣稍重的元素中,硫34與硫32比值的變化也高至 7%。又如元素鉛的穩定同位素中,鉛206、鉛207和鉛208分別產生於鈾、錒和釷三個放射性衰變系,所以鈾礦中鉛的相對質量(206.1)不同於釷礦中鉛的相對質量(207.8)。氦同位素組成的變化也是很大的,大氣中的氦3與氦4的相對含量比天然氣中大一個數量級或更多,這是由於前者是核反應的產物。
在Z小於28的元素中,往往有一種同位素在豐度上占絕對優勢,而其餘同位素豐度很低。在Z為28以後,同位素的豐度趨向均勻。Z為偶數的元素中,豐度最大的同位素是偶N的,最輕和最重的穩定同位素也是偶N的,且偶N的同位素豐度總和占70%以上,而奇N的同位素豐度總和卻不超過30%。
絕對豐度是指地球上各元素或核素存在的數量比,也稱元素豐度,對宇宙而言叫宇宙豐度(實際是指人們觀測到的那部分宇宙);一般定矽的豐度為 106 作基準,後來改用以氫的豐度為 1012 作基準。元素或核素的絕對豐度對Z或A的曲線叫分布曲線,如圖2所示。
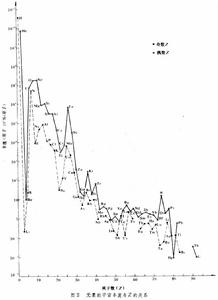 由圖可見,元素的豐度隨Z的增長而急劇下降, 從Z=1至Z=50,下降近10個數量級;而對於Z 較高的元素,下降較緩慢,最多為3個數量級。還可看出,Z為偶數的元素豐度普遍大於Z為奇數的元素豐度,地球和隕石物質 90%以上是由Z為偶數的元素構成。另外,從同位素在地殼中分布的數據可知,分布最廣的穩定同位素是偶Z和偶N的同位素。在研究核穩定性和核素分布情況時還發現,中子或質子數為2、8、20、28、50、82和 126等的原子核具有特殊的穩定性和較大的豐度,這些數值叫做幻數,元素豐度圖上的高峰處一般就為幻數核。
由圖可見,元素的豐度隨Z的增長而急劇下降, 從Z=1至Z=50,下降近10個數量級;而對於Z 較高的元素,下降較緩慢,最多為3個數量級。還可看出,Z為偶數的元素豐度普遍大於Z為奇數的元素豐度,地球和隕石物質 90%以上是由Z為偶數的元素構成。另外,從同位素在地殼中分布的數據可知,分布最廣的穩定同位素是偶Z和偶N的同位素。在研究核穩定性和核素分布情況時還發現,中子或質子數為2、8、20、28、50、82和 126等的原子核具有特殊的穩定性和較大的豐度,這些數值叫做幻數,元素豐度圖上的高峰處一般就為幻數核。 研究元素的同位素組成有很大的理論意義,元素的同位素組成是極為穩定的,對原子核原始形成過程的研究,這是個罕有的定量證據。
分析方法 同位素分析通常是指樣品中被研究元素的同位素比例的測定。它是同位素分離、同位素套用和研究中不可缺少的組成部分。
質譜法 是穩定同位素分析中最通用、最精確的方法。它是先使樣品中的分子或原子電離,形成各同位素的相似離子,然後在電場、磁場的作用下,使不同質量與電荷之比的離子流分開進行檢測。若用照相底板攝像檢測,則稱質譜儀。將離子流收集在法拉第杯電極上,並用靜電計測量電流,以能使儀器自動連續地接收不同荷質比的離子,這樣的儀器稱為質譜計。這兩種儀器不僅能用於氣體,也可用於固體的研究。質譜計能用於幾乎所有元素的穩定同位素分析。(見質譜法)
隨著高分辨質譜計的發展,可以根據質量的測定來確定被分析樣品(如標記化合物)的化學式,從而進行物質成分和結構的分析。如在樣品引入部分加上氣相色譜裝置,組成色譜-質譜聯用儀,更可直接分析複雜的混合物樣品。
核磁共振法 是穩定同位素分析的另一重要方法。由於構成有機體主要元素的穩定同位素氘、碳13、氮 15、氧17和硫33等的核自鏇量子數均不為零,在外磁場的作用下,這些原子核都會象陀螺一樣進動,若此時在磁場垂直方向加上一個射頻電場,當其頻率與這些原子核進動 頻率相同時,即出現共振吸收現象,核自鏇取向改變,產生從低能級到高能級的躍遷;當再回到低能級時就放出一定的能量,使核磁共振能譜上出現峰值,此峰的位置是表征原子核種類的。磁場強度恆定時,根椐共振時的射頻電場頻率,可以檢出有機體樣品中不同基團上的同位素,根據峰高,還可測定含量,但由於其測定靈敏度較低,一般不作定量分析用。核磁共振分析與同位素示蹤技術相結合,在化學、生物學、醫藥學等領域已成為很有用的工具。(見核磁共振譜)
光譜法 利用紅外振動光譜中同位素取代引起的譜線位移,可測定氫化合物中的氘含量。原子吸收、發射光譜等可用於氮等同位素分析,甚至可作鈾235濃度的中等精度測定。但對質量數較大的同位素,由於其位移值較小,套用受到一定限制。(見紅外光譜、原子發射光譜法、原子吸收光譜法)
氣相色譜法 可用於氫、氮、氧等的同位素分析,是一種簡單、易行的分析方法。(見氣相色譜法)
密度法 一般用於水中氘的同位素分析,其中有比重瓶法、落滴法、浮沉子法等。用這些方法測得的是總密度變化,如果水中的氧18含量不同於天然含量,則必須藉助質譜法測得其氧18的真實含量,並換算成密度增值,從水的總密度中扣除。
中子活化分析 也是一種穩定同位素的有效分析方法(見中子活化分析)。
分離和套用 大多數元素是其同位素的混合物,將其彼此分離(或部分分離)是一種特殊的精密分離──同位素分離。其中氘、鋰 6是重要的核燃料。各種純的穩定同位素成為核物理學和核化學研究的材料。氫、氮、碳、氧、硫等輕元素的穩定同位素則廣泛作為示蹤原子,用於研究化學和生物化學的各種過程和機理,以及分子的微觀結構與性質的關係等重要問題。
參考書目
郭正誼編著:《穩定同位素化學》(無機化學叢書,第17卷),科學出版社,北京,1984。
