定義
相對原子質量是指以一個碳-12原子質量的1/12作為標準,任何一種原子的平均原子質量跟一個碳-12原子質量的1/12的比值,稱為該原子的相對原子質量。原子量為質量單位,符號u,它定義為碳12原子質量的1/12。
發展
 相對原子質量
相對原子質量1803年,道爾頓用氫的原子量為1作為相對原子量的基準。
1826年,永斯·貝采利烏斯改為氧原子量的1/100為基準;1860年,J.-S.斯塔建議用氧原子量的1/16為基準,沿用了很長時間。
1929年,W.F.吉奧克和H.L.江斯登發現天然氧中存在著O、O、O三種同位素,它們在自然界的分布不完全均勻,因此用天然氧作為原子量基準就欠妥。後來物理學界改用O的1/16作為原子量基準,化學界還沿用原來的基準,從此原子量出現兩種標度,1940年國際原子量委員會確定以1.000275作為兩種標度的換算因子:物理原子量=1.000275×化學原子量。存在兩種標度必然經常引起混亂。
1959年,在慕尼黑召開的國際純粹暨套用物理學聯合會(InternationalUnionofPureandAppliedPhysics,簡稱IUPAP)上,德國J.H.馬陶赫建議C=12.0000作為原子量基準,並提交國際純粹與套用化學聯合會考慮,後者於1960年接受這一建議。1961年,在蒙特婁召開的國際純粹與套用化學聯合會上,正式通過這一新基準。1979年,由國際相對原子質量委員會提出原子量的定義。
特點
當我們計算一個水分子質量是多少時,就會發現計算起來極不方便。若是計算其它更複雜的分子質量時那就更麻煩了。因此國際上規定採用相對原子質量和相對分子質量來表示原子、分子的質量關係。相對分子質量在數值上等於摩爾質量,但單位不同。相對分子質量的單位是“1”,而摩爾質量的單位是g/mol。
國際規定
把一個碳-12原子的質量分為12等份,(碳原子有好幾種,其中有一種碳原子它的原子核中含6個質子和6箇中子,加起來是12,所以把它稱為碳-12。當然還有其它如碳-14等,它含有8箇中子和6個質子加起為14。國際上之所以要選用碳-12而不用碳-14是因為當選用碳-12原子作標準時,其它原子的相對原子質量都接近整數,便於記憶與使用)。那每一份的質量就是:一個原子的質量/(1/12×一個碳-12原子的質量)=一個原子的質量/1.667e⁻²⁷kg。
計算方法
(1.993e⁻²⁶)/12=1.667e⁻²⁷千克。然後再把其它某種原子的實際質量與這個數相比後所得的結果,這個結果的數值就叫做這種原子的相對原子質量。如氧原子的相對原子質量求法為:(2.657e⁻²⁶)/(1.667e⁻²⁷)=16(約),即氧原子的相對原子質量約為16,我們在計算時就採用16。這樣就要簡便得多。
其它原子的相對原子質量也是按相同的方法計算的。
相對原子質量的國際基本單位是1。
相對原子質量的概念是以一種碳原子(原子核內有6個質子和6箇中子的一種碳原子即C-12)的質量的1/12(約1.667e⁻²⁷kg)作為標準,其它原子的質量跟它的比值,就是這種原子的相對原子質量。
該原子一個原子的實際質量(kg)=該原子的相對原子質量x一個碳-12原子實際質量的1/12(kg)ne。
1mol物質的質量叫做該物質的摩爾質量,單位一般為g/mol。
一種原子(分子,離子)的摩爾質量在數值上等於其相對原子質量(式量),但請注意:只有當該原子、分子、離子的摩爾質量的單位為g/mol時,才符合本規律。
公式
由“原子的質量主要集中在原子核上”
可以得到計算相對原子質量的推導公式:
相對原子質量
=某種原子的質量/一種碳原子質量的(1/12)
=原子核質量+核外電子質量/[(1/12]mC
≈原子核質量/(1/12)mC
=質子的質量+中子的質量/(1/12)mC
=[質子數*一個質子的質量+中子數*一個中子的質量]/(1/12)mC
=[質子數*(1/12)mc+中子數*(1/12)mC]/(1/12)mC
=質子數+中子數
注釋:
①:質量
②:碳原子元素符號
③:質子和中子的質量大約相等,且質子的質量大約為碳原子質量的1/12,故得出此公式.
相對原子質量≈質子數+中子數(不能作為計算公式)。
相似算法
相對原子質量≈質子數+中子數(不可作為公式)
質量概念
2011年國際標準相對原子質量| 原子序數 | 元素名稱 | 化學符號 | 相對原子質量 | 註腳腳註 |
|---|---|---|---|---|
| 1 | hydrogen 氫 | H | [1.007 84; 1.008 11] | m |
| 2 | helium 氦 | He | 4.002 602(2) | g r |
| 3 | lithium 鋰 | Li | [6.938; 6.997] | m |
| 4 | beryllium 鈹 | Be | 9.012 182(3) | |
| 5 | boron 硼 | B | [10.806; 10.821] | m |
| 6 | carbon 碳 | C | [12.0096; 12.0116] | |
| 7 | nitrogen 氮 | N | [14.006 43; 14.007 28] | |
| 8 | oxygen氧 | O | [15.999 03; 15.999 77] | |
| 9 | fluorine氟 | F | 18.998 4032(5) | |
| 10 | neon氖 | Ne | 20.1797(6) | g m |
| 11 | sodium 鈉 | Na | 22.989 769 28 (2) | |
| 12 | magnesium鎂 | Mg | 24.3050(6) | |
| 13 | aluminium (aluminum) 鋁 | Al | 26.981 538 6 (8) | |
| 14 | silicon矽 | Si | [28.084; 28.086] | |
| 15 | phosphorus磷 | P | 30.973 762(2) | |
| 16 | sulfur硫 | S | [32.059; 32.076] | |
| 17 | chlorine氯 | Cl | [35.446; 35.457] | m |
| 18 | argon氬 | Ar | 39.948(1) | g r |
| 19 | potassium 鉀 | K | 39.0983(1) | |
| 20 | calcium 鈣 | Ca | 40.078(4) | g |
| 21 | scandium 鈧 | Sc | 44.955 912(6) | |
| 22 | titanium 鈦 | Ti | 47.867(1) | |
| 23 | vanadium釩 | V | 50.9415(1) | |
| 24 | chromium 鉻 | Cr | 51.9961(6) | |
| 25 | manganese 錳 | Mn | 54.938 045(5) | |
| 26 | iron鐵 | Fe | 55.845(2) | |
| 27 | cobalt 鈷 | Co | 58.933 195(5) | |
| 28 | nickel鎳 | Ni | 58.6934(4) | r |
| 29 | copper 銅 | Cu | 63.546(3) | r |
| 30 | zinc 鋅 | Zn | 65.38(2) | r |
| 31 | gallium鎵 | Ga | 69.723(1) | |
| 32 | germanium鍺 | Ge | 72.63(1) | |
| 33 | arsenic砷 | As | 74.921 60(2) | |
| 34 | selenium 硒 | Se | 78.96(3) | r |
| 35 | bromine 溴 | Br | 79.904(1) | |
| 36 | krypton氪 | Kr | 83.798(2) | g m |
| 37 | rubidium銣 | Rb | 85.4678(3) | g |
| 38 | strontium鍶 | Sr | 87.62(1) | g r |
| 39 | yttrium釔 | Y | 88.905 85(2) | |
| 40 | zirconium鋯 | Zr | 91.224(2) | g |
| 41 | niobium鈮 | Nb | 92.906 38(2) | |
| 42 | molybdenum鉬 | Mo | 95.96(2) | g |
| 43 | technetium*鎝 | Tc | ||
| 44 | ruthenium 釕 | Ru | 101.07(2) | g |
| 45 | rhodium銠 | Rh | 102.905 50(2) | |
| 46 | palladium鈀 | Pd | 106.42(1) | g |
| 47 | silver 銀 | Ag | 107.8682(2) | g |
| 48 | cadmium鎘 | Cd | 112.411(8) | g |
| 49 | indium銦 | In | 114.818(3) | |
| 50 | tin錫 | Sn | 118.710(7) | g |
| 51 | antimony 銻 | Sb | 121.760(1) | g |
| 52 | tellurium碲 | Te | 127.60(3) | g |
| 53 | iodine 碘 | I | 126.904 47(3) | |
| 54 | xenon氙 | Xe | 131.293(6) | g m |
| 55 | caesium (Cesium)銫 | Cs | 132.905 451 9 (2) | |
| 56 | barium 鋇 | Ba | 137.327(7) | |
| 57 | lanthanum鑭 | La | 138.905 47(7) | g |
| 58 | cerium鈰 | Ce | 140.116(1) | g |
| 59 | praseodymium鐠 | Pr | 140.907 65(2) | |
| 60 | neodymium釹 | Nd | 144.242(3) | g |
| 61 | promethium*鉕 | Pm | ||
| 62 | samarium釤 | Sm | 150.36(2) | g |
| 63 | europium銪 | Eu | 151.964(1) | g |
| 64 | gadolinium釓 | Gd | 157.25(3) | g |
| 65 | terbium鋱 | Tb | 158.925 35(2) | |
| 66 | dysprosium 鏑 | Dy | 162.500(1) | g |
| 67 | holmium鈥 | Ho | 164.930 32(2) | |
| 68 | erbium 鉺 | Er | 167.259(3) | g |
| 69 | thulium 銩 | Tm | 168.934 21(2) | |
| 70 | ytterbium鐿 | Yb | 173.054(5) | g |
| 71 | lutetium鑥 | Lu | 174.9668(1) | g |
| 72 | hafnium鉿 | Hf | 178.49(2) | |
| 73 | tantalum 鉭 | Ta | 180.947 88(2) | |
| 74 | tungsten 鎢 | W | 183.84(1) | |
| 75 | rhenium錸 | Re | 186.207(1) | |
| 76 | osmium鋨 | Os | 190.23(3) | g |
| 77 | iridium 銥 | Ir | 192.217(3) | |
| 78 | platinum鉑 | Pt | 195.084(9) | |
| 79 | gold 金 | Au | 196.966 569(4) | |
| 80 | mercury 汞 | Hg | 200.59(2) | |
| 81 | thallium 鉈 | Tl | [204.382; 204.385] | |
| 82 | lead鉛 | Pb | 207.2(1) | g r |
| 83 | bismuth鉍 | Bi | 208.980 40(1) | |
| 84 | polonium*釙 | Po | ||
| 85 | astatine*砹 | At | ||
| 86 | radon*氡 | Rn | ||
| 87 | francium*鍅 | Fr | ||
| 88 | radium*鐳 | Ra | ||
| 89 | actinium*錒 | Ac | ||
| 90 | thorium*釷 | Th | 232.038 06(2) | g |
| 91 | protactinium*鏷 | Pa | 231.035 88(2) | |
| 92 | uranium*鈾 | U | 238.028 91(3) | g m |
| 93 | neptunium*鎿 | Np | ||
| 94 | plutonium*鈽 | Pu | ||
| 95 | americium* 鎇 | Am | ||
| 96 | curium* 鋦 | Cm | ||
| 97 | berkelium*錇 | Bk | ||
| 98 | californium* 鐦 | Cf | ||
| 99 | einsteinium*鑀 | Es | ||
| 100 | fermium*鐨 | Fm | ||
| 101 | mendelevium*鍆 | Md | 202 | |
| 102 | nobelium*鍩 | No | ||
| 103 | lawrencium*鐒 | Lr | ||
| 104 | rutherfordium*鑪 | Rf | ||
| 105 | dubnium*釒杜 | Db | ||
| 106 | seaborgium*釒喜 | Sg | ||
| 107 | bohrium*釒波 | Bh | ||
| 108 | hassium*釒黑 | Hs | ||
| 109 | meitnerium*釒麥 | Mt | ||
| 110 | darmstadtium*鐽 | Ds | ||
| 111 | roentgenium*錀 | Rg | ||
| 112 | copernicium*鎶 | Cn | ||
| 113 | ununtrium* | Uut | ||
| 114 | Flerovium*鈇 | Fl | ||
| 115 | ununpentium* | Uup | ||
| 116 | Livermorium*鉝 | Lv | ||
| 118 | ununoctium* | Uuo |
以下是翻譯為中文的上表附註:
*這些是沒有穩定同位素的元素.一個或多個已知同位素已列在“參考資料”中的“Table3”中,並給出了合適的相對原子質量和半衰期。然而,三個元素(釷、鏷、鈾)有確定的特徵性地表同位素成分,所以這些元素的原子量也被列入上表。
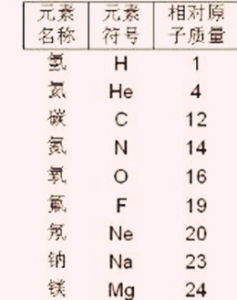
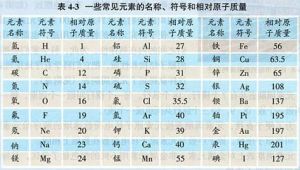
常用原子量
通常國中和高中所用到的都是整數或最多一位小數點附下表:| 核電荷數 | 元素名稱 | 元素符號 | 相對原子質量 |
|---|---|---|---|
| 1 | 氫 | H | 1 |
| 2 | 氦 | He | 4 |
| 6 | 碳 | C | 12 |
| 7 | 氮 | N | 14 |
| 8 | 氧 | O | 16 |
| 9 | 氟 | F | 19 |
| 10 | 氖 | Ne | 20 |
| 11 | 鈉 | Na | 23 |
| 12 | 鎂 | Mg | 24 |
| 13 | 鋁 | Al | 27 |
| 14 | 矽 | Si | 28 |
| 15 | 磷 | P | 31 |
| 16 | 硫 | S | 32 |
| 17 | 氯 | Cl | 35.5( 只能寫成35.5) |
| 18 | 氬 | Ar | 40 |
| 19 | 鉀 | K | 39 |
| 20 | 鈣 | Ca | 40 |
| 25 | 錳 | Mn | 55 |
| 26 | 鐵 | Fe | 56 |
| 29 | 銅 | Cu | 63.5( 可寫64或63.5) |
| 30 | 鋅 | Zn | 65 |
| 47 | 銀 | Ag | 108 |
| 53 | 碘 | I | 127 |
| 56 | 鋇 | Ba | 137 |
| 78 | 鉑 | Pt | 195 |
| 79 | 金 | Au | 197 |
| 80 | 汞 | Hg | 201 |