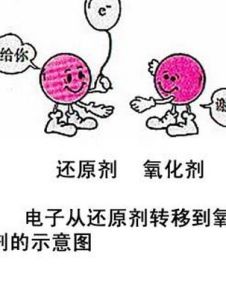
基本概念
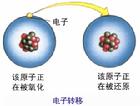 電子轉移
電子轉移名稱來源
氧化反應最早是指金屬或非金屬與氧結合形成氧化物的反應,這類反應中另一種元素的化合價總是升高。還原反應最早是指金屬從其化合物中被提煉出來的反應,這類反應中金屬的化合價總是降低。理論發展
 電子-模型圖
電子-模型圖 註:
氧化數又可以叫做氧化態
氧化數即高中所說的化合價,這兩者僅是叫法不同,部分表示方法有差別,其他並無區別,本詞條中視為可以混用。
反應本質
氧化還原反應的本質是電子有轉移,電子轉移是微觀的,巨觀表現是化合價(即氧化數)的變化。氧化數升高,即失電子的半反應是氧化反應,發生此反應的物質是還原劑;氧化數降低,得電子的反應是還原反應,發生此反應的物質是氧化劑。還原劑具有還原性,氧化劑具有氧化性。還原劑被氧化劑氧化後生成的物質叫氧化產物,氧化劑被還原劑還原後生成的物質叫還原產物。即: 還原劑 + 氧化劑 ---> 氧化產物 + 還原產物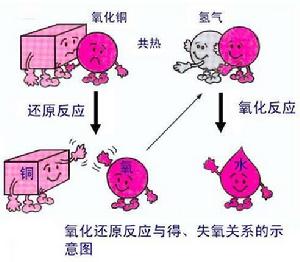 得失氧關係示意圖
得失氧關係示意圖一般來說,同一反應中還原產物的還原性比還原劑弱,氧化產物的氧化性比氧化劑弱,這就是所謂“強還原劑制弱還原劑,強氧化劑制弱氧化劑”。
五條基本規律
一、守恆律化合價有升必有降,電子有得必有失,對於一個完整的氧化還原反應,化合價升高總數與降低總數相等,失電子總數與得電子總數相等。 從還原劑轉移到氧化劑示意圖
從還原劑轉移到氧化劑示意圖二、強弱律較強氧化性的氧化劑和較強還原性的還原劑反應,生成弱還原性的還原產物和弱氧化性氧化產物。套用:在適宜的條件下,用氧化性較強的物質製備氧化性較弱的物質,或用還原性較強的物質製備還原性較弱的物質,亦可用於比較物質的氧化性或還原性的強弱。
三、先後律一種氧化劑(或還原劑)同時和多種還原劑(或氧化劑)相遇時,總是依還原性(或氧化性)強弱順序先後去氧化還原劑(或去還原氧化劑)。
四、價態律:元素處於最高價,只有氧化性(如Fe3+);元素處於最低價,只有還原性(如S2-、I-等);元素處於中間價態,既有氧化性又還有性,但主要呈現一種性質(如Fe2+以還原性為主)。物質若含有多種元素,其性質是這些元素性質的綜合體現。套用:判斷物質的氧化性或還原性。
五、轉化律:氧化還原反應中,以元素相鄰價態之間的轉化最容易;同種元素不相鄰價態之間若發生反應,元素的化合價只相靠不交叉;同種元素,相鄰價態之間不發生氧化還原反應。套用:分析判斷氧化還原反應能否發生及表明電子轉移情況。
反應實驗
實驗目的
1. 了解原電池的裝置以及濃度對電極電勢的影響(Nernst方程式)。
2.熟悉常用氧化劑和還原劑的反應。
3.了解濃度、酸度對氧化還原反應的影響。
實驗內容
(一)原電池電動勢的測定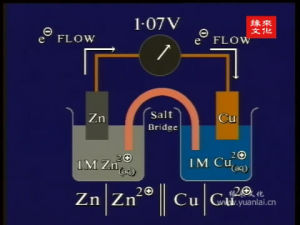 實驗示意圖
實驗示意圖負極(氧化反應) Zn-2e = Zn2+ 正極(還原反應) Cu2+ + 2e = Cu
電池反應 Zn + Cu2+ = Cu + Zn2+
(二)比較電極電勢的高低
1、2Fe3+ + 2I- = I2 + 2Fe2+
生成的I2可用澱粉(1%)檢驗或者用CCl4萃取,CCl4層呈紫紅色(I2在CCl4中的溶解度大於在水中的溶解度)
2、Fe3+ + 2Br-無反應
3、2Fe2+ + Br2 = 2Fe3+ +2Br-
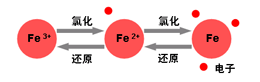
Fe3+ + n SCN- = [Fe(NCS)n]3-n 血紅色
根據實驗結果可知Br2是最強的氧化劑,I-是最強的還原劑, φ(Br2/ Br-) >φ(Fe3+/ Fe2+) > φ(I2/ I-)
(三)常見氧化劑和還原劑的反應
1、H2O2的氧化性 H2O2 + 2H+ + 2I- = I2 + 2H2O
2、KMnO4 的氧化性 2MnO4- + 6H+ + H2O2 = 2Mn2+ + 3O2 +4H2O
3、H2S的還原性 2Fe3+ + H2S = 2Fe2+ + S + 2H+
(H2S來源於硫代乙醯胺的水解,見P96下)
4、KI的還原性 Cl2 + 2I- = 2Cl- + I2
I2 + 5Cl2 + 6H2O = 2HIO3 + 10HCl
影響氧化還原反應的因素
1、濃度對氧化還原反應的影響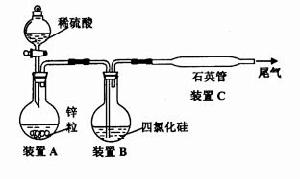 實驗示意圖
實驗示意圖4HNO3(濃) + Zn = Zn(NO3)2 + 2NO2 + H2O
10HNO3+ 4Zn = 4Zn(NO3)2 +NH4 NO3 + 3H2O
氣室法檢驗NH4+ :NH4+ + OH- = NH3 + H2O 酚酞試紙顯紅色
注意1:不同濃度的硝酸與Zn作用的反應產物和反應速率有何不同?
注意2:NH4+ 的檢驗方法
氣室法:用兩塊乾燥、潔淨的表面皿(一大一小),在大的一塊表面皿中心放3滴6molL-1的NaOH溶液,混合均勻。在小的一塊表面皿中心粘附一小條潤濕的酚酞試紙,蓋在大的表面皿上形成氣室。將此氣室放在水浴上微熱2min,酚酞試紙變紅,表示存在NH4+。
Nessler試劑:用Nessler試劑(K2[HgI4]的KOH溶液),現象:從紅棕色到深褐色的沉澱。
干擾:如果試液中含有Fe3+、Co2+ 、Ni2+、Cr3+、Ag+、S2-等,會干擾NH4+的鑑定。
清除干擾的方法:可在試液中加鹼,使逸出的氨與滴在濾紙條上的Nessler試劑反應,觀察現象。
2、介質對氧化還原反應的影響
(1) 介質對氧化還原反應方向的影響
IO3- + 6H+ + 5I- = 3I2 + 3H2O
3I2 + 6OH- = 5I- + IO3- + 3H2O
(2)介質對氧化還原反應產物的影響
H2SO4介質紫紅色褪去2KMnO4 + 3H2SO4 +5Na2SO3 = 2MnSO4 + K2SO4 +5 Na2SO4+3H2O
 示意圖
示意圖NaOH 介質綠色 2KMnO4 + 2NaOH + Na2SO3 = 2Na2MnO4 + K2SO4 + H2O
表示方法
雙線橋法
用於表明反應前後同一元素原子間的電子轉移情況標出各發生氧化還原反應的元素的氧化數。
畫出如右圖所示的線,其中一條由氧化劑中氧化數降低的元素指向還原產物中的相應元素,另一條線由還原劑中氧化數升高的元素指向氧化產物中的相應元素。
標出“失去”或“得到”的電子數,格式為“得/失發生氧化還原反應的原子數×單位原子得失的電子數"。
單線橋法
用於表明反應前後不同元素原子間的電子轉移情況標出各發生氧化還原反應的元素的氧化數。
用一條如右圖所示的線連線方程式左邊的氧化劑與還原劑,箭頭由失電子的還原劑指向得電子的氧化劑
標出電子轉移的數量,格式為“發生氧化還原反應的原子數×單位原子轉移的電子數"。
氧化-還原半反應式
為了將氧化還原反應與電子得失相聯繫起來,並簡化研究,可以將氧化還原反應拆成兩個半反應。於是所有氧化還原反應便可以表述為兩個半反應的加和[5]。例如有半反應:。
將所有半反應根據統一規定來改寫,便成為氧化-還原半反應式,其書寫有以下要求:
反應式的左邊總是氧化型物質(元素的氧化數高的物質),右邊總是還原型物質(元素的氧化數低的物質)。反應中的得失電子數在反應式左邊寫出,用+/e-表示;
半反應式必須配平;
在溶液中,物質須寫成在此溶劑中的主要存在形態,例如水中,強酸需要寫成酸根的形式;
反應式中有且僅有一種元素的氧化數可以發生改變。
半反應式從左到右,是氧化劑得到電子,生成其共軛還原劑的過程,即還原反應;從右到左,是還原劑得到電子,生成其共軛氧化劑的過程,即氧化反應。半反應中的氧化型物質與還原型物質互稱共軛氧化劑/還原劑,這種反應關係則被稱為氧化還原共軛關係。通常可以使用氧化還原反應電對來表示一組共軛的氧化還原劑,例如MnO4-/Mn2+,其左邊為氧化型物質,右邊為還原型物質。
半反應式中,氧化數未發生改變的元素被稱作非氧化還原組分,酸鹼組分、沉澱劑、絡合劑等一般都屬於這一範疇。
舉例
燃燒
燃燒是物質迅速氧化,產生大量光和熱的過程,其本質是一種劇烈的氧化還原反應。酒精測試
K2Cr2O7是一種橙紅色具有強氧化性的化合物,當它在酸性條件下被還原成三價鉻時,顏色變為綠色。據此,當交警發現汽車行駛不正常時,就可上前阻攔,並讓司機對填充了吸附有K2Cr2O7的矽膠顆粒的裝置吹氣。若發現矽膠變色達到一定程度,即可證明司機是酒後駕車。這時酒精被氧化為醋酸:工業煉鐵
這個反應中,Fe2O3中的鐵由Fe(III)變為Fe(0)(氧化數降低,為氧化劑),而CO中的碳由C(II)變為C(IV)(氧化數升高,為還原劑)。複分解反應
大多數無機複分解反應都不是氧化還原反應,因為這些復分解反應中的離子互相交換,不存在電子的轉移,各元素的氧化數沒有變化。基本操作
1. 原電池的組裝與測試(正負極勿連錯)2. NH4+ 的檢驗方法
注意事項
1、KMnO4 + NaOH + Na2SO3實驗時,Na2SO3用量不可過多,否則,多餘的Na2SO3會與產物Na2 MnO4 生成MnO2;2、廢液倒入廢液桶中;
3、涉及濃硝酸,濃鹽酸,溴水、氯水等刺激性操作應在通風櫥內操作;
4.安全
氧化還原方程式的配平
電子守恆法
1、配平原理發生氧化還原反應時,還原劑失去電子、氧化劑得到電子。因為整個過程的本質好比是還原劑把電子給了氧化劑,在這一失一得之間,電子守恆。故根據還原劑失去電子的數目和氧化劑得到電子的數目相等,結合二者化合價的改變情況,可以分別把氧化劑、還原劑的計量數計算出來,這樣整個氧化還原反應就順利配平了。
2、方法和步驟①標出發生變化的元素的化合價,並確定氧化還原反應的配平方向。
在配平時,需要確定先寫方程式那邊物質的計量數。有時先寫出方程式左邊反應物的計量數,有時先寫出方程式右邊生成物的計量數。一般遵循這樣的原則:
自身氧化還原反應→ 先配平生成物的計量數;
部分氧化還原反應 → 先配平生成物的計量數;
一般的氧化還原反應→既可先配平生成物的計量數,也可先配平反應物的計量數。
②列出化合價升降的變化情況。當升高或降低的元素不止一種時,需要根據不同元素的原子個數比,將化合價變化的數值進行疊加。
③根據電子守恆配平化合價變化的物質的計量數。
④根據質量守恆配平剩餘物質的計量數。最終並根據質量守恆檢查配平無誤。
待定係數法
1、配平原理質量守恆定律告訴我們,在發生化學反應時,反應體系的各個物質的每一種元素的原子在反應前後個數相等。通過設出未知數(如x、y、z等均大於零)把所有物質的計量數配平,再根據每一種元素的原子個數前後相等列出方程式,解方程式(組)。計量數有相同的未知數,可以通過約分約掉。
2、方法和步驟
對於氧化還原反應,先把元素化合價變化較多的物質的計量數用未知數表示出來,再利用質量守恆吧其他物質的計量數也配平出來,最終每一個物質的計量數都配平出來後,根據某些元素的守恆,列方程解答。
與電化學的關係
每一個氧化還原反應都可以做成一個原電池。其中發生氧化反應的一極為陽極,即外電路的負極;還原反應的一極為陰極,即外電路的正極。兩個電極之間有電勢差(電化學上通常叫電動勢),因此反應可以進行,同時可以用來做功。
規律
氧化還原反應中,存在以下一般規律:強弱律:氧化性:氧化劑>氧化產物;還原性:還原劑>還原產物。
價態律:元素處於最高價態,只具有氧化性;元素處於最低價態,只具有還原性;處於中間價態,既具氧化性,又具有還原性。
轉化律:同種元素不同價態間發生歸中反應時,元素的氧化數隻接近而不交叉,最多達到同種價態。
優先律:對於同一氧化劑,當存在多種還原劑時,通常先和還原性最強的還原劑反應。
守恆律:氧化劑得到電子的數目等於還原劑失去電子的數目。
例題
解題方法:氧化劑得到電子化合價降低轉變為還原產物,還原劑失去電子化合價升高轉變為氧化產物。在同一個氧化還原反應中得失電子數相等,即化合價升高總價數等於化合價降低總價數。【例題1】(NH4)2SO4在強熱條件下分解,生成NH3、SO2、N2、H2O,反應中生成的氧化產物和還原產物的物質的量之比為
A.1:3B.2:3C.1:1D.4:3
解析:(NH4)2SO4在強熱條件下分解,氧化產物為N2,還原產物為SO2,依據化合價升降相等原則有3×2↑×x=2↓×y,故有x:y=1:3
答案:A
【例題2】R2O8n-在一定條件下可把Mn2+氧化為MnO4-,若反應中R2O8n-變為RO42-,又知反應中氧化劑與還原劑物質的量之比為5:2,則n值為:
A.4B.3C.2D.1
解析:依題意有5R2O8n-+2Mn2+===2MnO4-+10RO42-,設R2O8n-中R的化合價為x,依據化合價升降相等原則有
5×2×↓(x-6)=2×↑(7-2),解得x=7,因此有
2×7+8×(-2)=-n,解得n=2.
答案:C
【例題3】(NH4)2PtCl6在強熱條件下分解,生成N2、HCl、NH4Cl、Pt反應中氧化產物與還原產物的物質的量之比為
A.1:2B.1:3C.2:3D.3:2
解析:(NH4)2PtCl6在強熱條件下分解,氧化產物為N2,還原產物為Pt,依據化合價升降相等原則有3×2↑×x=4↓×y,故有x:y=2:3
答案:C
【例題4】Cl2與NaOH(70℃)的溶液中,能同時發生兩個自身氧化還原反應,完全反應後,測得溶液中NaClO、NaClO3之比4:1,則溶液中NaCl和NaClO的物質的量之比為
A.11:2B.1:1C.9:4D.5:1
解析:Cl2中氯元素的化合價為0價,而在NaClO、NaClO3中氯元素的化合價分別為+1、+5價,設NaCl和NaClO的物質的量分別為x和y,依據化合價升降相等原則有1↓×x=1↑×y+5↑××y,故有x:y=9:4
答案:C
【例題5】含n克HNO3的稀溶液恰好與m克Fe完全反應,若HNO3隻被還原為NO,則n:m可能是①5:1、②9:2、③3:1、④2:1、⑤4:1
A.②③⑤ B.①③④ C.②③④ D.①③ 解析:當Fe恰好完全轉變為+2價時,3Fe+8HNO3===3Fe(NO3)2+2NO↑+4H2O,有= 解得:n:m=3:1
當Fe恰好完全轉變為+3價時,Fe+4HNO3===Fe(NO3)3+NO↑+2H2O,有
= 解得:n:m=9:2
結合選項分析n:m的取值範圍在4.5至3之間。
答案:A
【例題6】Zn與HNO3反應,Zn和被還原的HNO3的物質的量之比為4:1則HNO3的還原產物可能為
A.NO2B.NOC.N2OD.NH4NO3
解析:設還原產物中氮元素的化合價為x,依據化合價升降相等原則有
4×2↑=1↓×(5-x)解得:x=-3
答案:D
【例題7】將Mg和Cu的合金2.64克,投入適量的稀HNO3中恰好反應,固體全部溶解時,收集的還原產物為NO,體積為0.896L(SPT),向反應後的溶液中加入2mol/LNaOH溶液60mL時,金屬離子恰好完全沉澱,則形成沉澱的質量為
A.4.32克 B.4.68克 C.5.36克 D.6.38克
解析:依據在同一個氧化還原反應中得失電子數相等原則,解得Mg和Cu共失去
n(e-)=×3=0.12mol,由電荷守恆知Mg和Cu共需要結合0.12molOH-,故形成沉澱的質量m=2.64g+0.12mol×17g/mol=4.68g
答案:B
【例題8】取x克Mg和Cu的合金完全溶於濃HNO3中,反應過程中HNO3被還原只產生8960mLNO2和672mLN2O4氣體(SPT),向反應後的溶液中加入足量的NaOH溶液,形成沉澱質量為17.02克,則X的值為
A.8.64克 B.9.20克C.9.00克D.9.44克 解析:依據在同一個氧化還原反應中得失電子數相等原則,解得Mg和Cu共失去
n(e-)=×1=0.46mol,由電荷守恆知Mg和Cu共需要結合0.46molOH-,因此有17.02g=x+0.46mol×17g/mol,解得x=9.20g
答案:B
【例題9】將14克Ag和Cu的合金與一定濃度的HNO3反應,全部溶解後,產生的氣體再通入1.12L(SPT)O2,恰好完全吸收,求合金中各成分的含量?
解析:Ag和Cu失去電子的總數等於O2得到電子的總數,依題意有
108n(Ag)+64n(Cu)=14
n(Ag)+2n(Cu)=×4=0.2
解得n(Ag)=0.1moln(Cu)=0.05mol
w(Ag)=×100%=77.14%
w(Cu)=1-77.14%=22.86%
答案:合金中w(Ag)為77.14%,w(Cu)為22.86%。
【例題10】將51.2gCu完全溶於適量濃硝酸中,收集到氮的氧化物(含NO、N2O4、NO2)的混合物共0.8mol,這些氣體恰好能被500mL2mol/L的NaOH溶液完全吸收,生成NaNO3和NaNO2的混合溶液,其中生成的NaNO3的物質的量為
(已知NO+NO2+2NaOH===2NaNO2+H2O,2NO2+2NaOH===NaNO3+NaNO2+H2O)
A.0.2molB.0.4molC.0.6molD.0.8mol
解析:51.2gCu即為0.8molCu,失去的電子等於NaNO2生成時得到的電子,則NaNO2為0.8mol,由Na+守恆知:n(Na+)=n(NaNO2)+n(NaNO3),得NaNO3為0.2mol。
答案:A
【練習1】9.8g鎂、鋁混合物溶解在一定量的熱濃硝酸中,當金屬完全溶解後收集到標準狀況下8.96LNO2和2.24LN2O4氣體,向反應的溶液中加入足量的氨水,則生成的沉澱有
A.18克 B.20克 C.22克 D.24克
解析:依據在同一個氧化還原反應中得失電子數相等原則,解得Mg和Al共失去
n(e-)=×1+×2=0.6mol。由電荷守恆知Mg和Al共需要結合0.6molOH-,故形成沉澱的質量m=9.8g+0.6mol×17g/mol=20g
答案:B
將11.2g的Mg和Cu的混合物完全溶解於足量的硝酸中,收集反應產生的氣體X,再向所得溶液中加入適量的NaOH溶液,產生21.4g沉澱,根據題意推斷氣體X的成分可能是
A.0.3molNO2和0.3molNOB.0.2molNO2和0.1molN2O4
C.0.1molNO、0.2molNO2和0.05molN2O4 D.0.6molNO
解析:根據Mg、Cu的變化:Mg~Mg2+~2OH-~Mg(OH)2~2e-、Cu~Cu2+~2OH-~Cu(OH)2~2e-知增加的質量為OH-的質量,轉移電子的物質的量與OH-的物質的量相等,則有n(OH-)=21.4g-11.2g/17g·mol-1=0.6mol,故反應轉移的電子的物質的量也為0.6mol。選項A轉移電子的物質的量
為0.3mol×1+0.3mol×3=1.2mol,不正確;選項B轉移電子的物質的量為0.2mol×1+0.1mol×2=0.4mol,不正確;選項C轉移電子的物質的量為0.1mol×3+0.2mol×1+0.05mol×2=0.6mol,正確;選項D轉移電子的物質的量為0.6mol×3=1.8mol,不正確.
答案:C
套用與意義
氧化還原性的強弱判定物質的氧化性是指物質得電子的能力,還原性是指物質失電子的能力。物質氧化性、還原性的強弱取決於物質得失電子的能力(與得失電子的數量無關)。
從方程式與元素性質的角度,氧化性與還原性的有無與強弱可用以下幾點判定:
(1)從元素所處的價態考慮,可初步分析物質所具備的性質(無法分析其強弱)。最高價態——只有氧化性,如H2SO4、KMnO4中的S、Mn元素;最低價態,只有還原性,如Cl-、S2-等;中間價態——既有氧化性又有還原性,如Fe、S、SO2等。
(2)根據氧化還原的方向判斷:
氧化性:氧化劑>氧化產物;還原性:還原劑>還原產物。
(3)根據反應條件判斷:
當不同的氧化劑與同一種還原劑反應時,如氧化產物中元素的價態相同,可根據反應條件的高、低進行判斷,如是否需要加熱,是否需要酸性條件,濃度大小等等。
需要注意的是,物質的氧化還原性通常與外界環境,其他物質的存在,自身濃度等緊密相關,通過以上比較僅能粗略看出氧化還原性大小。如欲準確定量地比較氧化還原性的大小,需要使用電極電勢。
現實意義
在生物學中,植物的光合作用、呼吸作用是典型的氧化還原反應。人和動物的呼吸,把葡萄糖氧化為二氧化碳和水。通過呼吸把貯藏在食物的分子內的能,轉變為存在於三磷酸腺苷(ATP)的高能磷酸鍵的化學能,這種化學能再供給人和動物進行機械運動、維持體溫、合成代謝、細胞的主動運輸等所需要的能量。
在工業生產中所需要的各種各樣的金屬,很多都是通過氧化還原反應從礦石中提煉而得到的。如生產活潑的有色金屬要用電解或置換的方法;生產黑色金屬和一些有色金屬都是用在高溫條件下還原的方法;生產貴金屬常用濕法還原,等等。許多重要化工產品的合成,如氨的合成、鹽酸的合成、接觸法制硫酸、氨氧化法制硝酸、食鹽水電解制燒鹼等等,也都有氧化還原反應的參與。石油化工里的催化去氫、催化加氫、鏈烴氧化制羧酸、環氧樹脂的合成等等也都是氧化還原反應。
在農業生產中,施入土壤的肥料的變化,如銨態氮轉化為硝態氮等,雖然需要有細菌起作用,但就其實質來說,也是氧化還原反應。土壤里鐵或錳的氧化數的變化直接影響著作物的營養,曬田和灌田主要就是為了控制土壤里的氧化還原反應的進行。
在能源方面,煤炭、石油、天然氣等燃料的燃燒供給著人們生活和生產所必需的大量的能量。我們通常套用的乾電池、蓄電池以及在空間技術上套用的高能電池都發生著氧化還原反應,否則就不可能把化學能變成電能,把電能變成化學能。
由此可見,在許多領域裡都涉及到氧化還原反應,認識氧化還原反應的實質與規律,對人類的生產和生活都是有意義的。