簡介
氧化物按照是否與水生成鹽,以及生成的鹽的類型可分為:酸性氧化物、鹼性氧化物、兩性氧化物、不成鹽氧化物、假氧化物、過氧化物、超氧化物、臭氧化物和類似氧化物九類。(另外還有很多複雜的氧化物。)氧化物屬於化合物,(當然也一定是純淨物)。其構成中只含兩種元素,其中一種一定為氧元素且顯現負價,另一種若為金屬元素,則為金屬氧化物;若為非金屬,則為非金屬氧化物。
酸性
我們知道,鹼跟酸反應生成鹽和水,鹼跟某些非金屬氧化物反應,也生成鹽和水,例如:
2NaOH+CO2=Na2CO3+H2O
Ca(OH)2+SO3=CaSO4+H2O 。
上述反應表明,二氧化碳,三氧化硫跟酸的性質相似。因此,人們把二氧化碳,三氧化硫這樣能跟鹼反應生成鹽和水的氧化物,稱為酸性氧化物。
非金屬氧化物大多數是酸性氧化物,我們熟悉的非金屬氧化物中,一氧化碳不是酸性氧化物。
與水反應
酸性氧化物大多數能跟水直接化合生成含氧酸。例如:
CO2+H2O=H2CO3
SO3+H2O=H2SO4 。
含氧酸也可以受熱分解生成酸性氧化物.例如,將硫酸加熱可得到三氧化硫和水:
H2SO4=SO3↑+H2O
在這裡三氧化硫可以看做是硫酸脫水後的生成物,因此也把酸性氧化物叫做酸酐。
與鹼反應
酸性氧化物(可以與水反應生成酸)可以與鹼發生反應。例如:SiO2+2NaOH=Na2SiO3+H2O。
鹼性
跟酸起反應,生成鹽和水的氧化物,叫做鹼性氧化物。大多數金屬氧化物是鹼性氧化物.例如氧化鈉、氧化鉀、氧化鋇……: 能跟酸起反應,生成鹽和水的氧化物叫鹼性氧化物(且生成物只能有鹽和水,不可以有任何其它物質生成, 且能與水反應生成鹼)。鹼性氧化物一般不與正鹽、鹼式鹽(如Mg(OH)Cl)反應,但可與酸式鹽(如NaHSO4)反應。鹼性氧化物包括活潑金屬氧化物和其他金屬的低價氧化物,如Na2O、CaO、BaO和CrO、MnO。鹼性氧化物的對應水化物是鹼。例如,CaO對應的水化物是Ca(OH)2,Fe2O3對應的水化物是Fe(OH)3。鹼金屬和鈣、鍶、鋇的氧化物能跟水反應,生成相應的氫氧化物。它們都是強鹼:
Na2O+H2O→2NaOH
CaO+H2O→Ca(OH)2
高溫下,鹼性氧化物和酸性氧化物作用生成鹽:
CaO+SiO2→CaSiO3
鹼性氧化物與酸性氧化物反應:
Na2O+CO2→Na2CO3
鹼性氧化物受熱時比較穩定,一般不會分解。
鹼性氧化物一定是金屬氧化物,而金屬氧化物不一定是鹼性氧化物,如Mn2O7就是酸性氧化物,Al2O3、BeO、Cr2O3、ZnO為兩性氧化物。
鹼性氧化物還可以和對應的酸式鹽反應——Na20+2NaHSO4→2Na2SO4+H2O
當然,鹼性氧化物只是從理論上可以視為對應鹼脫水後的產物,並不是所有鹼性氧化物都可以與水反應生成對應的鹼。
注意:★能與酸反應的氧化物不一定就是鹼性氧化物,如SiO2可以與HF反應,但SiO2卻是酸性氧化物(應要注意,SiO2可以與HF反應是SiO2的特性,與它是鹼性氧化物或酸性氧化物無關!)。
★鹼金屬的氧化物不一定就是鹼性氧化物,如Na2O2可以和水反應生成鹼,但它是過氧化物而不是鹼性氧化物。
兩性
因為是臨界元素,所以既有一定金屬性,也有一定非金屬性,同時能與強酸強鹼反應,故稱之為兩性,對應水化物也是兩性氫氧化物如:Al2O3 ZnO BeO
Al2O3 + 6HCl= 2AlCl3 + 3H2O
Al2O3 + 2NaOH = 2NaAlO2 + H2O
不成鹽
不能跟酸起反應生成鹽和水,又不能跟鹼起反應而生成鹽和水,這類氧化物叫做不成鹽氧化物。例如,H2O、NO、CO、N2O、N2O4、TeO、ClO2、I2O4、MnO2 屬於不成鹽氧化物。二氧化錳、二氧化氮是不成鹽氧化物,因為錳和氮的含氧酸對應這兩種元素的化合價都不是+4 。
高錳酸根對應的氧化物是七氧化二錳而不是二氧化錳。
硝酸根對應的氧化物是五氧化二氮而不是二氧化氮。
這裡需要說明的是:有些不成鹽氧化物在一定條件下是可以“成鹽”的。如CO,在工業上製備甲酸,就是利用CO和NaOH在一定條件下反應來製取的:
CO + NaOH →HCOONa
在中學階段,我們將CO劃分到不成鹽氧化物類,是因為中學化學中還沒有涉及象上述的用CO制甲酸這方面的知識。同時也提示我們:在教學中,不能將某些概念或定義講得太死,要留有一定的餘地,注意出現特殊情況。
假氧化物
假氧化物也就是說由多種氧化物混合而成的氧化物,有些元素和氧的二元化合物,從分子組成上看是氧化物,但實際並不是氧化物且結構比較複雜。我們將這類氧化物稱做假氧化物。假氧化物是那種看似像氧化物(純淨物)其實是混合物的。像Fe3O4是氧化鐵和氧化亞鐵的混合物。
過氧化物
過氧化物,是由於分子中含有過氧基或過氧離子而得其名。此外具有極弱酸性的過氧化氫與鹼作用,也可生成過氧化物。因此,過氧化物也可看作是過氧化氫的鹽。能生成過氧化物的金屬,主要是鹼金屬和鹼土金屬。超氧化物
金屬性特別活潑的鹼金屬和鹼土金屬,在一定條件下,在過量的氧氣中燃燒時,可生成比過氧化物含氧量更高的氧化物。例如NaO4等,我們稱之為超氧化物。另外,超氧化氫也屬於超氧化物。超氧化物中的超氧離子,是分子作為一個整體獲得一個電子後形成的,因此穩定性很差,是很強的氧化劑。臭氧化物
常見的臭氧化物大都是比較活潑的鹼金屬的氧化物,例如KO3、CsO3、RbO3等。它們是通過臭氧(O3)與鹼金屬氫氧化物反應製備而得其名的。鹼金屬的臭氧化物在常溫下緩慢分解,生成超氧化物與氧氣。類似
這類化合物從它們的分子組成上看符合氧化物的定義,但是氧元素在分子中的化合價分別為+2和+l價,是電子的提供者而不是獲得者,因而不稱作氧化物。為了說明符合氧化物定義而又不屬於氧化物的現象,我們稱這類化合物為類似氧化物。比如 氟氧化合物 現已知有二氟化氧(OF2)、二氟化二氧(O2F2)、二氟化三氧(O3F2)、二氟化四氧(O4F2)及二氟化五氧(O5F2)。
除二氟化氧外,其他氟氧化物均不穩定。二氟化氧是近無色或淡黃色氣體。
分類
①金屬氧化物與非金屬氧化物②離子型氧化物與共價型氧化物
離子型氧化物:部分活潑金屬元素形成的氧化物如Na2O、CaO等
共價型氧化物:部分金屬元素和所有非金屬元素的氧化物如MnO2、HgO、SO2、ClO2 等
③普通氧化物、過氧化物和超氧化物
④酸性氧化物、鹼性氧化物和兩性氧化物、不成鹽氧化物、其它複雜氧化物
1. 酸性氧化物大多數能跟水直接化合生成含氧酸。
CO2+H2O→H₂CO₃
SO2+H2O→H₂SO₃
含氧酸也可以受熱分解生成酸性氧化物.例如,將硫酸加熱可得到三氧化硫與水
2. 同時能與強酸強鹼反應,故稱之為兩性如:Al2O3 ZnO BeO
3. 不能跟酸起反應,又不能跟鹼起反應而生成鹽和水,這類氧化物叫做不成鹽氧化物。
例如,H2O、NO、CO、N2O、TeO、ClO2、I2O5、MnO2屬於不成鹽氧化物。
(1)一氧化碳能跟氫氧化鈉起反應,生成甲酸的鈉鹽。但是在生成鹽時沒有生成水,所以一氧化碳仍屬於不成鹽氧化物。
(2)二氧化錳、二氧化氮是不成鹽氧化物,因為錳和氮的含氧酸對應這兩種元素的化合價都不是+4 。
(3)高錳酸根對應的氧化物是七氧化二錳而不是二氧化錳。
(4) 硝酸根對應的氧化物是五氧化二氮而不是二氧化氮。
相互關係
(1)酸性氧化物不都是非金屬氧化物,非金屬氧化物也不都是酸性氧化物
如Mn2O7、是酸性氧化物,卻是金屬氧化物;CO、NO2、NO等都是非金屬氧化物,但不是酸性氧化物
(2)鹼性氧化物都是金屬氧化物,但金屬氧化物不一定鹼性氧化物。
如 Na2O2、Al2O3 都不是鹼性氧化物
(3)酸性氧化物都是酸酐,都含有相對應的含氧酸,但不一定都能與水反應。
如SiO2是H4SiO4 /H2SiO3的酸酐,但SiO2不與水反應
(4)離子型氧化物都是強電解質,共價型氧化物都是非電解質
常見氧化物:
氧化鋅,氧化鎂,氧化鐵,氧化鈣,氧化鉻,氧化鋁(Al2O3)。
製備
氧化物通常可以用金屬直接燃燒(直接氧氣氧化)法、還原法、熱分解法等來製備。詳見:氧化物的製備。結構分類
離子型
MO2:ThO2、CeO2、UO2、SnO2、PbO2、TiO2、VO2、MnO2、RuO2、WO2、MoO2
共價型
結構類型 | | 氧化物舉例 |
非金屬元素 | 簡單分子氧化物 | H、F、Cl、Br、I、S、Se、N、P、As、C的氧化物 |
| | 巨分子氧化物 | B、Si的氧化物 |
金屬元素 | 18電子外殼離子的氧化物 | Ag2O、Cu2O |
| | 18+2電子外殼離子的氧化物 | SnO、PbO |
| | 8電子外殼、高電荷離子的氧化物 | Mn2O7 |
物理性質
在元素的特徵氧化物中,所有短周期元素的氧化物都是白色的,而長周期中卻有一些元素的氧化物是有顏色的,例如第四周期鉀~錳特徵氧化物的顏色呈如下變化:K2O | CaO | Sc2O3 | TiO2 | V2O5 | CrO3 | Mn2O7 |
白 | 白 | 白 | 白 | 橙 | 暗紅 | 綠紫 |
這是由於各陽離子具有相同的8電子構型,但隨著正電荷的增加和半徑的減小,它們對O(2-)離子的極化作用逐漸增強了,使得激發態和基態之間的能量差越來越小,因而能夠吸收部分可見光而使集中於氧端的電子向金屬一端遷移(這種電子遷移叫做電荷躍遷),它們的吸收譜帶向長波方向移動,致使氧化物的顏色逐漸加深。在特徵氧化物中顯色的,還有第五周期的Cd、Ag、In、Sb、Te,第六周期的W、Re、Os、Hg、Tl、Pb、Bi,以及許多的鑭系元素和錒系元素的氧化物。這些過渡元素氧化物之所以顯色,有些是由於電荷躍遷引起的,有些則是由於d-d躍遷引起的,鑭系和錒系元素的氧化物中,有顏色的現象更為普遍。例如,由d-d躍遷引起的Fe、Co、Ni氧化物的顏色變化為:
FeO | CoO | NiO | | | Fe2O3 | Co2O3 | Ni2O3 |
黑 | 灰綠 | 綠 | | | 紅 | 褐 | 灰黑 |
由於大多數金屬氧化物具有無限三維離子晶格,一部分非金屬氧化物具有網狀共價結構,所以相當多的氧化物都是難熔物質,其中BeO、MgO、CaO、Al2O3、ZrO2、HfO2和ThO2以及SiO2等都是極難熔的,它們的熔點一般在1800~3300K之間,因而是優良的高溫陶瓷材料,對於那些以分子單元結構存在的氧化物,它們多半呈分子晶型,共價分子之間以較弱的van der Waals力(范德華力)相結合,因而它們的熔、沸點都比較低。其中,在常溫下呈氣態的占多數,例如CO、CO2、N2O、NO、N2O3、NO2、N2O5、SO2和ClO2等;呈液態的有Cl2O7、Mn2O7;呈固態的有RuO4和OsO4卻極易熔化(熔點分別為298.6K和313.8K).
化學性質
酸鹼性
根據酸鹼特性,氧化物可分成4類:酸性的、鹼性的、兩性的和中性的。(1)酸性氧化物。溶於水呈酸性溶液或同鹼發生中和反應的氧化物是酸性氧化物。例如:
P4O10+6H2O→4H3PO4
SiO2+2NaOH—熔融→Na2SiO3+H2O
Sb2O5+2NaOH+5H2O→2Na[Sb(OH)6]
大多數非金屬共價型氧化物和某些電正性較弱的高氧化態金屬的氧化物都是酸性的。
(2)鹼性氧化物。溶於水呈鹼性溶液或同酸發生中和反應的氧化物是鹼性氧化物。例如:
CaO+H2O→Ca(OH)2
Fe2O3+6HCl→2FeCl3+3H2O
大多數電正性元素的氧化物是鹼性的。
(3)兩性氧化物。同強酸作用成酸性,又同強鹼作用呈酸性的氧化物是兩性氧化物。例如:
ZnO+2HCl→ZnCl2+H2O
ZnO+2NaOH+H2O→Na2[Zn(OH)4]
靠近長周期表中非金屬區的一些金屬元素的氧化物易顯兩性。
(4)中性氧化物。既不與酸反應也不與鹼反應的氧化物叫做中性氧化物。例如CO和N2O。
詳見:氧化物的酸鹼性。
熱穩定性
大部分氧化物具有很高的熱穩定性,尤其是IIA和IVB族元素的氧化物、Li2O、Na2O、B2O3、Al2O3、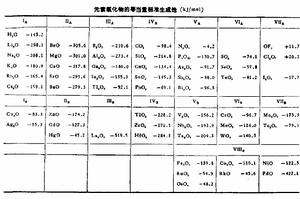
元素氧化物的等當量標準生成焓如右圖。
常見的氧化物簡表
(按元素周期表順序H2O H2O2 HO2 He Li2O BeO B2O3 B6O CO2 CO C3O2 C2O
N2O NO N2O3 NO2 N2O4 N2O5 O OF2 O2F2 Ne Na2O Na2O2 NaO2 MgO
Al2O3 SiO2 P4O10 P4O6 SO2 SO3 Cl2O ClO2 Cl2O7 Ar K2O K2O2 KO2
KO3 CaO Sc2O3 TiO2 V2O5 VO2 V2O3 VO CrO3 CrO2 Cr2O3 Mn2O7
MnO2 Fe2O3 Fe3O4 FeO Co2O3 Co3O4 CoO Ni2O3 NiO CuO Cu2O ZnO Ga2O3
GeO2 As2O3 As2O5 SeO2 SeO3 Br2O Kr Rb2O SrO Y2O3 ZrO2 Nb2O5
MoO3 MoO2 Tc2O7 RuO2 RuO4 Rh2O3 PdO Ag2O AgO CdO In2O3 SnO2
S nO Sb2O3 Sb2O3 TeO2 TeO3 I2O5 I4O9 XeO3 XeO4 Cs2O BaO HfO2
Ta2O5 WO3 WO2 W2O3 ReO3 Re2O7 OsO4 IrO2 PtO2 Au2O3 HgO Tl2O
Tl2O PbO Pb3O4 PbO2 Bi2O3 Bi2O5 PoO At Rn Fr Ra Rf Db Sg Bh Hs Mt Ds
La2O3 Ce2O3 CeO2 Pr Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Yb Lu
Ac ThO2 Pa U3O8 UO2 UO3 Np Pu Am Cm Bk Cf Es Fm Md No L)
氧化鈣
中文別名:生石灰 石灰; CaO; 預分散CaO-80; 母膠粒CaO-80; 藥膠CaO-80; 消泡劑CaO; 吸水劑CaO; 吸濕劑CaO; 煅燒石灰; 煅石灰; 稀釋用石灰; 納米氧化鈣; 鈉石灰[含氫氧化鈉]; 母膠粒CaO-80; 藥用氧化鈣; 消泡劑氧化鈣; 吸潮劑氧化鈣; 母膠粒氧化鈣化學式
CaO
相對分子質量
56.08(不考慮其他同位素)
EINECS
215-138-9
分子式
CAO
分子量
56.08
性狀
白色或帶灰色塊狀或顆粒。對濕敏感。易從空氣中吸收二氧化碳及水分。 溶於水成氫氧化鈣並產生大量熱,溶於酸類、甘油和蔗糖溶液,幾乎不溶於乙醇。相對密度3.32~3.35。熔點2572℃。沸點2850℃。折光率1.838。有腐蝕性。
生產方法
1.石灰石煅燒法:將石灰石粗碎至150 mm,並篩除30~50 mm以下的細渣。無煙煤或焦炭要求粒度在50 mm 以下,其中所含低熔點灰分不宜過多,其無煙煤或焦炭的加入量為石灰石的7.5%~8.5%(重量)。將經篩選的石灰石及燃料定時、定量由窯頂加入窯內,於900~1200℃煅燒,再經冷卻即得成品。在煅燒工序副產二氧化碳。其 CaCO3=CaO+CO2↑;
2.用純硝酸溶解大理石,將其煮沸驅除乾淨CO2。向熱溶液中加入石灰乳,過濾除去Cu、Fe、Mg等氫氧化物沉澱,加熱濾液當其接近沸騰時通入CO2產生Ca(HCO3)2,Ca(HCO3)2的量相當於加入的Ca(OH)2的量。煮沸該溶液,Ca(HCO3)2即分解成碳酸鈣沉澱,並攜帶痕量的Fe。濾液中的Ca(NO3)2經冷卻後加入1/3體積的濃氨水和濃的(NH4)2CO3則另有CaCO3沉澱下來。將CaCO3沉澱洗滌乾燥,放在石英坩堝中在電爐上灼燒即得純的氧化鈣。若要製得高純氧化鈣,則應先將高純硝酸鈣與高純碳酸銨合成碳酸鈣:將沉澱精製後,先於烘箱中烘乾,再經灼燒 ( 控制溫度逐漸升高) ,於1000℃恆溫8h,取出稍冷後,乾燥保存,製得的產品為99.999%的高純氧化鈣;
3.碳酸鈣煅燒法:
先將碳酸鈣與鹽酸反應生成氯化鈣,再加入氨水進行中和,靜置沉澱,過濾,再加入碳酸氫鈉反應生成碳酸鈣沉澱,經離心分離脫水,乾燥後,進行煅燒,經粉碎,篩選,製得藥用氧化鈣成品。其
CaCO3+2HCl→CaCl2+CO2+H2O
CaCl2+2NH3.H2O→Ca(OH)2+2NH4Cl
Ca(OH)2+NaHCO3→CaCO3+NaOH+H2O
CaCO3===高溫==CaO+CO2↑;
用途
1.可作填充劑,例如:用作環氧膠黏劑的填充劑;2.用作分析試劑,氣體分析時用作二氧化碳吸收劑,光譜分析試劑,高純試劑用於半導體生產中的外延、擴散工序,實驗室氨氣的乾燥及醇類脫l水等。
3.用作原料,可製造電石、純鹼、漂白粉等,也用於製革、廢水淨化,氫氧化鈣及各種鈣化合物;
4.可用作建築材料、冶金助熔劑,水泥速凝劑,螢光粉的助熔劑;
5.用作植物油脫色劑,藥物載體,土壤改良劑和鈣肥;
6.還可用於耐火材料、乾燥劑;
7.可配製農機1、2號膠和水下環氧膠黏劑,還用作與2402樹脂預反應的反應劑;
8.用於酸性廢水處理及污泥調質;
9.還可用作鍋爐停用保護劑,利用石灰的吸濕能力,使鍋爐水汽系統的金屬表面保持乾燥,防止腐蝕,適用於低壓、中壓、小容量汽包鍋爐的長期停用保護;
10、可以和水反應製備氫氧化鈣,反應方程式:CaO+H2O==Ca(OH)2,屬於化合反應。

