定義性質
定義
既不含能電離的氫離子,又不含氫氧根離子的鹽。性質
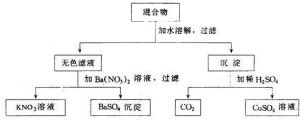 正鹽圖所示步驟進行實驗
正鹽圖所示步驟進行實驗酸跟鹼完全中和生成的鹽中,不會有酸中的氫離子,也不會有鹼中的氫氧根離子,只有金屬陽離子和酸根離子,這樣的鹽為正鹽。生成正鹽的反應,如:
HCl+NaOH=NaCl+H2O
H2SO4+Cu(OH)2=CuSO4+2H2O
H2SO4+2NaOH=Na2SO4+2H2O等
正鹽既不含能電離的氫離子,又不含氫氧根離子的鹽。化學中的鹽分為單鹽和合鹽,單鹽分為正鹽、酸式鹽、鹼式鹽,合鹽分為復鹽和絡鹽。在酸跟鹼完全中和生成的鹽中,不會有酸中的氫離子,也不會有鹼中的氫氧根離子,只有金屬陽離子和酸根離子,呈中性的鹽就是正鹽。正鹽是酸鹼完全中和的產物:NaOH+HCl===NaCl(正鹽)+H2O。判斷正鹽、酸式鹽和鹼式鹽通常採用以下方法:金屬離子+酸根--正鹽;金屬離子+H+酸根---酸式鹽;金屬離子+OH+酸根--鹼式鹽。
 正鹽圖所示步驟進行實驗
正鹽圖所示步驟進行實驗碳酸銅正鹽是一種化學品,英文名是copper carbonate,分子式是CuCO3。
碳酸銅(CuCO3):小於“水解”趨勢,所以溶液呈鹼性。酸式鹽熱穩定性 一般為正鹽熱穩定性大於...↑+2H2O水解程度對比強鹼弱酸的酸式鹽水解程度小於強鹼弱酸的正鹽水解程度。如...的溶解性 一般來說,在相同溫度下,不溶性正鹽對應的酸式鹽的溶解度比正鹽...
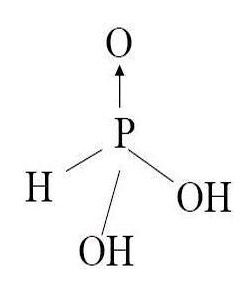
定義 性質磷酸鹽。磷酸鹽很多,有正鹽和酸式鹽兩類。正鹽如磷酸鈉Na3PO4、磷酸鈣...正鹽、一氫鹽、二氫鹽依次漸增。磷酸與足量鹼生成正鹽。天然存在的磷酸鹽...微鹼性,正鹽鹼性,正鹽遇酸視酸量不同可轉化為磷酸、二氫鹽或一氫鹽;一氫鹽...
磷酸鹽 分類 化學性質 用途 參考資料)(3)多元鹼(Fe(OH)3等)鹽(1)正鹽(Na2CO3....水;碳酸的正鹽、矽酸的正鹽、亞硫酸的正鹽、磷酸的正鹽、氫硫酸的正鹽除鉀鹽...一般易溶於水,磷酸氫鹽和正鹽類似,一般不溶於水;碳酸氫鹽一般易溶於水...
酸鹼鹽的分類 酸鹼鹽的定義 酸鹼鹽的讀法 酸、鹼、鹽的溶解性 酸鹼鹽中的規律簡介鹽法國家對食鹽徵稅和專賣榷禁的各種制度。我們的祖先很早以前就知道食用鹽了,但是國家對鹽的生產和銷售加以管理,則自春秋始。當時...
簡介 歷程 立法 變遷 擴展閱讀參考書目相關介紹磷酸的鹽類。皆為固體,溶解性按正鹽、一氫鹽、二氫鹽依次漸增。其鈉或鉀鹽的水解,其二氫鹽呈微酸性,一氫鹽微鹼性,正鹽鹼性,正鹽遇酸視酸量...鹽與強酸則有磷酸生成。磷酸根磷酸酸加工可製得磷酸鹽。磷酸與足量鹼生成正鹽...
相關介紹。正鹽正鹽是一鹽類的一種,既不含能電離的氫離子,又不含氫氧根離子。 正鹽是酸和鹼完全中和的產物 ,但正鹽的水溶液不一定顯中性,如NaCO(碳酸鈉...,這樣的鹽為正鹽。生成正鹽的反應。酸式鹽酸式鹽是鹽類的一種,由陽離子和...
定義 分類 性質 製備 命名法詞語解釋讀音:dǐnggé解釋[change of dynasties] 建立新的,革除舊的。舊時特指改朝換代。鼎革,“鼎”與“...
詞語解釋 網路小說《鼎革》 《鼎革》鹽引開中制度 《鼎革》目錄 卦名