簡介
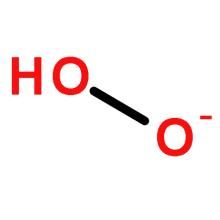
超氧化物中,氧的氧化態為-1/2,O2-的O-O鍵長為1.33pm;(氧氣中為1.21pm;,O22-中為1.49pm;)。按O-O鍵級排序,O2中鍵級為2,O2-中鍵級為1.5,O22-中的鍵級為1。無機化學
鹼金屬超氧化物CsO2、RbO2、KO2可由金屬與氧氣直接反應製備,NaO2的製備則需過氧化鈉與氧氣加壓反應,單質直接反應得到的超氧化鈉約占10%。它們都是橙黃色的穩定固體,與水迅速反應歧化。反應中的O2為強布朗斯特鹼,先與質子反應生成超氧酸(HO2,pKa約為4.88)。其他獲得鹼金屬超氧化物的方法有:
①氧氣低溫氧化金屬的液氨溶液。超氧化鋰就可通過此法製得。
②通過鹼金屬氫過氧化物的過氧化氫合物分解製得,如2NaOOH·H2O2及相應的鉀化合物分解可分別得到NaO2和KO2。
鹼土金屬中,鋇和鈣的超氧化物Ba(O2)2、Ca(O2)2也已製得。Mg、Zn、Cd的超氧化物僅以很小濃度,以固溶體的形式存在於相應的過氧化物中。
固態超氧化物加熱時分解,與二氧化碳反應經由過氧碳酸鹽中間體,最終得到氧氣和碳酸鹽。超氧化鉀可用作空間飛船和潛艇中的供氧劑。
4KO2+2CO2==2K2CO3+3O2。
有機化學
在有機化學中,超氧化物可以作為反應物與烯烴反應形成環氧化物。如(MCPBA,MMPP......)生物化學
 超氧化物
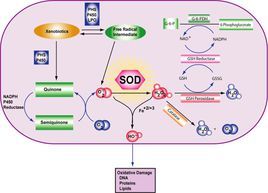
超氧化物生物體正常代謝過程和在各種環境脅迫下均能產生活性氧和自由基(包括超氧陰離子),它們的積累將引起生物體內細胞結構和功能的破壞。超氧化物歧化酶(superoxidedismutase,SOD)廣泛存在於生物體內,是活性氧清除系統中第一個發揮作用的抗氧化酶.。SOD岐化超氧陰離子自由基生成過氧化氫和分子氧,可在保護細胞免受氧化損傷過程中具有十分重要的作用。
種類及性質
超氧化物通常是由金屬離子和超氧離子形成的化合物。其主要品種有超氧化鈉(Na2O4)(也被寫作NaO2)、超氧化鉀(K2O4)(也被寫作KO2)。鉀、銣、銫、鈣、鍶、鋇能形成超氧化物,特徵是分子中含有超氧離子O2。超氧化物易潮解,加熱時便釋放出氧氣,性質不穩定,具有強氧化性和強吸濕性,置於空氣中能與水和二氧化碳發生反應生成碳酸鹽,同時放出氧。基於這一性質,它們是氧氣再生藥板的主要原料,也用作隔絕式氧氣面具的產氧藥柱。上述反應方程式如下(以K2O4為例):
K2O4+2H2O=2KOH+H2O2+O2↑
2K2O4+2CO2=2K2CO3+3O2
製備方法
超氧化物的製備方法主要有以下三種:①過氧化物與氧氣作用。
②鉀、銣、銫在過量的氧氣中燃燒。
③將氧氣通入鉀、銣、銫的液氨溶液中。
超氧化鈉是將過氧化鈉在壓力為13MPa、溫度為350℃的高壓釜中通入氧氣進行氧化生成的。
超氧化鉀的製備是在不鏽鋼置換釜內,以金屬鈉置換氯化鉀得到純度大於97%的金屬鉀,熔融的鉀壓送到特製的噴槍與經過淨化的空氣混合後噴入氧化爐,在230~250℃下燃燒生成超氧化鉀。