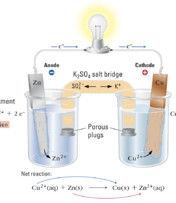
定義
 氧化反應
氧化反應物質失電子的作用叫氧化反應;得電子的作用叫還原。狹義的氧化指物質與氧化合;還原指物質失去氧的作用。氧化時氧化值升高;還原時氧化值降低。氧化、還原都指反應物(分子、離子或原子)。氧化也稱氧化作用或氧化反應。有機物反應時把有機物引入氧或脫去氫的作用叫氧化;引入氫或失去氧的作用叫還原。物質與氧緩慢反應緩緩發熱而不發光的氧化叫緩慢氧化,如金屬鏽蝕、生物呼吸等。劇烈的發光發熱的氧化叫燃燒。
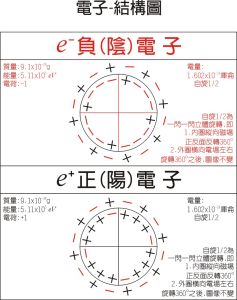 電子-模型圖
電子-模型圖 一般物質與氧氣發生氧化時放熱,個別可能吸熱如氮氣與氧氣的反應。電化學中陽極發生氧化,陰極發生還原。
根據氧化劑和氧化工藝的不同,氧化反應主要分為空氣(氧氣)氧化和化學試劑氧化。化學試劑氧化具有選擇性好、過程簡單、方便靈活等優點,在醫藥化工領域,由於產品噸位小,因此多用化學試劑氧化法。
化學試劑氧化所用的氧化劑有無機氧化劑和有機氧化劑,無機氧化劑包括:高價金屬氧化物、高價金屬鹽、硝酸、硫酸、氯酸鈉、臭氧、過氧化氫等;有機氧化劑一般是緩和的氧化劑,包括硝基物、亞硝基物、過氧酸以及與無機氧化物形成的複合氧化劑。
生物氧化反應分類
肝細胞微粒體、線粒體和胞液中含有參與生物轉化作用的不同氧化酶系,如加單氧酶系、胺氧化酶系和脫氫酶系。注意:微粒體並不是活細胞中的亞細胞結構(細胞器),而是組織細胞在實驗室破碎分離得到的一種囊狀膜結構,它是由細胞內質網的碎片形成的,因此,微粒體相當於細胞內的內質網部分。
1、加單氧酶系:此酶系存在於微粒體中,能催化烷烴、烯烴、芳烴和類固醇等多種物質進行氧化。該酶系催化反應的一個特點是能直接激活氧分子,使其中的一個氧原子加到作用物上,而另一個氧原子被NADPH還原成水分子。由於一個氧分子發揮了兩種功能,故將加單氧酶系又叫做混合功能氧化酶。又因底物的氧化產物是羥化物,所以該酶又稱為羥化酶。
加單氧酶系的羥化作用非常廣泛,例如維生素D3在肝臟和腎臟經2次羥化後形成活性的1,25-(OH)2-D3,類固醇激素(腎上腺皮質激素、性激素)和膽汁酸的合成都需要羥化過程。應該指出的是,有些致癌活性物質經羥化後失活,但另一些無致癌活性的物質經羥化後會生成有致癌活性的物質,如多環芳烴經羥化後就具有了致癌活性,還需通過其他生物轉化形式進行轉化滅活。因此,生物轉化是轉化而不是解毒!
2、胺氧化酶系:此酶系存在於肝細胞線粒體中,可催化活性物質胺類的氧化脫氫,生成相應醛類。胺類物質是由胺基酸脫羧基作用產生的,胺類物質具有生物活性。例如由谷氨酸脫羧產生的γ-氨基丁酸(GABA)是一種抑制性神經遞質,在臨床上可用於減輕早孕反應;組氨酸脫羧產生的組胺是一種強烈的血管舒張劑,並能增加毛細血管的通透性,創傷性休克和炎症時會引起組胺的釋放;色氨酸脫羧後產生的5-羥色胺是一種抑制性神經遞質,並對外周血管有刺激收縮的作用;鳥氨酸等脫羧作用後產生的多胺(精脒、精胺)是調節細胞生長物質,在旺盛分裂的癌細胞中多胺含量較高。胺類物質的另一個來源是腸道中的胺基酸經細菌的脫羧基作用產生並被吸收入血,如屍胺、腐胺,這些是有活性的毒性物質。
3、醇脫氫酶系和醛脫氫酶系:分布於肝細胞微粒體和胞液中的醇脫氫酶(ADH)和醛脫氫酶(ALDH),均以NAD+為輔酶,可催化醇類氧化成醛,醛類氧化成酸。
乙醇作為飲料和調味劑廣為利用。人類攝入的乙醇可被胃(吸收30%)和小腸上段(吸收70%)迅速吸收。吸收後的乙醇90%~98%在肝臟代謝,其餘在腎臟進行代謝。人類血中乙醇的清除速率為100~200mg/h·kg體重。酒精有輕度的麻醉(喝酒解乏)、能增強自信心(酒壯英雄膽)、心率加快、皮膚充血(面紅耳赤)導致皮溫升高(喝酒禦寒)、噁心嘔吐等生理效應,飲酒過量會導致這些效應放大而使人在意識和行動上失去自我控制。這些作用效果其實並不完全是由乙醇直接導致的,很多是由乙醇脫氫氧化產物乙醛刺激機體產生腎上腺素、去甲腎上腺素等產生的生理反應。
醇脫氫酶(ADH)和醛脫氫酶(ALDH)在人類中存在多態性(同工酶)。ADH為二聚體,有3種亞基αβγ,成人主要是β二聚體,多數白種人是活性較低的β1β1,90%的黃種人是活性較高的β2β2,加之白種人ALDH活性較高,而黃種人約50%的ALDH活性較低,因此黃種人飲酒後能快速生成乙醛,約一半的黃種人乙醛氧化速度較慢,導致黃種人飲酒後乙醛濃度升高。顯然,黃種人與白種人在同等條件下更容易導致酒精中毒。長期過量飲酒由於加重肝臟生物轉化的負擔而影響肝臟功能。
常用氧化劑
下面介紹幾種常用氧化劑:
高錳酸鉀氧化性強,可以將伯醇、醛、芳環側鏈的烷基氧化成酸,由於在酸性條件下氧化選擇性差,多在中性或鹼性中使用。
二氧化錳是較溫和的氧化劑,可將芳環側鏈的甲基氧化為醛。
三氧化鉻的吡啶絡合物是比較緩和的氧化劑,可將伯醇氧化為醛,而不破壞碳碳雙鍵和其它基團。
注意事項
1、鎂在空氣中燃燒:2Mg+O2=2MgO白色信號彈
現象:(1)發出耀眼的白光(2)放出熱量(3)生成白色粉末
2、鐵在氧氣中燃燒:3Fe+2O2=Fe3O4
現象:(1)劇烈燃燒,火星四射(2)放出熱量(3)生成一種黑色固體
注意:瓶底要放少量水或細沙,防止生成的固體物質濺落下來,炸裂瓶底。
3、銅在空氣中受熱:2Cu+O2=△=2CuO
現象:銅絲變黑、用來檢驗是否含氧氣。
4、鋁在空氣中燃燒:4Al+3O2=2Al2O3
現象:發出耀眼的白光,放熱,有白色固體生成。
5、氫氣中空氣中燃燒:2H2+O2=2H2O高能燃料
現象:(1)產生淡藍色火焰(2)放出熱量(3)燒杯內壁出現水霧。
6、紅(白)磷在空氣中燃燒:4P+5O2=2P2O5證明空氣中氧氣含量
現象:(1)發出白光(2)放出熱量(3)生成大量白煙。
7、硫粉在空氣中燃燒:S+O2=SO2
現象:
A、在純的氧氣中
發出明亮的藍紫火焰,放出熱量,生成一種有刺激性氣味的氣體。
B、在空氣中燃燒
(1)發出淡藍色火焰(2)放出熱量(3)生成一種有刺激性氣味的氣體。
8、碳在氧氣中充分燃燒:C+O2=CO2
現象:(1)發出白光(2)放出熱量(3)澄清石灰水變渾濁
9、碳在氧氣中不充分燃燒:2C+O2=2CO
10、二氧化碳通過灼熱碳層:C+CO2=2CO(是吸熱的反應)
11、一氧化碳在氧氣中燃燒:2CO+O2=2CO2
現象:發出藍色的火焰,放熱,產生的氣體能使澄清石灰水變渾濁。
12、二氧化碳和水反應(二氧化碳通入紫色石蕊試液):
CO2+H2O=H2CO3
現象:紫色石蕊試液由紫色變成紅色。
注意:酸性氧化物+水→酸
如:SO2+H2O=H2SO3 SO3+H2O=H2SO4
13、生石灰溶於水:CaO+H2O=Ca(OH)2(此反應放出大量的熱)
注意:鹼性氧化物+水→鹼
氧化鈉溶於水:Na2O+H2O=2NaOH[1]
氧化鉀溶於水:K2O+H2O=2KOH
氧化鋇溶於水:BaO+H2O=Ba(OH)2
14、鈉在氯氣中燃燒:2Na+Cl2=2NaCl(無氧也能夠燃燒)
15、2Hg+O2=2HgO銀白液體、生成紅色固體拉瓦錫測定空氣中氧氣的實驗
16、2Cu+O2=2CuO紅色金屬變為黑色固體用來檢驗是否含氧氣
17、無水硫酸銅作乾燥劑:CuSO4+5H2O=CuSO4·5H2O