簡介
兩種或兩種以上化學性質可區別的物質所組成的均勻混合物。溶液的組成比有一定的連續變化範圍,溶液的性質隨組成比而連續變化,均勻是指在這個單一相中物質的分散程度達到分子水平。具有上述特徵的實體可能是氣態的、固態的或是液態的,溶液一詞習用上是專指液體溶液,特別是水溶液;對於液-液組成的溶液在多數事例中稱為混合物(見溶液類型)。
 溶液
溶液對於氣體或固體溶於液體而成的溶液,習慣上把氣體或固體叫溶質,液體叫溶劑;對於兩種液體所組成的溶液,則把含量較多的組分叫溶劑,少者叫溶質,它們具有相對的意義。
在自然界中純物質極少,溶液是最主要的物質存在形式。人體中的體液是溶液,不知道溶液性質就不能了解生命現象;黃銅是銅和鋅的溶液(合金);空氣則是由氮氣、氧氣、稀有氣體等組成的氣體混合物。要了解這些物質,就需要了解溶液性質的基本規律和內在原因。又如在許多工業過程中,反應必須在溶液中才容易發生和控制,溶劑環境影響著化學反應的機理和速率;化工生產中的萃取、蒸餾、鹽析等操作和生物學、地球化學、地質學等學科研究中都涉及溶液,因此,溶液問題在化學和這些學科中占有重要位置。
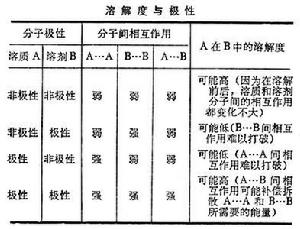
溶解度溶解是人們經常遇到的現象,不同物質形成溶液的可能性和溶解度的大小等問題,早為人們所關注,但迄今認識上還很不成熟。早期人們根據一些經驗來認識它。例如,水是具有多羥基分子物質的良溶劑;烴類易於相互溶解;二硫化碳是硫和碘的良溶劑,而對分子中具有極性集團的物質則是不良溶劑。所以,曾以一句諺語“相似者相溶”來描述這種溶解的特性。然而,隨著溶液種類的增多,發現這個原則不能概括許多事例,例如甲醇和苯、水和二甲基甲醯胺、苯胺和二乙基醚、聚苯乙烯和氯仿在室溫下皆能在全組成比範圍內混溶。這裡,每對物質的分子是不相似的。也可以指出一些相似而不溶的情況,例如,聚乙烯醇不溶於乙醇;醋酸纖維不溶於乙酸乙酯;聚丙烯腈不溶於丙烯腈;四氯化錫在苯中比在四氯化碳中更易溶解。這些事例表明:以“相似與否”作為原則,不能概括地描述多種多樣的溶解性質。雖然如此,當前不使用“相似”一詞,而根據分子極性所導致的分子間相互作用的大小來估計溶解性質的作法是有實用意義的,這一點可由表看出:
 溶液
溶液溶度參數利用實驗得到的物質的溶度參數,可以估計非電解質在有機溶劑中的溶解度。溶度參數
的定義是:
式中E為摩爾凝聚能;V為摩爾體積,在低於正常沸點溫度時,E近似等於該物質的蒸發能ΔU。由實驗結果可知,一種溶質的良好溶劑的 δ值,必與這個溶質的 δ值相近。如果兩種溶劑之一的δ值較溶質高;另一種較溶質低,則兩者的混合物比單一溶劑對溶質的溶解能力更好。這個現象為上表所示內容的一個方面。多數的酸、鹼、鹽易溶於水和其他極性溶劑。
決定溶液性質的因素在溶液中,分子足夠接近,各種分子間的力皆起著一定作用;分子在溶液中占據空間,具有局部的和統計性質的排布狀況。從本質上看,溶液性質和溶解現象決定於兩方面特性:其一是溶液和純物質的結構;其二是分子間作用力的大小和性質。例如普通鹽水是由氯化鈉離子晶體和締合液體水所形成,在溶液中離子電場的作用導致一定數量鄰近離子的水偶極子固定取向,性質上表現為與離子相聯結,並且離子電場也影響著較遠區域的水分子性質,並改變了水的初始結構狀態。溶液性質隨濃度的變化,也是由上述結構和分子、離子間相互作用的變化所決定。兩個低碳的且碳原子數相近的烷烴混合時,體積和熱量變化接近零值,所形成的混合物相當好地遵守拉烏爾定律。這顯然是由於它們的純質是非極性分子組成的簡單分子液體,各自的分子間相互作用的大小和性質皆相近,得以形成接近理想的分子混合物。醇-水溶液的性質則取決於同種分子間氫鍵締合結構的破壞和異種分子間氫鍵締合結構的形成。隨著溶液組分的不同,結構和分子間力的特徵也不同,構成了溶液研究的廣闊內容。
結構和分子間相互作用這兩項因素不是各自獨立的,分子間力左右著結構狀態;結構狀態又決定著體系的勢能。與熱力學函式聯繫起來,熵反映了無序度的量度,是一種結構性質;焓是勢能的量度,就是使所有分子互相分離所需的能量。溶解是自發過程,在等溫等壓下吉布斯函式降低值ΔG是由焓變ΔH和熵變ΔS兩項組成:
ΔG=ΔH-TΔS
如果溶解前後分子間相互作用等同並為無序混合,即ΔH=0,而且ΔS符合理想值,則由此形成理想溶液。實際溶液總是不同程度上偏離理想溶液。有的溶液性質主要決定於結構因素,這種類型的極限情況是 ΔH為零,ΔG即為-TΔS,稱為無熱溶液。有的溶液性質主要決定於同種分子和異種分子間相互作用的不同,其極限情況是ΔH不等於零,而混合是無序的,-TΔS符合理想值,稱為正規溶液。在理論上,有著多種溶液模型,其共同點都是針對一定的典型溶液性質,以統計力學為基礎對溶液中分子的分布和相互作用給出數學處理,從而計算溶液的熱力學函式。這些模型是實際溶液的近似。理論工作促進了對溶液本質的認識和對溶液性質的解釋。
溶液問題涉及很多學科,許多知識皆是探討溶液本質所需要的,諸如化學熱力學、統計力學、分子結構、化學反應及其機理、化學鍵及分子間相互作用、相變和相平衡,以及物質的氣態、液態和固態的性質等。
組成成份
1.溶質: 被溶解的物質 (例如:用鹽和水配置鹽水鹽就是溶質)
2.溶劑: 能溶解其他物質的物質(例如:用鹽和水配置鹽水'水就是溶劑)
3.兩種溶液互溶時,一般把量多的一種叫溶劑,量少的一種叫溶質。
4.兩種溶液互溶時,若其中一種是水,一般將水稱為溶劑。
5.固體或氣體溶於液體,通常把液體叫溶劑。
 溶液配製
溶液配製其中,水(H2O)是最常用的溶劑,能溶解很多種物質。汽油、酒精、氯仿、香蕉水也是常用的溶劑,如汽油能溶解油脂,酒精能溶解碘等等。
溶質可以是固體,也可以是液體或氣體;如果兩種液體互相溶解,一般把量多的一種叫做溶劑,量少的一種叫做溶質。
溶質溶解在溶劑中形成溶液,物質的溶解度變化的曲線叫做溶解度曲線。溶解度曲線可以查出某物質在一定溫度時的溶解度。
氣體的溶解度是指這種氣體在壓強為101kPa和一定溫度時溶解在1體積里達到飽和狀態時的氣體體積。
固體溶解度表示在一定的溫度下,某物質在100g溶劑里達到飽和狀態是所溶解的質量。多數固體的溶解度隨溫度的升高而增大,但也有少數固體的溶解度隨溫度的升高而減小。
溶液性質
1.均一性:溶液各處的密度、組成和性質完全一樣;
2.穩定性:溫度不變,溶劑量不變時,溶質和溶劑長期不會分離(透明);
3混合物:溶液一定是混合物。
濃度計算
定義
一種可溶物質溶於一種溶劑後,在該溶劑的分布密度以百分比的方式表示,稱為溶液百分比濃度(溶液質量分數)
常用C%來表示(也可表示為w)
意義
是溶液濃稀程度的標準公式
溶液百分比濃度的計算公式為:
*其中 溶質質量+溶劑質量=溶液質量
溶液用途
 溶液的用途
溶液的用途在溶液里進行的化學反應通常是比較快的。所以,在實驗室里或化工生產中,要使兩種能起反應的固體起反應,常常先把它們溶解,然後把兩種溶液混合,並加以振盪或攪動,以加快反應的進行。
溶液對動植物的生理活動也有很大意義。動物攝取食物里的養分,必須經過消化,變成溶液,才能吸收。在動物體內氧氣和二氧化碳也是溶解在血液中進行循環的。在醫療上用的葡萄糖溶液和生理鹽水、醫治細菌感染引起的各種炎症的注射液(如慶大黴素、卡那黴素)、各種眼藥水等,都是按一定的要求配成溶液使用的。植物從土壤里獲得各種養料,也要成為溶液,才能由根部吸收。土壤里含有水分,裡面溶解了多種物質,形成土壤溶液,土壤溶液里就含有植物需要的養料。許多肥料,像人糞尿、牛馬糞、農作物秸稈、 野草等等,在施用以前都要經過腐熟的過程,目的之一是使複雜的難溶的有機物變成簡單的易溶的物質,這些物質能溶解在土壤溶液里,供農作物吸收。
形成機制
溶液形成的過程伴隨著能量、體積變化,有時還有顏色變化。溶解是一個特殊的物理化學變化,分為兩個過程。一是溶質分子或離子的離散,這個過程需要吸熱以克服分子間的吸引力,同時增大體積;二是溶劑分子和溶質分子的結合,這是一個放熱過程同時體積縮小。整個過程的綜合情況是兩方面的共同作用。
溶液配製
1.理論
c=n/v (mol/L)2.專用儀器:
(1).台秤(或天平)、燒杯、玻璃棒、量筒(或量杯)、容量瓶、移液管、膠頭滴管 、表面皿。
2.固體藥品:
(2).NaCl, NaOH .
液體藥品
(3).95%(ml/ml) 醫用酒精、濃HCl、蒸餾水。
操作步驟
1.計算:n=m/M , c=n/v , p=m/v
例:實驗室用密度為1.18g/mL,質量分數為36.5%,濃鹽酸配製250ml,0.3mol/L的鹽酸溶液。
v=m/p=(0.25*0.3*36.5)/(36.5%*1.18)
2.稱量或量取:固體試劑用托盤天平或電子天平稱量,液體試劑用量筒。
3.溶解:應在燒杯中溶解,待冷卻後轉入容量瓶中。
4.轉移:由於容量瓶的頸較細,為了避免液體灑在外面,用玻璃棒引流。
5.洗滌:用少量蒸餾水洗滌2到3次,洗滌液全部轉入到容量瓶中。
6.定容:向容量瓶中加入蒸餾水,在距離刻度2到3cm時,改用膠頭滴管加之刻度線。
影響配製溶液
1.稱量時引起誤差。
2.未將燒杯洗滌,使溶液的物質量減少,導致溶液濃度偏低。
3.轉移時不小心濺出溶液,導致濃度偏低。
安全注意
1.氫氧化鈉為鹼性化學物質,濃鹽酸為酸性化學物質,注意不要濺到手上、身上、以免腐蝕!
2.要注意計算的準確性
3.注意移液管的使用
溶液計算
根據稀釋前後溶質的總量不變進行運算,無論是用水,或是用稀溶液來稀釋濃溶液,都可計算。
(1)用水稀釋濃溶液
設稀釋前的濃溶液的質量為m,其溶質的質量分數為a%,稀釋時加入水的質量為n,稀釋後溶質的質量分數為b%。
則可得m×a%=(m+n)×b%
(2)用稀溶液稀釋濃溶液
設濃溶液的質量為A,其溶質的質量分數為a%,稀溶液的質量為B,其溶質的質量分數為b%,兩液混合後的溶質的質量分數為c%。
則可得 A×a%+B×b%=(A+B)×c% (1)
或 A/B=(c%-b%)/(a%-c%) (2)
使溶液變濃(增大一倍)
1.增加溶質
令溶液質量為m g,溶質的質量分數為a%
若使其質量分數增大一倍
則要加am/100+2a g 的溶質
2.蒸發溶劑
令溶液質量為m g,則蒸發m/2 g溶劑
3.用濃溶液混合
令稀釋前溶液質量為m g,溶質的質量分數為a%;稀釋後溶液質量為n g,溶質的質量分數為b%
則有m g*a%+n g*b%/m g+n g*100%=b%
使溶液變稀
1.增加溶劑
令溶液質量為m g
若使其質量分數減小一倍
則要加m g溶劑
2。減少溶質
溫度變化
物質溶解,一方面是溶質的微粒——分子或離子要克服它們本身的相互之間的吸引力離開溶質,另一方面是溶解了的溶質要擴散到整個溶劑中去,這些過程都需要消耗能量,所以物質溶解時,要吸收熱量。溶解過程中,溫度下降原因就在於此。
如果溶解過程只是單純的擴散,就應該全是吸熱的,為什麼還有的放熱呢?原來,在溶解過程中,溶質的微粒——分子或離子不僅要互相分離而分散到溶劑中去,同時,溶解於溶劑中的溶質微粒也可以和溶劑分子生成溶劑化物(如果溶劑是水,就生成水合物)。在這一過程里要放出熱量。
如NaOH,CaO溶於水Q放>Q吸,故升溫
如NH4NO3溶於水Q放

