基本簡介
離子是指原子由於自身或外界的作用而失去或得到一個或幾個電子使其達到最外層電子數為8個或2個的穩定結構。這一過程稱為電離。電離過程所需或放出的能量稱為電離能。與分子、原子一樣,離子也是構成物質的基本粒子。原子失去或獲得電子後所形成的帶電粒子叫離子,例如鈉離子Na+。帶電的原子團亦稱“離子”,如硫酸根離子。某些分子在特殊情況下,亦可形成離子。
一般說來,原子核最外層電子數小於4的通常形成陽離子(就是帶正號的),大於4的通常形成陰離子(也就是帶負號的),還有一個規律,原子核最外層電子數也就決定了該元素的化合價,就是正號或者負號前的數.
陽離子是指原子由於 外界作用失去一個或幾個 電子,使其最外層電子數達到8個或2個電子的穩定結構。原子半徑越大的 原子其失電子能力越強, 金屬性也就越強。屬性最強的金屬 元素是鍅(Fr)。
帶一個或多個正電荷的離子稱為“正離子”,亦稱“陽離子”。
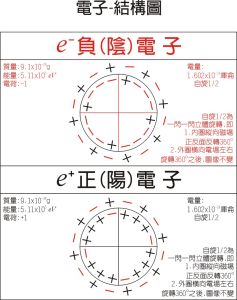 電子-模型圖
電子-模型圖(放)電子的功能
而原子的半徑愈大,原子的失電子能力較強, 金屬性也就較強;相反,原子的半徑愈小,原子的失電子能力愈弱,因此金屬性也較弱。而原子的半徑相同,最外層電子數目愈少,失電子能力較強;相反,最外層電子數目愈多,失電子能力較弱。金屬性最強的 元素是 鍅(Fr),也是失(放)電子的能力最強的 金屬。
陽離子是帶正電荷的離子,核電荷數= 質子數>核外電子數,所帶正電荷數等於原子失去的電子數。
陽離子的書寫方法就是在該離子的元素或原子團負號右上角表上所帶電荷數與“+”號,如鈉離子:Na+、三價鐵離子:Fe3+、銨根NH4+、銀銨 配離子:[Ag(NH3)2]+等
陽離子的鑑定方法
Na鑑定方法:
1.取2滴Na試液,加8滴醋酸鈾醯試劑 :UO2(Ac)2+Zn(Ac)2+HAc,放置數分鐘,用玻璃棒摩擦器壁,淡黃色的晶狀沉澱出現,示有Na :
3UO2+Zn+Na+9Ac+9H2O=3UO2(Ac)2·Zn(Ac)2·NaAc·9H2O
條件與干擾:
1.在中性或醋酸酸性溶液中進行,強酸強鹼均能使試劑分解。需加入大量試劑,用玻璃棒摩擦器壁
2.大量K存在時,可能生成
KAc·UO2(Ac)2 的針狀結晶。如試液中有大量K時用水沖稀3倍後試驗。 Ag、Hg、Sb有干擾, PO4、AsO4能使試劑分解,應預先除去
靈敏度:
撿出限量:12.5μg
最低濃度:250μg·g (250ppm)

