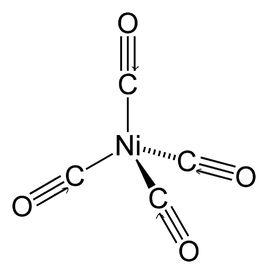
中心離子的分類
從中心離子的電子結構可以了解它們與有機試劑的絡合物形成及穩定性,金屬離子的電子結構不同,它的離子勢(離子電荷z與離子半徑r的比值)也不同,反映出的與配位體的絡合能力也不同.根據中心離子與配位原子0,N,S的配位能力,按中心離子電子結構把金屬離子分成三組.
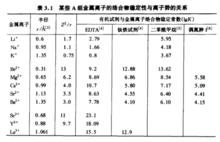
第一組具有惰性氣體電子結構的金屬離子(外層軌道具有2或8個電子).這組離子與配位原子O的成鍵能力大於N和S.鹼金屬、鹼土金屬,Al,Sc,Y,Ln(+3價鑭系元素),Ac,Fe,Si,Ce,Ti(Ⅳ),Zr(Ⅳ),Hf(Ⅳ),U,Th,Nb(V),Ta(V),Cr(Ⅵ),Mo(Ⅵ),W(Ⅵ),Re2+,Os(Ⅷ),U(VI)等屬於這一組,還有Ge,Sn,pb,Bi(V)也應屬於這一組.多數情況下,它們易與含氧配位原子的有機試劑反應,金屬離子與配位原子成鍵性質多為靜電引力.這組金屬離子的絡合物穩定性一般與金屬離子的離子勢(Z/r)成正比(表3.1).
 中心離子
中心離子表3.1
鹼金屬離子與含有氧配位原子的冠醚絡合物儘管沒有離子鍵形成也相當穩定,如Na,K,Cs與18一冠醚一6的絡合物穩定常數(lgK)分別為4.32,6.10和4.62,除了離子半徑與冠醚孔穴半徑相匹配外,與鹼金屬離子的親氧能力較大也很有關係.
Ti,Zr,Nb(V),Ta(V),Mo(Ⅵ),W(Ⅵ)等水解或以TiO,ZrO,NbO,TaO,MoO,WO形式存在,同樣表明這些金屬離子具有較強的親氧能力.所以含有O,O配位原子的有機試劑,如鄰苯二酚紫(PV)、苯基螢光酮、鉻天青S、β一二酮類及有機羧酸等易與這組金屬離子形成穩定的絡合物.
對於半徑相近的金屬離子,電荷越多,離子勢越大,形成的絡合物越穩定.如Mg和Sc半徑較為接近,與EDTA的絡合物lgK分別為8.69和23 1.差別很大
第二組(較小的一組)是具有d。或d排布的那些過渡金屬離子。這包括Cu(I)、Ag(I)、Au(I)、Hg(II)、Pt(Ⅱ)和pd(Ⅱ),它們的離子容易變形並有形成共價鍵的能力。與第一組離子相反,本組離子能形成高度穩定的絡物。在第一組中,電荷和離子半徑影響絡合物的形成,麗在第二組中,電負性則是重要的。
配位體中給予原子的電負性愈低,絡合物中的鍵就愈強。這一組金屬同含有硫、砷和磷的配位體形成穩定的絡合物。在鹵族中,同氟離子的鍵是最弱的。在具有高度穩定性的絡合物中,可能會出現π鍵。如果金屬離子的軌道都充滿了,則生成鍵的電子來自金屬離子。對於要形成的鍵,配位體必須有能接受電子的空的p或d軌道。氟離子沒有可用的d軌道,而它的p軌道又被充滿,所以不能形成π給予鍵。例如,在Cu(I)、Zn(II)和Ga(IlI)的氰絡合物和氯絡合物中,出現了π-給予鍵。
第三組(相當大的一組)包含有軌道部分充滿的過渡金屬離子。根據d電子的數目,這些離子的性質處在前兩組金屬離子的性質之間。從絡合物穩定性的觀點出發,離子的電荷與半徑以及由軌道的分裂而引起的穩定化作用都是重要的。與相同配位體形成的絡合物的穩定性和鍵的共價性一般隨著金屬離子氧化數的增加而增強。因此 〔(Fe(CN) 〕絡離子比類似的〔Fe(CN) 〕穩定。當較低氧化態為自旋配對而較高氧化態不是自旋配對出現時例外。例如,1.10一菲噦啉-Fe(II)絡合物(低自旋)比高自旋的Fe(Ⅲ)絡合物穩定。這一組的金屬離子主要同含氮和含氧的配位體結合。根據Irving和wiIIiams〔33〕 的研究,一系列類似的二價金屬離子的絡合物形成能力有如下次序:
Mn<Fe<CO<Ni<Cu>Zn
這種次序能用金屬離子半徑從Mn到Zn減小和用晶體場穩定化能從Fe到Cu增加來解釋。zn(II)的d軌道已充滿,所以它在形成絡合物時沒有穩定化能釋放出來。這就是在以後次序改變的原因。如果給予原子是氮或氧,配位數是4,則該次序大體上是正確的;但在同Zn(1I)可形成巧-給予鍵的配位體(如C1。)的情況下,該次序是顛倒的。
中心離子電荷數的影響
對於過渡元素的八面體看配合物來說,中心離子的電荷不同,取代反應的速率會有很大的差別。一般來說,中心離子的電荷數越高,取代反應越慢。例如,同屬於d 構型的Cr 合V 以及同屬於d 構型的Co 合Fe ,其三價金屬離子的配合物與三價相比,取代反應就要慢得多。
對於過渡非金屬的八面體配合物,也有類似的情況,如PF 、SbF 、AsF 等配合物顯示惰性,而AlF 則顯示活性。這是因為中心離子電荷高,對配位體吸引得很牢固,使取代反應難以進行。
d軌道能級的分裂
過渡金屬離子的d軌道,在沒有配體作用時,能量是相同的,當配體以一定方向接近中心金屬離子時,若配體負電荷或偶極子負端電荷是球形分布的,即球殼上的電荷是均勻的,這時若中心離子位於球心,則d軌道上的電子受到配體電荷或偶極子負端電荷的排斥作用是相等的,d軌道的能量比原來自由離子時的能量升高Es,但不發生分裂。如果配體負電荷或偶極子負端電荷不是球形分布,而是位於八面體或四面體各頂點,由於d軌道的構型與角度分布不一樣,距離配體遠近不同,能量升高的程度有所不同。距離較近的d軌道,受到較大的靜電斥力,能量升高較多,高於Es。;另一些距離較遠的d軌道受到的靜電排斥較小,能量升高較低,低於Es,於是便產生了能級的分裂。
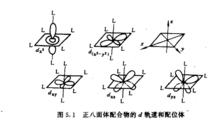
正八面體場中d軌道能級的分裂正八面體配合物,過渡金屬離子位於正八面體中心,現設六個相同的配體L各沿x、y、z三個坐標軸的正、負方向接近中心金屬離子(如圖5.1),d和d—軌道極大值正處於和配體迎頭相碰的位置,受到強烈的靜電排斥作用,使這兩個軌道的能量升高較大,高於Es。而d、d、d的最大值方向,正好都穿插在配體之間,因而受到配體較弱的排斥作用,故這些軌道能量升高較少,低於Es。所以在正八面體場申,中心離子的d軌道分裂為兩組:一組是能量較高的d和d—軌道,叫做e軌道;另一組是能量較低的的d、d、d軌道,叫做t軌道。e和t軌道是分子軌道理論所用的符號。圖5.2表示出八面體場中d軌道能級的分裂。
 中心離子
中心離子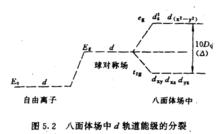 中心離子
中心離子圖5.1 圖5.2
量子力學一個原理指出,在外場作用下,d軌道能量的平均值不變。因此分裂前和分裂後五個d軌道總能量相等。選取球形場(與配位體總電荷相等)中d軌道的能量E。作為零點,則有
2E+3E=0 (5一1)
設e和t軌道的能級間隔為△(△稱為分裂能)將△分為10等分,即A--10Dq,則有
E--E=10D=△ (5—2)
聯立解式(5一1)和(5—2),得e和t軌道的能量
E=-0.4△=-4Dq (5—3)