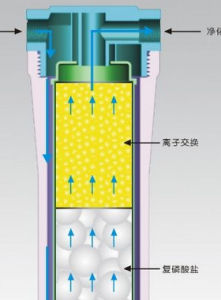
 離子反應
離子反應簡介
1、離子反應的概念
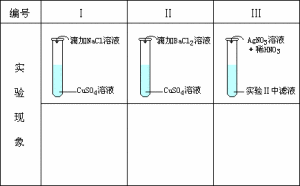
 離子反應試驗
離子反應試驗2、離子反應的特點
離子反應的反應速率快,相應離子間的反應不受其它離子的干擾。3、離子反應的類型
(1)離子互換反應在溶液中酸、鹼、鹽之間互相交換離子的反應,一般為非氧化還原反應。
(2)離子互換反應發生的條件
①生成難溶的物質。如生成BaSO4、AgCl、CaCO3等。
②生成難電離的物質。如生成CH3COOH、H2O、NH3•H2O、HClO等。
③生成揮發性物質。如生成CO2、SO2、H2S等。
只要具備上述三個條件中的一個,離子互換反應即可發生。這是由於溶液中離子間相互作用生成難溶物質、難電離物質、易揮發物質時,都可使溶液中某幾種、自由移動離子濃度減小的緣故。若不能使某幾種自由移動離子濃度減小時,則該離子反應不能發生。如KNO3溶液與NaCl溶液混合後,因無難溶物質、難電離物質、易揮發物質生成,Na+、Cl-、K+、NO濃度都不減少,四種離子共存於溶液中,故不能發生離子反應。
(3)有離子參加的氧化還原反應
①置換反應的離子反應
金屬單質與金屬陽離子之間的置換反應,如Fe與CuSO4溶液的反應,實際上是Fe與Cu2+之間的置換反應。非金屬單質與非金屬陰離子之間的置換反應,如Cl2與NaBr溶液的反應,實際上是Cl2與Br-之間的置換反應。
②其它一些有離子參加的氧化還原反應
如MnO2與濃HCl反應製取Cl2;Cu與FeCl3溶液反應生成FeCl2、CuCl2;Cl2與NaOH溶液反應生成NaCl、NaClO和水等。
這些離子反應發生的條件是:比較強的氧化劑和較強的還原劑反應,生成氧化性較弱的氧化產物和還原性較弱的還原產物。因此掌握一些常見離子的氧化性或還原性的相對強弱,是判斷這一類離子反應能否發生的重要依據。
本質
 驗證離子反應的試驗
驗證離子反應的試驗離子反應發生條件
(1)非氧化還原型的離子反應條件:
a.離子交換型:
例如:(Ag+)+(Cl-)=AgCl↓
離子交換後要有沉澱、氣體、弱電解質三者之一生成才能發生反應。
b.雙水解反應型:
例如:2(Al3+)+(3CO32-)+3H2O=2Al(OH)3沉澱+3CO2氣體
要生成更難溶解的物質或弱電解質才能發生離子反應。
c.絡合反應型:
例如:(Ag+)+2NH3→[Ag(NH3)2]+
生成比簡單離子更穩定的絡離子,離子反應才能進行。
(2)氧化還原型離子反應條件:
在電解質溶液中能滿足“以強制弱”的氧化還原反應規律的反應,離子反應才能進行。
例如:Cl2+(SO32-)+H2O=2Cl-+(SO42-)+2H+
∵氧化性還原性
∴此反應才能進行。
難點:離子在溶液中大量共存的規律。
即:向溶液中有關離子濃度減小的方向進行
判斷原則:在溶液中所有離子之間不能發生任何類型的反應,否則離子不能共存。
例如:生成沉澱的:如Ba2+與SO42-,CO32-;Ag+與Cl-,SO42-
(生成難電離的物質:H+與OH-;CH3COO-與H+;NH4+與OH-;H+與F-)
(生成氣體(揮發性物質)如:H+與CO32-,S2-,SO32-)
發生氧化還原:H+(KMnO4)與I-,S2-;Fe3+與
發生中和反應:Fe3+,Al3+,Cu2+等是在溶液中顯酸性的離子,OH-,CO3-,SO2-,SO3-,ClO4-等在溶液里則顯鹼性,酸鹼中和反應,則不可共存
強氧化性離子:MnO4-Cr2O72-ClO-Fe3+(H+)NO3-
強還原性離子:S2-I-Fe2+HS-Sn2+S2O32-SO32-HSO3-
因發生氧化還原反應無法大量共存
離子反應中,不可以拆開的物質有:單質、氣體、沉澱、水、弱酸、弱鹼、氧化物及絕大部分有機物(有機鹽除外)
常見有色離子:Fe2+:淺綠色 Fe3+:黃色 Cu2+:藍色 MnO4+:紫色……
1.由於發生複分解反應,離子不能大量共存
(1)有氣體產生。例如:CO32—、SO32—、S2—、HCO3—、HSO3—、HS—等易揮發的弱酸的酸根與H+不能大量共存。
(2)有沉澱生成。例如:Ba2+、Ca2+、Mg2+、Ag+等不能與SO42—、CO32—等大量共存;Mg2+、Fe2+、Ag+、Al3+、Zn2+、Cu2+、Fe3+等不能與OH—大量共存;Pb2+與Cl—,Fe2+與S2—、Ca2+與PO43—、Ag+與Cl-、Br-、I—等不能大量共存。
(3)有弱電解質生成。例如:OH—、CH3COO—、PO43—、HPO42—、H2PO4—、F—、ClO—、AlO2—、SiO32—、CN—、C17H35COO—、等與H+不能大量共存;一些酸式弱酸根,例如:HCO3-、HPO42—、HS—、H2PO4—、HSO3—不能與OH—大量共存;NH4+與OH—不能大量共存。
(4)一些容易發生水解的離子,在溶液中的存在是有條件的:
①例如:AlO2—、S2—、CO32—、C6H5O—等必須在鹼性條件下才能在溶液中存在;
②再如:Fe3+、Al3+等必須在酸性條件下才能在溶液中存在。
這兩類離子不能同時存在在同一溶液中,即離子間能發生“雙水解”反應。例如:3AlO2—十Al3+十6H2O=4Al(OH)3↓等
典型雙水解的條件;弱酸跟、弱鹼根離子對應的酸鹼容易從體系中脫離。即生成沉澱、氣體或同時生成兩種沉澱
特點
離子反應的反應速率快,相應離子間的反應不受其它離子的干擾。類型
複分解
在溶液中酸、鹼、鹽之間互相交換離子的反應,一般為非氧化還原反應。離子反應器這類離子反應發生的條件與複分解反應的條件一致,分三種情況:(1)生成難溶的物質
①常見(2)生成難電離的物質
①常見的難電離的物質
離子反應
②反應規律:由強酸制弱酸,由強鹼制弱鹼。如:
鹽酸+Ca(ClO)2溶液H++ClO-=HClO
稀醋酸+苯酚鈉溶液CH3COOH+C6H5O-=CH3COO-+C6H5OH
離子反應示意圖
離子反應示意圖
NH4Cl溶液+NaOH溶液NH4++OH-=NH3·H2O
(3)生成揮發性物質
①常見的揮發性物質有:SO2、CO2、NH3、H2S等。
離子反應
其中SO2、CO2、NH3即是揮發性物質,也是難電離物質(H2SO3、H2CO3、
NH3·H2O)進一步分解的產物,因此,從離子反應的本質上是相同的。
②有些離子反應不是電解質在電離的條件下進行的,不能用離子方程式表示。如:
實驗室制NH3,用固態銨鹽與固體Ca(OH)2反應:
的難溶物有:
離子反應
②當有關離子濃度足夠大時,生成微溶物的反應也能發生,常見的微溶物有CaSO4、Ag2SO4、MgCO3、Ca(OH)2等。
如:Ca2++SO42-=CaSO4↓
③由微溶物生成難溶物的反應也能發生,如:
離子反應示意圖
離子反應示意圖
Ca(OH)2+CO32-=CaCO3↓+2OH-
(微溶) (難溶)
CaSO4+CO32-=CaCO3↓+SO42-
(微溶) (難溶)
離子反應 實驗室制HCl、HF、HNO3用濃硫酸與其鹽反應:
離子反應
但Cu與濃H2SO4的反應不是離子反應。
氧化還原
有些在溶液中進行的離子反應,是由於發生了氧化還原反應,使反應物的某些離子濃度減小。此類離子反應示意圖
離子反應示意圖
反應能否發生取決於有關離子的氧化性、還原性強弱,須滿足由強變弱的原則,即由氧化性和還原性強的性質生成氧化性和還原性弱的物質。主要包括有離子參與的置換反應與其他有離子參與的氧化還原反應。如:
離子反應
其他的離子反應,如鹽類的水解、絡合反應能發生的條件是反應物的某些離子結合成難電離的物質而引起反應物離子濃度的減小。
置換反應的離子反應
金屬單質與金屬陽離子之間的置換反應,如Fe與CuSO4溶液的反應,實際上是Fe與Cu之間的置換反應。非金屬單質與非金屬陰離子之間的置換反應,如Cl2與NaBr溶液的反應,實際上是Cl2與Br之間
離子反應實驗
離子反應實驗
的置換反應。
其它一些有離子參加的氧化還原反應
如MnO2與濃HCl反應製取Cl2;Cu與FeCl3溶液反應生成FeCl2、CuCl2;Cl2與NaOH溶液反應生成NaCl、NaClO和水等。
這些離子反應發生的條件是:比較強的氧化劑和較強的還原劑反應,生成氧化性較弱的氧化產物和還原性較弱的還原產物。因此掌握一些常見離子的氧化性或還原性的相對強弱,是判斷這一類離子反應能否發生的重要依據。
離子互換
①生成難溶的物質。如生成BaSO4、AgCl、CaCO3等。
②生成難電離的物質。如生成CH3COOH、H2O、NH3·H2O、HClO等。
③生成揮發性物質。如生成CO2、SO2、H2S等。
絡合反應
例如:Ag+2NH3→[Ag(NH3)2]
離子反應本質:反應物的某些離子濃度減少。
離子反應發生條件
①生成難溶的物質。如生成BaSO4、AgCl、CaCO3等。
②生成難電離的物質。如生成CH3COOH、H2O、NH3·H2O、HClO等。
③生成揮發性物質。如生成CO2、SO2、H2S等。
只要具備上述三個條件中的一個,離子互換反應即可發生。這是由於溶液中離子間相互作用生成難溶
物質、難電離物質、易揮發物質時,都可使溶液中某幾種、自由移動離子濃度減小的緣故。若不能使某幾種自由移動離子濃度減小時,則該離子反應不能發生。如KNO3溶液與NaCl溶液混合後,因無難溶物質、難電離物質、易揮發物質生成,Na、Cl、K、NO3濃度都不減少,四種離子共存於溶液中,故不能發生離子反應。
(1)非氧化還原型的離子反應條件:
a.離子交換型:
例如:Ag﹢+Cl﹣=AgCl↓
離子交換後要有沉澱、氣體、弱電解質三者之一生成才能發生反應。
b.雙水解反應型:
例如:2Al³﹢+3CO3²﹣+3H2O=2Al(OH)3↓+3CO2↑
要生成更難溶解的物質或弱電解質才能發生離子反應。
c.絡合反應型:
例如:Ag﹢+2NH3→[Ag(NH3)2]
生成比簡單離子更穩定的絡離子,離子反應才能進行。
(2)氧化還原型離子反應條件:
在電解質溶液中能滿足“以強制弱”的氧化還原反應規律的反應,離子反應才能進行。
離子反應條件
離子反應條件
例如:Cl­2+SO3²﹣+H2O=2Cl﹣+SO4²﹣+2H﹢
∵氧化性還原性
∴此反應才能進行。
難點:離子在溶液中大量共存的規律。
即:向溶液中有關離子濃度減小的方向進行
判斷原則:在溶液中所有離子之間不能發生任何類型的反應,否則離子不能共存。
例如:生成沉澱的:如Ba²﹢與SO4²﹣,CO3²﹣;Ag與Cl﹣,SO4²﹣
(生成難電離的物質:H﹢與OH﹣;CH3COO與H﹢;NH4﹢與OH﹣;H﹢與F﹣)
(生成氣體(揮發性物質)如:H與CO3²﹣,S²﹣,SO3²﹣)
發生氧化還原:(H﹢)KMnO4與I﹣,S²﹣;Fe²﹢與Fe³﹢
發生中和反應:Fe²﹢,Al³﹢,Cu²﹢等是在溶液中顯酸性的離子,OH﹣,CO3²
離子反應結構
離子反應結構
;﹣,HCO3﹣,SO3²﹣等在溶液里則顯鹼性,酸鹼中和反應,則不可共存
強氧化性離子:MnO4﹣Cr2O7ClO﹣Fe²﹢(H﹢)NO3﹣
強還原性離子:S²﹣I﹣FeHSSnS2O3SO3²﹣HSO3﹣
因發生氧化還原反應無法大量共存
離子反應中,不可以拆開的物質有:單質、氣體、沉澱、水、弱酸、弱鹼、氧化物及絕大部分有機物(有機鹽除外)
常見有色離子:Fe^3+:棕黃色 Fe^2+:淺綠色 Cu^2+:藍色 MnO4^-:紫色……
1.由於發生複分解反應,離子不能大量共存
(1)有氣體產生。例如:CO3、SO3、S、HCO3、HSO3、HS等易揮發的弱酸的酸根與H+不能大量共存。
(2)有沉澱生成。例如:Ba、Ca、Mg、Ag等不能與SO4、CO3等大量共存;Mg、Fe、Ag、Al、Zn、Cu、Fe等不能與OH大量共存;Pb與Cl,Fe與S、Ca2與PO4、Ag與Cl、Br、I等不能大量共存。
(3)有弱電解質生成。例如:OH﹣、CH3COO﹣、PO4³﹣、HPO4²﹣、H2PO4﹣、F、ClO﹣、AlO、SiO3²﹣、CN、C17H35COO、等與H﹢不能大量共存;一些酸式弱酸根,例如:HCO3﹣、HPO4²﹣、HS、H2PO4﹣、HSO3不能與OH﹣大量共存;NH4與OH不能大量共存。
離子反應器
離子反應器
(4)一些容易發生水解的離子,在溶液中的存在是有條件的:
①例如:AlO2、S²﹣、CO3²﹣、C6H5O等必須在鹼性條件下才能在溶液中存在;
②再如:Fe²﹢、Al³﹢等必須在酸性條件下才能在溶液中存在。
這兩類離子不能同時存在在同一溶液中,即離子間能發生“雙水解”反應。例如:3AlO²﹣十Al³﹢十6H2O=4Al(OH)3↓等
典型雙水解的條件;弱酸根、弱鹼根離子對應的酸鹼容易從體系中脫離。即生成沉澱、氣體或同時生成兩種沉澱
書寫
 離子反應式
離子反應式2、離子方程式的書寫步驟:四步。
“一寫”:首先以客觀事實為依據寫出反應的化學方程式;
“二改”:把易溶於水、易電離物質改寫成離子形式(最關鍵的一步):
“三刪”:刪去方程式兩邊未參加反應的離子;
“四查”:檢查離子方程式兩邊各元素的原子個數和電荷總數是否相等。
3、離子方程式表示的意義:
離子方程式反映了離子反應的實質,它不僅能表示一定物質間的某個反應,而且可以表示同一類型的離子反應。
發生條件
1、複分解型離子反應的條件
 離子反應器
離子反應器(1)生成難溶的物質
①常見的難溶物有:
 離子反應
離子反應②當有關離子濃度足夠大時,生成微溶物的反應也能發生,常見的微溶物有CaSO4、ag2so4、MgCO3、Ca(OH)2等。
如:Ca2++SO42-=CaSO4↓
③由微溶物生成難溶物的反應也能發生,如:
Ca(OH)2+CO32-=CaCO3↓+2OH-
(微溶)(難溶)
CaSO4+CO32-=CaCO3↓+SO42-
(微溶)(難溶)
(2)生成難電離的物質
①常見的難電離的物質
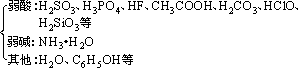 離子反應
離子反應②反應規律:由強酸制弱酸,由強鹼制弱鹼。如:
稀醋酸+苯酚鈉溶液CH3COOH+C6H5O-=CH3COO-+C6H5OH
NH4Cl溶液+NaOH溶液NH4++OH-=NH3·H2O
(3)生成揮發性物質
①常見的揮發性物質有:SO2、CO2、NH3、H2S等。
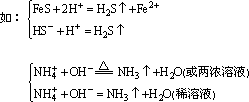 離子反應
離子反應其中SO2、CO2、NH3即是揮發性物質,也是難電離物質(H2SO4、H2CO3、
NH3·H2O)進一步分解的產物,因此,從離子反應的本質上是相同的。
②有些離子反應不是電解質在電離的條件下進行的,不能用離子方程式表示。如:
實驗室制NH3,用固態銨鹽與固體Ca(OH)2反應:
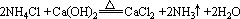 離子反
離子反實驗室制HCl、HF、HNO3用濃硫酸與其鹽反應:
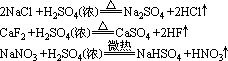 離子反應
離子反應但Cu與濃H2SO4的反應不是離子反應。
2、有離子參與的氧化還原反應的條件
有些在溶液中進行的離子反應,是由於發生了氧化還原反應,使反應物的某些離子濃度減小。此類反應能否發生取決於有關離子的氧化性、還原性強弱,須滿足由強變弱的原則,即由氧化性和還原性強的性質生成氧化性和還原性弱的物質。主要包括有離子參與的置換反應與其他有離子參與的氧化還原反應。如:
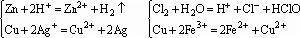 離子反應
離子反應其他的離子反應,如鹽類的水解、絡合反應能發生的條件是反應物的某些離子結合成難電離的物質而引起反應物離子濃度的減小。
離子共存問題匯總
1.由於發生複分解反應,離子不能大量共存。(1)有氣體產生。如CO32-、SO32-、S2-、HCO3-、HSO3-、HS-等易揮發的弱酸的酸根與H+不能大量共存。
(2)有沉澱生成。如Ba2+、Ca2+、Mg2+、Ag+等不能與SO42-、CO32-等大量共存;Mg2+、Fe2+、Ag+、Al3+、Zn2+、Cu2+、Fe3+等不能與OH-大量共存;Pb2+與Cl-,Fe2+與S2-、Ca2+與PO43-、Ag+與I-不能大量共存。
(3)有弱電解質生成。如OH-、CH3COO-、PO43-、HPO42-、H2PO4-、F-、ClO-、AlO2-、SiO32-、CN-、C17H35COO-、等與H+不能大量共存;一些酸式弱酸根如HCO3-、HPO42-、HS-、H2PO4-、HSO3-不能與OH-大量共存;NH4+與OH-不能大量共存。
(4)一些容易發生水解的離子,在溶液中的存在是有條件的。如AlO2-、S2-、CO32-、C6H5O-等必須在鹼性條件下才能在溶液中存在;如Fe3+、Al3+等必須在酸性條件下才能在溶液中存在。這兩類離子不能同時存在在同一溶液中,即離子間能發生“雙水解”反應。如3AlO2-+3Al3++6H2O=4Al(OH)3↓等。
2.由於發生氧化還原反應,離子不能大量共存。
(1)具有較強還原性的離子不能與具有較強氧化性的離子大量共存。如S2-、HS-、SO32-、I-和Fe3+不能大量共存。
(2)在酸性或鹼性的介質中由於發生氧化還原反應而不能大量共存。如MnO4-、Cr2O7-、NO3-、ClO-與S2-、HS-、SO32-、HSO3-、I-、Fe2+等不能大量共存;SO32-和S2-在鹼性條件下可以共存,但在酸性條件下則由於發生2S2-+SO32-+6H+=3S↓+3H2O反應不能共在。H+與S2O32-不能大量共存。
3.能水解的陽離子跟能水解的陰離子在水溶液中不能大量共存(雙水解)。
例:Al3+和HCO3-、CO32-、HS-、S2-、AlO2-、ClO-等;Fe3+與CO32-、HCO3-、AlO2-、ClO-等不能大量共存。
4.溶液中能發生絡合反應的離子不能大量共存。
如Fe2+、Fe3+與SCN-不能大量共存;Fe3+與不能大量共存。
5.審題時應注意題中給出的附加條件。
①酸性溶液(H+)、鹼性溶液(OH-)、能在加入鋁粉後放出可燃氣體的溶液、由水電離出的H+或OH-=1×10-10mol/L的溶液等。
②有色離子MnO4-,Fe3+,Fe2+,Cu2+,Fe(SCN)2+。③MnO4-,NO3-等在酸性條件下具有強氧化性。
④S2O32-在酸性條件下發生氧化還原反應:S2O32-+2H+=S↓+SO2↑+H2O
⑤注意題目要求“大量共存”還是“不能大量共存”。
6.審題時還應特別注意以下幾點:
(1)注意溶液的酸性對離子間發生氧化還原反應的影響。如:Fe2+與NO3-能共存,但在強酸性條件下(即Fe2+、NO3-、H+相遇)不能共存;MnO4-與Cl-在強酸性條件下也不能共存;S2-與SO32-在鈉、鉀鹽時可共存,但在酸性條件下則不能共存。
(2)酸式鹽的含氫弱酸根離子不能與強鹼(OH-)、強酸(H+)共存。
如HCO3-+OH-=CO32-+H2O(HCO3-遇鹼時進一步電離);HCO3-+H+=CO2↑+H2O