概念
在無機鹽工業中,不同離子的兩種鹽(或鹼和鹽、酸和鹽)在液相(或液-固相)中進行離子交換,生成另外兩種鹽(或鹼和鹽、酸和鹽)的反應過程。鹼和鹽、酸和鹽的複分解反應過程,通常分別稱為鹼解和酸解。原理
在複分解反應中,反應物和生成物,被稱為互動鹽對,反應通式為: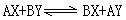
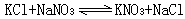
K+ 、Na+ ‖Cl- 、NO婣-H2O
利用四元體系相圖(見相平衡)可對複分解過程中的溶解、結晶、加熱、冷卻以及蒸發和稀釋等操作進行分析,確定合理生產流程和操作條件,以獲得所需產品。四元體系相圖由乾鹽圖和水圖組成,K+ 、Na+ ‖Cl- 、NO婣-H2O四元互動鹽對的相圖(見圖)是其中典型的一例。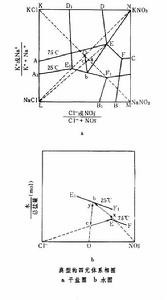 複分解
複分解乾鹽圖表示出四種鹽在不同溫度下的結晶區,例如DEFCN為75℃下KNO3結晶區,LAEFB為75℃下NaCl結晶區。以摩爾%為單位,EF和E1F1分別為 75℃和25℃下KNO3、NaCl兩鹽共飽和線。E、F和E1、F1分別為75℃和25℃下相應的三鹽共飽和點。水圖縱坐標表示體系的水含量,以水/總鹽量(摩爾比)為單位,純水坐標在無窮遠處。這實際上是以一個底面為正方形的長方體作為坐標空間,來表示鹽的溶解度和水含量。
從乾鹽圖上可知:75℃下三鹽共飽和點E的溶液冷卻到25℃時,析出KNO3結晶,溶液組成為b。從水圖上可知:為了使b落在25℃E1F1線上,E溶液必需加水至組分為x,加水量為x-E。25℃下溶液b加入KCl:NaCl=1:1的混合物。其組成落在乾鹽圖上的c點,加熱至75℃,NaCl結晶析出,溶液落到E點。在水圖上,為了滿足循環過程水平衡,溶液b必須先蒸發至濃度為y,蒸去水量為b-y。上述循環過程在乾鹽圖上以EbcE表示,在水圖上以ExbycE表示。
發生的條件
根據複分解反應趨於完成的條件,複分解反應發生需要一定條件。下面從反應物和生成物兩方面,按以下四類反應具體分析複分解反應發生的條件。
(1)酸+鹽→新酸+新鹽
反應物中酸必須是可溶的,生成物中至少有一種物質是氣體或沉澱或水。
如:2HCl+CaCO3=CaCl2+H2O+CO2↑
(2)酸+鹼→鹽+水
反應物中至少有一種是可溶的。
如:H2SO4+Cu(OH)2=CuSO4+2H20
(3)鹽+鹽→兩種新鹽
國中階段反應物中的兩種鹽都是可溶性的,且反應所得的兩種鹽中至少有一種是難溶的。
如:Na2SO4+BaCl2=2NaCl+BaSO4↓
附:兩種鹽(一種為不溶或難溶的不穩定的鹽,另一種可溶)複分解生成更穩定(或趨於穩定)的鹽(反應物和生成物中都有有不溶的鹽)
鹽(不溶或難溶)+鹽=兩種新鹽
BaS+Na2SO4=BaSO4↓+Na2S
BaCO3+Na2SO4=BaSO4↓+Na2CO3
(4)鹽+鹼→新鹽+新鹼
反應物一般都要可溶,生成物中至少有一種是沉澱或氣體(只有氨鹽跟鹼反應才能生成氣體)。
如:2NaOH+CuSO4=Na2SO4+Cu(OH)2↓;NaOH+NH4Cl=NaCl+NH3↑+H2O
Fe(OH)3與NaCl不發生反應
方法指導
概括上述四種類型的複分解反應能夠發生並趨於完成的條件,可分成兩方面記憶掌握。一方面是對反應物的要求:酸鹽、酸鹼一般行,鹽鹽、鹽鹼都需溶;另一方面是對生成物的要求:生成物中有沉澱析出或有氣體放出,或有水生成或難電離的物質生成。這兩方面必須兼顧,才能正確地書寫有關複分解反應的化學方程式。
反應條件
氣體:CaCO3+2HCl=CaCl2+H2O+CO2↑
沉澱:Ca(OH)2+Na2CO3=CaCO3↓+2NaOH
水:H2SO4+2NaOH=Na2SO4+2H2O
難電離:CH3COONa+HCl=CH3COOH+NaCl
條件規律:鹽可溶,生成水or氣or沉,難電離的物質
廣義的複分解反應是生成難電離,難溶和揮發性的物質,如CH3COONa和HCl
套用
利用複分解反應製取所需產品,一般要求作為反應物的兩種鹽在水中溶解度比較大,作為生成物的鹽溶解度比較小,且在一定溫度範圍內能成為固體析出。根據生成物狀態也可有三種情況:①析出的固體結晶就是所需產品。如氯化鉀和硝酸鈉複分解時,在低溫下即可析出硝酸鉀固體結晶。②複分解所得溶液需進一步加工才能得到產品。如碳酸銨和硫酸鈣複分解時,需將碳酸鈣沉澱分離後的溶液進行蒸發,才能得到硫酸銨固體產品。③生成物的兩種鹽都是沉澱,它們的混合物就是產品。如硫酸鋅和硫化鋇複分解時,生成硫化鋅和硫酸鋇兩種鹽的沉澱混合物,經過濾、洗滌和高溫灼燒,而成為白色顏料鋅鋇白(立德粉)。鹽在水溶液中的飽和濃度與溫度有關。除了生成物是溶解度很小的鹽外,複分解反應過程中,原料鹽的一次利用率(或稱轉化率)通常不會很高,需要將分離固體結晶後的母液循環使用,以提高總利用率。 採用複分解反應生成無機鹽,一般是在帶有機械攪拌的槽式反應器中進行,操作可以是間歇的,也可以是連續的。複分解反應生產無機鹽的過程中,常用到過濾、結晶等化工單元操作。