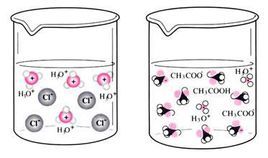
案例
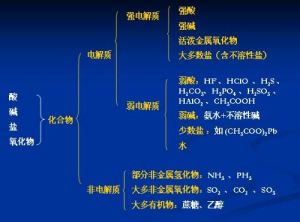 弱電解質
弱電解質弱鹼:一水合氨(氨水)兩性氫氧化物:氫氧化鋁,氫氧化鋅
個別的鹽:如HgCl2、Pb(Ac)2、HgBr2、CdI2等
水:是由強極性鍵構成的極弱的電解質。
不同的弱電解質在水中電離的程度是不同的,一般用電離度和電離常數來表示。
電離度的定義和計算:
電離度——弱電解質在溶液里達電離平衡時,已電離的電解質分數占原來總分子數(包括已電離的和未電離的)的百分數。
電離度(α)=(已電離弱電解質分子數/原弱電解質分子數)*100%=(分子、分母同除以阿氏常數)=(分子、分母同除以溶液體積)
區別
它們的主要區別為:強電解質是可以在水中或熔融狀態下完全電離的物質,在電離過程中,強電解質可電離方程式用“=”來表示。如硫酸:H2SO4=2H++SO42-
但是在弱電解質當中要用可逆符號,如果是多元弱酸要分步電離,如下:
例:CH3COOH CH3COO+H
NH3·H2ONH4+OH
H2OH+OH
多元弱酸分步電離,多元弱鹼一步電離
例:H2CO3 HCO3+H HCO3CO3+ H
電離平衡定義
在一定條件(如溫度、濃度)下,當電解質分子電離成離子的速率和離子重新結合成分子的速率相等時,電離過程就達到了平衡狀態例:CH3COOH的電離平衡的建立過程,開始時c(醋酸)最大,而離子濃度最小——為0,所以弱電解質分子電離成離子的速率從大到小變化;離子結合成電解質分子的速率從小到大變化。
電離平衡特徵
弱電解質的電離平衡屬於化學平衡中的一種,具有以下一些特徵:“逆”——弱電解質的電離是可逆的
“動”——電離平衡是動態平衡
“等”——v(離子化)=v(分子化)≠0
“定”——在電離平衡狀態時,溶液中分子和離子的濃度保持不變。
“變”——電離平衡是相對的、暫時的,當外界條件改變時,平衡就會發生移動
影響因素
內因
電解質的本身的性質。外因
溫度和溶液的濃度等。濃度
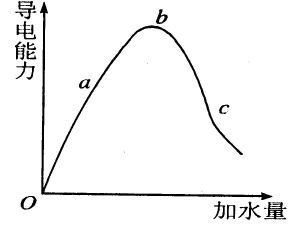 弱電解質濃度的影響
弱電解質濃度的影響濃度(mol/L)0.20.10.001
電離度(%)0.9481.3212.4
可見,電離度隨濃度的降低而增大。(因濃度越稀,離子互相碰撞而結合成分子的機會越少,電離度就越大。)
溫度
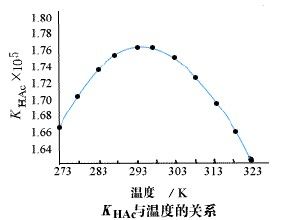 弱電解質溫度的影響
弱電解質溫度的影響因此,用電離度比較幾種電解質的相對強弱時,就當注意所給條件,即濃度和溫度,如不註明溫度通常指25℃。
在相同溫度和濃度時,電離度的大小可以表示弱電解質的相對強弱。
[例3]下列關於電離度α的敘述正確的是(D)
①α與濃度無關;②α值隨溫度升高而增大;③在相同條件下,α值的大小可以表示弱電解質的相對強弱;④α值增大,相應離子濃度一定增大;⑤α值增大相應離子物質的量增大。
A.①②③B.①②④C.③④⑤D.②③
電離常數又叫電離平衡常數,用Ki表示。如醋酸,碳酸和硼酸。其定義為,當弱電解質電離達到平衡時,電離的離子濃度的乘積與未電離的分子濃度的比值叫做該弱電解質的電離平衡常數。一種弱電解質的電離平衡常數隻與溫度有關,而與該弱電解質的濃度無關。因為弱電解質通常為弱酸或弱鹼,所以在化學上,可以用Ka、Kb分別表示弱酸和弱鹼的電離平衡常數。
用HA表示弱酸,則其電離方程式為HA——H++A-,則電離常數Ka=[H]*[A]/HA
電離常數K與電離度α的關係可近似的表示為K=cα2(α平方)其中c為弱電解質溶液的濃度。