“【說明】:此教學設計任務由南京曉莊學院現代教育技術課程老師yqiong參與教師-維基星光計畫進行wiki教學而發布。此詞條為範例詞條,由楊琳琳選定主題並負責、參與現代教育技術課程的所有同學協作共同完成!
基本信息:
科目:化學教學對象:高二學生
課時:二課時教學環境:實驗室
學習者特徵分析:
學生已經掌握電解法和非電解法,強電解法和弱電解法的概念和弱電解法的電離方程式;學習過電解質與非電解質的判斷方法和如何判斷強弱電解質;能正確書寫電離方程式;掌握了電離度的概念及表示的意義。學生在歸納思維能力和邏輯推理能力得到了一定的訓練,這些都是為學好本節提供保障。學生的學習困難在於鹽類水解方程式的書寫和分析,在這些方面是需要教師加以引導的。學習內容分析:
本節內容包括使學生理解鹽類水解的本質及鹽類水解對溶液酸、鹼性的影響及變化規律。 學習鹽類水解的離子方程式與化學方程式。其中教學重點是鹽類水解的本質,理解強酸弱鹼鹽和強鹼弱酸鹽的水解的規律。這一節也重於培養學生分析問題的能力,使學生學會透過現象看本質。並且進一步培養學生歸納思維能力和邏輯推理能力。
教學目標分析
(知識與技能,過程與方法,情感態度與價值觀)
1、知識目標:掌握鹽水解的本質,並能分析判斷鹽溶液的酸鹼性。
2、能力目標:通過分析綜合、歸納演繹、類比等科學抽象活動,培養創新能力和學習能力;通過實驗設計、實驗觀測和實驗操作等培養科學實踐能力。
3、德育目標:培養實事求是、理論聯繫實際的科學態度,樹立辯證唯物主義觀點。
4、情感目標:通過科學探索過程培養學生學習化學的興趣。
教學重點與難點
教學重點:鹽類水解的本質,理解強酸弱鹼鹽和強鹼弱酸鹽的水解的規律。教學難點:鹽類水解方程式的書寫和分析。
教學策略的選擇與設計
科學程式法是遵循科學發現過程的一般程式,力求讓學生在化學實驗的科學實踐活動中,像科學家那樣獨立地探索認識客觀世界物質變化的規律、獲得化學知識,從而能動地培養學生的創新能力和實踐能力,全面提高與發展學生科學素質的一種方法。用於本節也可以簡單稱為啟發式實驗引導法。科學程式法是按照提出問題,分析問題,解決問題的科學程式進行教學的。本課的教學過程分為學習準備,提出問題,解決問題,知識系統化,知識的套用,小結等步驟。在解決問題的過程中培養創新能力和科學實踐能力。
教學過程與媒體資源
板書:一、鹽類的水解:
講解:CH3COONa溶於水之後,完全電離。(因為CH3COONa是強電解質。)
引導:把CH3COONa溶於水之後,溶液中存在哪些電離平衡?
講解:我們知道,CH3COOH是一種弱酸,在溶液中部分電離,溶液中既然存在CH3COO-和H+,根據,可逆反應,反應物和生成物同時共存,那么就一定有CH3COOH。
講解:把⑴⑵⑶式聯立,可得到CH3COONa+H2OCH3COOH+NaOH
這說明CH3COONa溶於水後,反應有NaOH生成,所以溶液顯鹼性。
| 教學階段 | 教師活動 | 學生活動 | 設計意圖 | 媒體及資源準備 |
| 複習提問 | 當溶液中,c(H+)=c(OH-)中性,常溫下,pH=7 c(H+)<c(OH-)鹼性,常溫下,pH>7 c(H+)<c(OH-)酸性,常溫下,pH<7 酸的溶液顯酸性,鹼的溶液顯鹼性,那么酸與鹼反應生成的鹽,溶液顯什麼性? 講解:同學們,實驗是我們探求未知問題的好方法,下面我們做一個實驗來看看,將鹽溶於水後,溶液的酸鹼性到底如何呢? 實驗:①取少量CH3COONa溶於水,滴加幾滴酚酞試劑,觀察顏色變化。 ②取少量NH4Cl溶於水,滴加幾滴紫色石蕊試劑,觀察顏色變化。 ③取少量NaCl,溶於水,找一名同學測一下pH值。 註:對於②可以做一個對比,清水中加幾滴紫色石蕊試劑,進行比較。 結論:①CH3COONa鹼性②NH4Cl酸性③NaCl中性 | 學生實驗:用PH試紙檢驗Na2CO3、Al2(SO4)3、KNO3溶液的酸鹼性。 討論:由上述實驗結果分析,鹽溶液的酸鹼性與生成該鹽的酸和鹼的強弱有什麼關係? 小結:鹽的組成與鹽溶液酸鹼性的關係: 強鹼弱酸鹽的水溶液顯鹼性 強酸弱鹼鹽的水溶液顯酸性 強酸強鹼鹽的水溶液顯中性 | 使學生明白鹽的組成與鹽溶液酸鹼性的關係 | 課件顯示如下問題: (1)為什麼CH3COONa水溶液呈鹼性呢? (2)為什麼NH4Cl水溶液呈酸性? (3)通常情況下,水既能電離出H+又能電離出OH-,為什麼既不顯酸性也不顯鹼性? 準備好實驗需要的試劑及儀器 |
| 提出問題並分析 | 講解:CH3COONa溶於水之後,完全電離。(因為CH3COONa是強電解質。) 引導:把CH3COONa溶於水之後,溶液中存在哪些電離平衡? 講解:我們知道,CH3COOH是一種弱酸,在溶液中部分電離,溶液中既然存在CH3COO-和H+,根據,可逆反應,反應物和生成物同時共存,那么就一定有CH3COOH。 講解:把⑴⑵⑶式聯立,可得到CH3COONa+H2OCH3COOH+NaOH 這說明CH3COONa溶於水後,反應有NaOH生成,所以溶液顯鹼性。 | 同學活動:請同學們討論一下第一個問題,為什麼CH3COONa水溶液呈鹼性呢?醋酸鈉、氯化鈉都是鹽,是強電解質,他們溶於水完全電離成離子,電離出的離子中既沒有氫離子,也沒有氫氧根離子,而純水中[H+]=[OH-],顯中性。而實際上醋酸鈉顯鹼性,即[H+]<[OH-],氯化銨溶液顯酸性,即[H+]>[OH-] | 研究不同類鹽的水溶液酸鹼性不同的原因。 | 板書:一、鹽類的水解: 板書:CH3COONa═CH3COO-+Na+………(1) H2OH++OH-………⑵ CH3COO-+H+CH3COOH………⑶ 水解方程式:CH3COONa+H2OCH3COOH+NaOH |
| 深入講解 | 講解:隨著CH3COONa的加入,對水的電離有什麼影響呢?促進了水的電離,可以看作是使水分解了。醋酸鈉與水反應的實質是:醋酸鈉電離出的醋酸根離子和水電離出的氫離子結合生成弱電解質醋酸的過程。 | 學生活動:把上述化學方程式改寫成離子方程式。 | 學習書寫水解方程式 | 板書:CH3COO- + H2O CH3COOH + OH- 課件顯示說明:鹽類水解方程式書寫注意點 1、鹽類水解是可逆反應,寫方程式要用“” 2、一般鹽類水解程度很小,生成的弱酸或弱鹼濃度很小,通常生成氣體或沉澱也不發生水解,書寫時產物不用“↑”和“↓”。 3、多元弱酸生成的鹽水解時,生成弱酸過程應分步表示,以第一步為主。 |
| 舉例學習 | 說明:1、只有弱酸的陰離子或弱鹼的陽離子才能與H+ 或 OH-結合生成弱電解質。 2、鹽類水解使水的電離平衡發生了移動,並使溶液呈酸性或鹼性。 3、鹽類水解反應是酸鹼中和反應的逆反應。 | 練習:試分析NH4Cl水解呈酸性的原因 | 講解:CH3COONa可以看作是弱酸CH3COOH和強鹼NaOH生成的鹽,這種鹽叫做強鹼弱酸鹽。 | 板書:1、鹽類水解定義: 在溶液中鹽電離出來的離子跟水所電離出來的H+ 或 OH-結合生成弱電解質的反應,叫做鹽類的水解。(在溶液中由鹽電離出的弱酸的陰離子或弱鹼的陽離子跟水電離出的氫離子或氫氧根離子結合生成弱電解質弱酸或弱鹼,破壞了水的電離平衡,使其平衡向右移動,引起氫離子或氫氧根離子濃度的變化。) 酸 + 鹼中和生成鹽 + 水 板書:2、鹽類水解的本質: 弱酸的陰離子和弱鹼的陽離子和水電離出的H+或OH-離子結合生成弱電解質,促進了水的電離。 |
| 學習重點1 | 講解:由強鹼和弱酸反應生成的鹽,稱為強鹼弱酸鹽,含有以上弱酸根的鹽,常會發生水解。 分析:對於多元弱酸來說,水解要分步寫。 提問:該水解反應能放出CO2嗎?不能,因為這樣的水解程度都很小。 | 討論:分析Na2CO3的水解過程,寫出有關反應的離子方程式。 練習:寫出K2S水解的化學方程式和離子方程式。 | 總結:NH4Cl可以看作是強酸HCl和弱鹼NH3·H2O反應生成的鹽,我們把這種鹽叫做強酸弱鹼鹽。類似這樣的鹽還有Al2(SO4)3、FeCl3、CuSO4等。 | 板書:二、鹽類水解的類型 1、強鹼弱酸鹽水解(CH3COONa)CO32-,PO43-,S2-,SO32-,ClO-,F- 板書: Na2CO3的水解 第一步: CO32-+H2O HCO3-+OH-(主要) 第二步: HCO3- +H2O H2CO3 +OH- |
| 講解:由於一水合氨和醋酸的電離度相近,因此銨離子、醋酸跟離子水解程度相近,從二溶液顯中性。 小結:由於NaCl電離出的Na+和Cl-都不能與水電離出來的H+ 或 OH-結合生成弱電解質,所以強鹼強酸鹽不能水解,不會破壞水的電離平衡,因此其溶液顯中性。 | 練習:寫出Al2(SO4)3水解的離子方程式。 Al3+ + 3H2O Al(OH)3 + 3H+ Cu(NO3)2 Al2(SO4)3 (NH4)2SO4 AgNO3 討論:以NaCl為例,說明強鹼強酸鹽能否水解。 | 學習其他水解類型 | 板書:2、強酸弱鹼鹽(NH4Cl)Al3+,Fe3+,Cu2+ 板書:3、強酸強鹼鹽、難溶於水的鹽不水解 板書:4、弱酸弱鹼鹽(NH4Ac) | |
| 難點 | 過渡:那么,我們在書寫水解離子方程式時,要注意哪些問題? 討論:請大家根據我們剛才書寫水解方程式的方法,說說書寫時,要注意哪些問題? | 練習:FeCl3、NaHCO3水解的離子方程式及化學方程式。 | 板書:5、混合鹽溶液(酸式鹽溶液) | |
| 總結提升 | 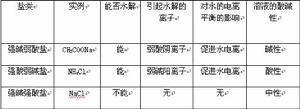 表格 表格 | 投影總結:各類鹽水解的比較。 | ||
| 學習重點2 | 過渡:水解反應有什麼套用呢? 引入:大家知道泡沫滅火器的滅火原理嗎?它就是利用Al2(SO4)3和NaHCO3溶液反應,產生二氧化碳來滅火的。那么Al2(SO4)3和NaHCO3是怎么反應? 分析:Al3+易結合水電離出的OH-,HCO3-易結合水電離出的H+,兩者在水溶液中會發生強烈的雙水解,反應進行得很徹底。Al3++ 3HCO3-= Al(OH)3↓+3CO2↑(反應前有水參加,反應後又有水生成) | 討論:Al3+和HCO3-在水溶液中能大量共存嗎? | 學習影響水解的因素 | 板書:三、影響水解的因素: 內因:鹽類本身的性質 這是影響鹽類水解的內在因素。組成鹽的酸或鹼越弱,鹽的水解程度越大,其鹽溶液的酸性或鹼性就越強。“無弱不水解,有弱即水解,越弱越水解,誰強顯誰性” 外因:1、溫度 由於鹽的水解作用是中和反應的逆反應,所以鹽的水解是吸熱反應,溫度升高,水解程度增大。 |
| 講述:在我們的生活中,有時也會碰到一些問題或觀察到一些現象,你有沒有想過要去分析它,找出其中的原因呢?比如,有一次我在實驗室配製FeCl3溶液時,放置一段時間後溶液竟然變渾濁,大家能解釋一下是什麼原因?(FeCl3發生了水解,生成了Fe(OH)3,使溶液變渾濁了。) 設疑:那么怎么配製FeCl3溶液?怎么防止它的水解? (Fe3+ + 3H2OFe(OH)3↓+3 H+ ,往配製的溶液中加入少量稀鹽酸 ,使平衡向逆進行,可以防止FeCl3的水解) | 思考:怎么配製FeCl2溶液?K2CO3和NH4Cl這兩種肥料能混合使用?混合使用的效果好嗎? | 2、濃度 溶液濃度越小,實際上是增加了水的量,可使平衡相正反應方向移動,使鹽的水解程度增大。(最好用勒沙特例原理中濃度同時減小的原理來解釋) 3、溶液的酸鹼性 鹽類水解後,溶液會呈現不同的酸鹼性。因此,控制溶液的酸鹼性可以促進或抑制鹽的水解。如在配製FeCl3溶液時常加入少量鹽酸來抑制FeCl3水解。 鹽的離子與水中的氫離子或氫氧根離子結合的能力的大小,組成鹽的酸或鹼的越弱,鹽的水解程度越大。 | ||
| 總結提升 |  表格 表格 | 板書:四、水解的套用 | ||
| 例題 | 判斷溶液的pH值:1、強酸弱鹼鹽、強鹼弱酸鹽等。 2、如何對比NaX、nay、NaZ的鹼性。已知;酸性HX》HY》HZ 3、如何對比碳酸鈉、碳酸氫鈉的鹼性。 4、氯化鋁、偏鋁酸鈉、氯化鐵分別蒸乾灼燒後的產物是什麼? |
教學流程圖:
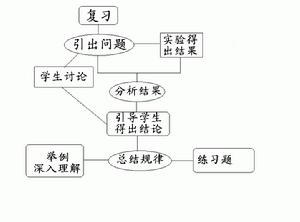 流程圖
流程圖教學評價
小結:指導學生從獲得知識和套用的方法兩方面做本課小結。第一,理解掌握了鹽水解的實質是鹽的離子與水電離出來的H+或OH-生成弱電解質的反應;第二,了解了提出問題、分析問題(建立假說)、解決問題(驗證假說)的科學探索過程的方法和程式。
參考資源
2.安徽馬鞍山市紅星中學化學組 陳婧《鹽類的水解》教案
3. 高中化學人教版教材選修四化學反應原理第三章第三節
備註與反思
在設計學習流程的時候應提高學生的參與度,以此增強學生的主動學習能力;並且老師在講解的同時可以適當加入些趣味性,使學生課堂效率最大化是我們仍需努力的目標。
花了4個小時完成這項案例,在完成這一項時已經很輕鬆了,雖然說是認真完成的,但是肯定存在很多不足,希望下次還有機會可以更正。
