鹽類的水解
一.定義
在溶液中,強鹼弱酸鹽,強酸弱鹼鹽或弱酸弱鹼鹽電離出來的離子與水電離出來的H+與OH-生成弱電解質的過程叫做鹽類水解。越弱越水解酸性溶液ph越小越水解,鹼性溶液ph越大越水解。
二.鹽類的水解
(一)鹽類的水解的分類:(二)鹽類水解的類型
(三)相關內容
⒈實質:在溶液中,由於鹽電離出的離子於水電離出的離子結合生成弱電解質,從而破壞了水的電離平衡,使水的電離平衡向電離的方向移動,顯示出不同濃度的酸性、鹼性或中性。
⒉規律:難溶不水解,有弱才水解,無弱不水解;誰弱誰水解,越弱越水解,都弱都水解;誰強顯誰性,同強顯中性,弱弱具體定;越熱越水解,越稀越水解。
(即鹽的構成中出現弱鹼陽離子或弱酸根陰離子,該鹽就會水解;這些離子對應的鹼或酸越弱,水解程度越大,溶液的pH變化越大;水解後溶液的酸鹼性由構成該鹽離子對應的酸和鹼相對強弱決定,酸強顯酸性,鹼強顯鹼性。)
⒌特點:
⑴水解反應和中和反應處於動態平衡,水解進行程度很小。
⑵水解反應為吸熱反應。
⑶鹽類溶解於水,以電離為主,水解為輔。
⑷多元弱酸根離子分步水解,以第一步為主。
⒍鹽類水解的離子反應方程式
因為鹽類的水解是微弱且可逆的,在書寫其水解離子反應方程式時應注意以下幾點:
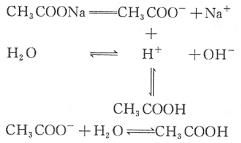 示意圖
示意圖⑴套用可逆符號表示,
⑵一般生成物中不出現沉澱和氣體,因此在書寫水解離子方程式時不標“↓”“↑”
⑶多元弱酸根的水解分步進行且步步難,以第一步水解為主。
⒎水解平衡的因素
影響水解平衡進行程度最主要因素是鹽本身的性質。
①組成鹽的酸根對應的酸越弱,水解程度越大,鹼性就越強,PH越大;
②組成鹽的陽離子對應的鹼越弱,水解程度越大,酸性越強,PH越小;
外界條件對平衡移動也有影響,移動方向應符合勒夏特列原理,下面以NH4+水解為例:
①.溫度:水解反應為吸熱反應,升溫平衡右移,水解程度增大。
②.濃度:改變平衡體系中每一種物質的濃度,都可使平衡移動。鹽的濃度越小,水解程度越大。
③.溶液的酸鹼度:加入酸或鹼能促進或抑制鹽類的水解。例如:水解呈酸性的鹽溶液,若加入鹼,就會中和溶液中的H+,使平衡向水解的方向移動而促進水解;若加入酸,則抑制水解。
同種水解相互抑制,不同水解相互促進。(酸式水解——水解生成H+;鹼式水解——水解生成OH-)
三.鹽類的水解實例
(一).以NH4+ + H2O=可逆號=NH3·H2O + H+ 為例:(二)以CH3COO- + H2O=可逆號=CH3COOH + OH- 為例:
四、水解過程中的守恆問題
(以NaHCO3水解為例,HCO3-既水解又電離)NaHCO3溶液中存在Na+,H+,OH-,HCO3-,CO32-,H2CO3
①.電荷守恆——溶液中所有陽離子帶的正電荷等於所有陰離子帶的負電荷(即溶液呈電中性)
c(Na+)+c(H+)===c(OH-)+2c(CO32-)+c(HCO3-)
②.物料守恆(原子守恆)——溶液中某些離子能水解或電離,這些粒子中某些原子總數不變,某些原子數目之比不變
n(Na):n(C)==1:1所以c(Na+)===c(HCO3-)+c(CO32-)+c(H2CO3)
③.水的電離守恆(質子守恆)(也可以由上述兩式相減得到,最好由上述兩式相減得到)
c(H+)+c(H2CO3)===c(OH-)+c(CO32-)
五、雙水解反應
雙水解反應——一種鹽的陽離子水解顯酸性,一種鹽的陰離子水解顯鹼性,當兩種鹽溶液混合時,由於H+和OH-結合生成水而相互促進水解,使水解程度變大甚至完全進行的反應。①.完全雙水解反應
離子方程式用==表示,標明↑↓,離子間不能大量共存
種類:Al3+與CO32-HCO3-S2-,HS-,亞硫酸氫根,偏鋁酸根
Fe3+與CO32-HCO3-
2Al3++3S2-+6H2O===Al(OH)3↓+3H2S↑
②.不完全雙水解反應
離子方程式用可逆符號,不標明↑↓,離子間可以大量共存
種類:NH4+與CO32-HCO3-S2-,HS-,CH3COO-等弱酸根陰離子
③.並非水解能夠相互促進的鹽都能發生雙水解反應
有的是發生複分解反應——Na2S+CuSO4===Na2SO4+CuS↓
有的是發生氧化還原反應——2FeCl3+Na2S===2FeCl2+S↓+2NaCl或2FeCl3+3Na2S===2FeS↓+S↓+6NaCl
PS:離子間不能大量共存的條件——生成沉澱、氣體、水、微溶物、弱電解質;發生氧化還原、完全雙水解反應
(多元弱酸的酸式酸根離子不能與H+或OH-離子共存;在酸性條件下,NO3-和MnO4-具有強氧化性)
六、鹽溶液蒸乾後
①.鹽水解生成揮發性酸,蒸乾後得到其氫氧化物,如FeCl3蒸乾後得到Fe(OH)3,如繼續蒸則最終產物是Fe2O3 分析
分析鹽水解生成難揮發性酸或強鹼,蒸乾後得到原溶質,如Na2SO4
②.陰陽離子均易水解的鹽,蒸乾後得不到任何物質,如(NH4)2S
③.易被氧化的物質,蒸乾後得到其氧化產物,如Na2SO3溶液蒸乾後得到Na2SO4
④.受熱易分解的物質,蒸乾後得到其分解產物,如Mg(HCO3)2蒸乾後得到Mg(OH)2
七、鹽類水解的套用
①.配製FeCl3溶液——將FeCl3先溶於鹽酸,再加水稀釋②.製備Fe(OH)3膠體——向沸水中滴加FeCl3溶液,並加熱至沸騰以促進Fe3+水解
Fe3++3H2O=加熱=Fe(OH)3(膠體)+3H+
③.泡沫滅火器——Al3++3HCO3-===Al(OH)3↓+3CO2↑
④.純鹼作洗滌劑——加熱促進其水解,鹼性增加,去污能力增強
八、鹽類水解內容補充
①.電離大於水解(溶液呈酸性)的離子——亞硫酸氫根,磷酸二氫根,草酸氫根HC2O4-硫酸氫根。
其餘多元弱酸的酸式酸根離子均是水解大於電離(溶液呈鹼性)
水解大於電離,硫氫根、碳酸氫根;
②.pH酸<;酸式水解的鹽鹼>;鹼式水解的鹽
③.酸根離子相應的酸越弱,其強鹼弱酸鹽的鹼性越強
如酸性Al(OH)3NaHCO3(碳酸根對應的酸為HCO3-)
九、鹽類水解的規律
有弱才水解,無弱不水解,越弱越水解,都弱都水解,誰強顯誰性。⒈強酸和弱鹼生成的鹽水解,溶液呈酸性。
⒉強鹼和弱酸生成的鹽水解,溶液呈鹼性。
⒊強酸強鹼不水解,溶液呈中性(不一定,如NaHSO4)
⒋弱酸弱鹼鹽強烈水解。
⒌強酸酸式鹽,取決於酸式根離子的電離程度和水解程度的相對大小
十、酸式鹽
酸式鹽定義:電離時生成的陽離子(易失電子)除金屬離子【或NH4+(有金屬離子性質)】外還有氫離子,陰離子(易得電子)為酸根離子的鹽。1、強酸強鹼酸式鹽
只電離不水解的酸式鹽,顯強酸性。如:NaHSO4
2、弱酸強鹼酸式鹽
既電離又水解的酸式鹽,酸鹼性視其電離和水解的相對強度而定。
⑴電離>;水解
如NaH2PO4,NaHSO4,顯酸性。
⑵電離<;水解
如NaHCO3,NaHS,顯鹼性。
3、酸式鹽的考察:比較溶液離子濃度,比較溶液酸鹼性等問題。
鹽類水解原理及套用
⒈鹽類水解實質
鹽電離出來的弱酸根或弱鹼的陽離子跟水電離出來的微粒H+或OH-生成弱酸或弱鹼,從而促進水的電離。⒉利用
用純鹼溶液清洗油污時,加熱可以增強其去污能力。在配置易水解的鹽溶液時,如氯化鐵溶液為了抑制水解可加入少量的鹽酸,以防止溶液渾濁。
有些鹽水解可生成難溶於水的氫氧化物成膠體且無毒,可用作淨水劑,如鋁鹽鐵鹽,明礬(硫酸鋁鉀)。鹽類水解方程式的書寫規律
⑴鹽類水解的程度一般遠小於其逆過程——中和反應,所以水解反套用可逆符號表示,生成的產物少,生成物一般不標“↓”或“↑”,也不將生成物如H2CO3、NH3·H2O等寫成其分解產物的形式。
⑵鹽類水解的離子反應遵循電荷原則,所以陽離子水解,H+多餘,溶液呈酸性,陰離子水解,OH-多餘,溶液呈鹼性。
 示意圖
示意圖如NH4Cl溶液中:c(NH4+)+c(H+)=c(Cl—)+c(OH—)
如Na2CO3溶液中:c(Na+)+c(H+)=2c(CO32—)+c(HCO3—)+c(OH—)
⑶多元弱酸相應的鹽水解與多元弱酸的電離一樣是分步進行的,每一步水解分別用一個水解離子方程式表示,不能連等,不能合併,每一步的水解程度也與分步電離一樣,呈現大幅下降的趨勢,如Na3PO4的水解依次為:
PO43-+H2OHPO42-+OH-
HPO42-+H2OH2PO4-+OH-
H2PO4-+H2OH3PO4+OH-
⑷多元鹼的鹽也是分步水解的,由於中間過程複雜,可寫成一步,如:
Al3++3H2O〓Al(OH)3+3H+
⑸多元弱酸的酸式鹽,其酸式根離子在水溶液中既有電離產生H+的可能,又有水解產生OH-的可能,溶液的酸鹼性由電離和水解的相對強弱來決定,即當電離趨勢大於水解趨勢時,溶液呈酸性,應該用電離方程式來表示酸性的產生(如NaH2PO4、NaHSO3等),當電離趨勢小於水解趨勢時,溶液呈鹼性,應該用相應的水解方程式來表示鹼性的產生(如Na2HPO4、NaHCO3、NaHS等)。鹽類的水解的例題
例1.下列離子反應方程式中,不屬於水解反應的是
A.NH4++H2O=可逆號=NH3·H2O+H+
B.NH3·H2O=可逆號=NH4++OH-
C.HCO3-+H2O=可逆號=H3O++CO32-
D.AlO2-+2H2O=可逆號=Al(OH)3+OH-
分析與解答:
B、C選項是電離方程式,水解反應後一定有弱酸或弱鹼。
答案:B、C
例2.若室溫時,0.1mol/L的鹽NaX溶液的pH=9。則該溶液中起水解的X-占全部的X-的
A.0.01% B.0.09% C.1.0% D.無法確定
分析與解答:
NaX的水解反應為:X-+H2O=可逆號=HX+OH-,起水解反應c(X-)=c(OH—)=1×10-5mol/L,水解率為=0.01%
答案:A
例3.25℃時,相同物質的量濃度下列溶液中,水的電離程度由大到小排列順序正確的是( )
①KNO3 ②NaOH ③CH3COONH4 ④NH4Cl
A.①>;②>;③>;④ B.④>;③>;①>;②
C.③>;④>;②>;① D.③>;④>;①>;②
分析與解答:
①KNO3為強酸強鹼鹽,在水溶液中電離出的K和NO對水的電離平衡無影響②NaOH為強鹼在水溶液中電離出的OH對水的電離起抑制作用,使水的電離程度減小③CH3COONH4為弱酸弱鹼鹽,在水溶液中電離出的NH和CH3COO均可以發生水解生成弱電解質NH3·H2O和CH3COOH,並能相互促進,使水解程度加大從而使水的電離程度加大。④NH4Cl為強酸弱鹼鹽,在水溶液中電離出的NH可以發生水解生成弱電解質NH3·H2O,促進水的電離,但在相同濃度下其水解程度要小於CH3COONH4,該溶液中水的電離程度小於CH3COONH4中的水的電離程度。
答案D
小結:酸、鹼對水的電離起抑制作用,鹽類的水解對水的電離起促進作用。
例4.SOCl2為一種易揮發的液體,當其與水相遇時劇烈反應,生成一種能使品紅褪色的氣體寫出該反應的化學反應方程式。
分析與解答:
SOCl2中S為+4價,O為-2價,Cl為-1價,當其與水相遇時所生成的使品紅褪色的氣體應是SO2,本反應不是氧化——還原反應。故其反應方程式為SOCl2+H2O=SO2-+2HCl,本題雖屬於水解反應,但有別於鹽類的水解,而且根據題目所述劇烈反應,可以判斷該反應進行的徹底故用“=”表示之。參考練習
⒈常溫下,0.1mol/L的下列溶液中,水的電離程度大小排列順序正確的是
①AlCl3 ②KNO3 ③NaOH ④NH3·H2O
A.①>;②>;③>;④ B.①>;②>;④>;③
C.③>;④>;②>;① D.①=②=③=④
⒉已知0.1mol/LNaHCO3溶液的pH為8.4,0.1mol/LNa2CO3溶液的pH為11.4,則NaHCO3溶液中由H2O電離出c(OH-)是Na2CO3溶液中由H2O電離出的c(OH-)的
A.3倍 B.1/3倍
C.103倍 D.10-3倍
⒊物質的量濃度相同的下列溶液:①Na2CO3 ②NaHCO3 ③H2CO3 ④(NH4)2CO3 ⑤NH4HCO3中c(CO32-)由小到大的排列順序為
A.⑤④③②① B.③⑤②④①
C.③②⑤④① D.③⑤④②①
⒋下列微粒中,不能促進水電離的是( )
A.所有離子中半徑最小的離子
B.含有的電子數和質子數均與Na+相同,共含有5個原子核的微粒
C.還原性最弱的非金屬陰離子
D.含有2個原子核,10個電子的陰離子
⒌能證明醋酸是一種弱電解質的實驗是( )
A.醋和水以任意比例溶解
B.中和10ml0.1mol/L的CH3COOH須用0.1mol/L10mlNaOH溶液
C.1mol/LCH3COONa溶液的pH大約是9
D.1mol/LCH3COOH溶液能使石蕊試液變紅
參考答案:
1B
2D
3B
4AD
5C一、鹽類水解實質的理解
1.鹽類水解實質是鹽中的弱離子(弱酸的陰離子或弱鹼的陽離子)與水電離出的H+或OH-生成弱電解質(即弱酸或弱鹼)從而促進了水的電離。
2.鹽溶液水解顯酸性或鹼性,也正是由於鹽中的弱離子與水電離出的H+或OH-生成弱電解質,從而使得溶液中獨立存在的C(H+)不等於C(OH-)。
3.若鹽水解顯酸性,則溶液中的C(H+)全都來自於水的電離;
若鹽水解顯鹼性,則溶液中的C(OH-)全都來自於水的電離。
例1:室溫下pH=9的NaOH溶液和pH=9的CH3COONa溶液中,由水電離產生的C(OH-)分別為amol/L和bmol/L;則a/b=
解析pH=9的NaOH溶液,水的電離平衡受到抑制,溶液中的OH-主要來自NaOH,H+來自於水的電離,所以C(OH-)水=10-9mol/L;
pH=9的CH3COONa溶液,OH-完全來自於水的電離,即C(OH-)水=10-5mol/L。
答案:1:10000二、影響鹽類水解程度大小的因素
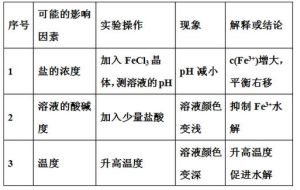
1.內因:即鹽中弱離子與水電離出的H+或OH-結合生成的弱電解質越難電離(電離常數越小),對水的電離平衡的促進作用就越大,鹽的水解程度就越大。
例2:已知乙酸(HA)的酸性比甲酸(HB)弱,在物質的量濃度均為0.1mol/L的NaA和NaB混合溶液中,下列排序正確的是____
A.c(OH-)>c(HA)>c(HB)>c(H+)
B.c(OH-)>c(A-)>c(B-)>c(H+)
C.c(OH-)>c(B-)>c(A-)>c(H+)
D.c(OH-)>c(HB)>c(HA)>c(H+)
解析根據“越弱越水解”的原則,NaA的水解比NaB水解程度大,所以溶液中的c(HA)>c(HB),c(A-)
 表
表答案:A
2.外因:
⑴溫度:升溫,促進水解
水解反應是中和反應的逆反應,所以水解反應為吸熱反應。
⑵濃度:
加水,促進水解;但對於水解顯酸性的鹽,酸性下降;對於水解顯鹼性的鹽,鹼性下降。
加鹽,水解平衡向正向移動,但鹽的水解程度下降,對於水解顯酸性的鹽,溶液的酸性增強,對於水解顯鹼性的鹽,溶液的鹼性增強。
⑶酸、鹼
對於水解顯酸性的鹽,加酸會抑制水解,加鹼會促進水解;
對於水解顯鹼性的鹽,加鹼會抑制水解,加酸會促進水解;
⑷鹽
水解顯酸性的鹽溶液與對於水解顯鹼性的鹽溶液混合,兩種鹽水解互促水解均顯酸(鹼)性的鹽溶液混合,兩種鹽水解一般互相抑制。
例3:比較下列溶液的pH(填“>;”、“<;”、“=”)
⑴0.1mol/LNH4Cl溶液0.01mo1/LNH4Cl溶液;
⑵0.1mol/LNa2CO3溶液0.1mol/LNaHCO3溶液;
⑶25℃、1mol/LFeCl3溶液__80℃、1mol/LFeCl3溶液。
解析⑴NH4Cl溶液越稀,水解程度越大,但酸性減弱;
⑵由於CO32-水解產生HCO3-,HCO3-水解產生H2CO3分子,酸性H2CO3>HCO3-,所以CO32-的水解程度大於HCO3-;

