簡介
1.定義:在溶液中鹽的離子跟水所電離出來的H+或OH-生成弱電解質的過程叫做鹽類的水解。
2.條件:鹽必須溶於水,鹽必須能電離出弱酸根離子或弱鹼陽離子。
3.實質:弱電解質的生成,破壞了水的電離,促進水的電離平衡發生移動的過程。
4.規律:難溶不水解,有弱才水解,無弱不水解;誰弱誰水解,越弱越水解,都弱都水解;誰強顯誰性(適用於正鹽),同強顯中性,弱弱具體定;越弱越水解,越熱越水解,越稀越水解。
(即鹽的構成中出現弱鹼陽離子或弱酸根陰離子,該鹽就會水解;這些離子對應的鹼或酸越弱,水解程度越大,溶液的pH變化越大;水解後溶液的酸鹼性由構成該鹽離子對應的酸和鹼相對強弱決定,酸強顯酸性,鹼強顯鹼性。)
5.特點:
(1)水解反應和中和反應處於動態平衡,水解進行程度很小。
(2)水解反應為吸熱反應。
(3)鹽類溶解於水,以電離為主,水解為輔。
(4)多元弱酸根離子分步水解,以第一步為主。
6.鹽類水解的離子反應方程式
因為鹽類的水解是微弱且可逆的,在書寫其水解離子反應方程式時應注意以下幾點:
(1)套用可逆符號表示,
(2)由於鹽類的水解程度通常很小,因此在書寫水解離子方程式時不標“↓”“↑”,但是如果存在雙水解的情況,通常需要標註“↓”“↑”,且可逆符號要換成等於號。
(3)多元弱酸根的水解分步進行且步步難,以第一步水解為主。
7.水解平衡的因素
影響水解平衡進行程度最主要因素是鹽本身的性質。
①組成鹽的酸根對應的酸越弱,水解程度越大,鹼性就越強,PH越大;
②組成鹽的陽離子對應的鹼越弱,水解程度越大,酸性越強,PH越小;
外界條件對平衡移動也有影響,移動方向應符合勒夏特列原理,下面以NH4+水解為例:
①.溫度:水解反應為吸熱反應,升溫平衡右移,水解程度增大。
②.濃度:改變平衡體系中每一種物質的濃度,都可使平衡移動。鹽的濃度越小,水解程度越大。
③.溶液的酸鹼度:加入酸或鹼能促進或抑制鹽類的水解。例如:水解呈酸性的鹽溶液,若加入鹼,就會中和溶液中的H+,使平衡向水解的方向移動而促進水解;若加入酸,則抑制水解。
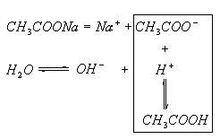 醋酸鈉水解
醋酸鈉水解同種水解相互抑制,不同水解相互促進。(酸式水解——水解生成H+;鹼式水解——水解生成OH-)
水解實例
(一).以NH4+ + H2O=可逆號=NH3·H2O+ H+ 為例:
| 條件 | c(NH4+) | c(NH3·H2O) | c(H+) | c(OH-) | pH | 水解程度 | 平衡移動方向 |
| 加熱 | 減少 | 增大 | 增大 | 減少 | 減小 | 增大 | 正向 |
| 加水 | 減少 | 減少 | 減少 | 增大 | 增大 | 增大 | 正向 |
| 通入 氨氣 | 增大 | 增大 | 減少 | 增大 | 增大 | 減少 | 逆向 |
| 加入少量NH4Cl固體 | 增大 | 增大 | 增大 | 減少 | 減小 | 減少 | 正向 |
| 通入 氯化氫 | 增大 | 減少 | 增大 | 減少 | 減小 | 減少 | 逆向 |
| 加入少量 NaOH 固體 | 減少 | 增大 | 減少 | 增大 | 增大 | 增大 | 正向 |
(二)以CH3COO- + H2O=可逆號=CH3COOH + OH- 為例:
| 條件 | c(CH3COO-) | c(CH3COOH) | c(OH-) | c(H+) | pH | 水解程度 | 平衡移動方向 |
| 加熱 | 減少 | 增大 | 增大 | 減少 | 增大 | 增大 | 正向 |
| 加水 | 減少 | 減少 | 減少 | 增大 | 減小 | 增大 | 正向 |
| 加入冰醋酸 | 增大 | 增大 | 減少 | 增大 | 減小 | 減少 | 逆向 |
| 加入少量醋酸鈉固體 | 增大 | 增大 | 增大 | 減少 | 增大 | 減少 | 正向 |
| 通入少量 氯化氫 | 減少 | 增大 | 減少 | 增大 | 減小 | 增大 | 正向 |
| 加入 NaOH 固體 | 增大 | 減少 | 增大 | 減少 | 增大 | 減少 | 逆向 |
(以NaHCO3水解為例,HCO3-既水解又電離)
NaHCO3溶液中存在Na+,H+,OH-,HCO3-,CO32-,H2CO3
①.電荷守恆——溶液中所有陽離子帶的正電荷等於所有陰離子帶的負電荷(即溶液呈電中性)
c(Na+)+c(H+)===c(OH-)+2c(CO32-)+c(HCO3-)
②.物料守恆(原子守恆)——溶液中某些離子能水解或電離,這些粒子中某些原子總數不變,某些原子數目之比不變
n(Na):n(C)==1:1 所以 c(Na+)===c(HCO3-)+c(CO32-)+c(H2CO3)
③.水的電離守恆(質子守恆)(也可以由上述兩式相減得到,最好由上述兩式相減得到)
c(H+)+c(H2CO3)===c(OH-)+c(CO32-)
如純鹼溶液中c(H+)水=c(OH-)水
c(H+)水=c(HCO3-)+2c(H2co3)+c(H+)
所以c(OH-)水=c(HCO3-)+2c(H2CO3)+c(H+)
雙水解反應
雙水解反應——一種鹽的陽離子水解顯酸性,一種鹽的陰離子水解顯鹼性,當兩種鹽溶液混合時,由於H+和OH-結合生成水而相互促進水解,使水解程度變大甚至完全進行的反應。
①.完全雙水解反應
離子方程式用==表示,標明↑↓,離子間不能大量共存
種類:Al3+與CO32- HCO3- S2-,HS-,亞硫酸氫根,偏鋁酸根
Fe3+與CO32- HCO3-
2Al3++3S2-+6H2O===Al(OH)3↓+3H2S↑
②.不完全雙水解反應
離子方程式用可逆符號,不標明↑↓,離子間可以大量共存
種類:NH4+與CO32- HCO3- S2-,HS-,CH3COO-等弱酸根陰離子
③.並非水解能夠相互促進的鹽都能發生雙水解反應
有的是發生複分解反應——Na2S+CuSO4===Na2SO4+CuS↓
有的是發生氧化還原反應——2FeCl3+Na2S===2FeCl2+S↓+2NaCl或2FeCl3+3Na2S===2FeS↓+S↓+6NaCl
PS:離子間不能大量共存的條件——生成沉澱、氣體、水、微溶物、弱電解質;發生氧化還原、完全雙水解反應
(多元弱酸的酸式酸根離子不能與H+或OH-離子共存;在酸性條件下,NO3-和MnO4-具有強氧化性)
蒸乾產物
鹽溶液蒸乾後得到的物質
①.水解生成揮發性酸的鹽溶液,蒸乾後得到鹽相應的氫氧化物,如FeCl3溶液蒸乾後得到Fe(OH)3,故蒸乾時應通入HCl。(只有HCl會揮發)
水解生成難揮發性酸或強鹼的鹽溶液,蒸乾後得到原溶質,如Na2SO4溶液。
②.陰陽離子均易水解的鹽,蒸乾後得不到任何物質,如(NH4)2S溶液。
③.易被氧化的物質,蒸乾後得到其氧化產物,如Na2SO3溶液蒸乾後得到Na2SO4固體。
④.受熱易分解的物質,蒸乾後得到其分解產物,如NaHCO3溶液蒸乾後得到Na2CO3固體。( Mg(HCO3)2先變成MgCO3再變成了Mg(OH)2是後者溶解度更小的緣由。
水解原理的套用
判斷鹽溶液酸鹼性
如醋酸鈉溶液中,因醋酸根水解,所以溶液顯鹼性。
判斷溶液中離子濃度大小
以醋酸鈉溶液為例,鈉離子不水解,濃度最高,醋酸根微弱水解,濃度第二,水電離出的氫離子氫氧根一樣多,但由於醋酸根與氫離子結合,導致氫離子濃度最低。C(Na+)>C(CH3COO-)>C(OH-)>C(H+)
工業、農業、生產生活、社會實踐中的套用
①.配製FeCl3溶液——將FeCl3先溶於鹽酸,再加水稀釋
②.製備Fe(OH)3膠體——向沸水中滴加FeCl3溶液,並加熱至沸騰以促進Fe3+水解
Fe3++3H2O=加熱=Fe(OH)3(膠體)+3H+
③.泡沫滅火器——Al3++3HCO3-===Al(OH)3↓+3CO2↑
④.純鹼作洗滌劑——加熱促進其水解,鹼性增加,去污能力增強
⑤.解釋生活和生產中的一些化學現象,如明礬淨水[KAl(SO4)2·12H2O],化肥使用等
⑥加熱某鹽溶液時,要考慮鹽類的水解,如濃縮氯化鐵 氯化鋁溶液得到氫氧化物,灼燒的金屬氧化物
內容補充
①.電離大於水解(溶液呈酸性)的離子——亞硫酸氫根,磷酸二氫根,草酸氫根HC2O4-。
其餘多元弱酸的酸式酸根離子均是水解大於電離(溶液呈鹼性)
水解大於電離,硫氫根、碳酸氫根;
②.pH 酸<酸式水解的鹽 鹼>鹼式水解的鹽
③.酸根離子相應的酸越弱,其強鹼弱酸鹽的鹼性越強
如酸性 Al(OH)3NaHCO3 (碳酸根對應的酸為HCO3-)
九、鹽類水解的規律
有弱就水解,
無弱不水解。
越弱越水解,
都弱雙水解。
誰強顯誰性,
同強顯中性。
(多元弱酸水解,以第一步電離為主。)
1.強酸和弱鹼生成的鹽水解,溶液呈酸性。
2.強鹼和弱酸生成的鹽水解,溶液呈鹼性。
3.強酸強鹼不水解,溶液通常呈中性(不一定)
4.弱酸弱鹼鹽強烈水解(強烈是相對的)。
5.水解程度與水解生成的弱電解質有關,(產物)越弱越水解。
6.強酸酸式鹽,取決於酸式根離子的電離程度和水解程度的相對大小(與電離以及水解平衡常數有關)
影響因素
影響鹽類水解程度大小的因素
1.內因:即鹽中弱離子與水電離出的H+或OH-結合生成的弱電解質越難電離(電離常數越小),對水的電離平衡的促進作用就越大,鹽的水解程度就越大。
例2:已知乙酸(HA)的酸性比甲酸(HB)弱,在物質的量濃度均為0.1mol/L的NaA和NaB混合溶液中,下列排序正確的是____
A.c(OH-)>c(HA)>c(HB)>c(H+)
B.c(OH-)>c(A-)>c(B-)>c(H+)
C.c(OH-)>c(B-)>c(A-)>c(H+)
D.c(OH-)>c(HB)>c(HA)>c(H+)
解析根據“越弱越水解”的原則,NaA的水解比NaB水解程度大,所以溶液中的c(HA)>c(HB),c(A-)
答案:A
2.外因:
(1)溫度:升溫,促進水解
水解反應是中和反應的逆反應,所以水解反應為吸熱反應。
(2)濃度:
加水,促進水解;但對於水解顯酸性的鹽,酸性下降;對於水解顯鹼性的鹽,鹼性下降。
加鹽,水解平衡向正向移動,但鹽的水解程度下降,對於水解顯酸性的鹽,溶液的酸性增強,對於水解顯鹼性的鹽,溶液的鹼性增強。
(3)酸、鹼
對於水解顯酸性的鹽,加酸會抑制水解,加鹼會促進水解;
對於水解顯鹼性的鹽,加鹼會抑制水解,加酸會促進水解;
(4)鹽
水解顯酸性的鹽溶液與水解顯鹼性的鹽溶液混合,兩種鹽水解互促水解。
均顯酸(鹼)性的鹽溶液混合,兩種鹽水解一般互相抑制。
例3:比較下列溶液的pH(填“>”、“<”、“=”)
(1)0.1mol/LNH4Cl溶液 0.01mo1/LNH4Cl溶液;
(2)0.1mol/LNa2CO3溶液 0.1mol/LNaHCO3溶液;
(3)25℃、1mol/LFeCl3溶液__80℃、1mol/LFeCl3溶液。
解析(1)NH4Cl溶液越稀,水解程度越大,但酸性減弱;
(2)由於CO32-水解產生HCO3-,HCO3-水解產生H2CO3分子,酸性H2CO3>HCO3-,所以CO32-的水解程度大於HCO3-;