簡介
兩個氮原子以分子氮形式與金屬絡合而成的化合物(見配位化合物)。氮分子的化學性質比較遲鈍,不易與許多化學試劑發生反應。1965年人們發現六氨合釕(Ⅲ)可以與一氧化氮反應,生成【Ru(NH3)5N2】2+,驗明是兩個氮原子以分子氮形式與釕原子絡合而成,從此開始研究分子氮與過渡金屬形成的絡合物。
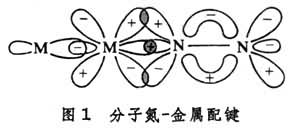
氮分子的電子構型與一氧化碳的電子構型很相似,氮分子絡合的金屬化合物很少,羰基金屬種類很多,這是因為氮分子的三鍵比一氧化碳的三鍵穩定,只是在過渡金屬(見過渡元素)處於低價狀態,有較強的π反饋情況下,M—N匉N 鍵才能得到穩定(圖1)。
分子氮絡合的金屬一般為ⅣB到ⅦB族的過渡金屬。一般分子氮絡合物不穩定,低價金屬容易被還原,絡合物上的氮分子容易游離。最常見的絡合方式是端基一頭絡合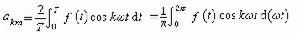 ,還有兩頭絡合
,還有兩頭絡合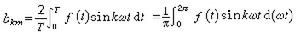 ;較少見的是側基絡合
;較少見的是側基絡合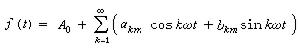 和雙側絡合
和雙側絡合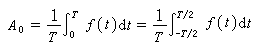 。為了穩定低價過渡金屬,需要有其他配位體同時存在,如膦、雙膦、環戊二烯基、羰基苯等。
。為了穩定低價過渡金屬,需要有其他配位體同時存在,如膦、雙膦、環戊二烯基、羰基苯等。
分子氮絡合物中的氮的活化程度常以其紅外光譜特徵波數的多少來衡量。氮在游離分子 N呏N 中的鍵距為1.0976埃,紅外伸縮波數為2000~2200厘米-1。分子氮被絡合後,鍵距拉長,伸縮波數變小,鍵距為1.35埃,紅外伸縮波數最低可到1600厘米-1。
合成方法
分子氮絡合物的合成方法,有直接和間接兩類。直接法是先製得有其他配位體絡合的金屬,然後與分子氮作用。這個方法接近於固氮酶在細胞內的固氮過程。自然界中發現的固氮酶的輔基含有鐵、鉬、硫等,它們能在常壓下把氮分子結合起來,然後在細胞環境條件下把氮還原成氨。許多合成的分子氮絡合物難以達到這後一過程,即一旦形成分子氮絡合物,金屬對氮的活化作用便不夠,遇到還原條件,氮依然以分子狀態逸出,或者分子氮絡合物被還原成一些含氮化合物,如肼或氨,而金屬喪失了再與氮絡合的可能。因此,人工合成的分子氮絡合物不能作為催化過程的中間體,不能進行催化固氮的反應。例如雙(五甲基環戊二烯基)鋯的分子氮絡合物【(C5Me5)2ZrN2】2N2(圖2 ) 的分子氮用兩種方式與鋯結合,一種是兩頭端基絡合,另一種是單頭端基絡合。這個分子氮絡合物與質子酸反應,只有兩個氮分子被還原成肼,其餘以氮氣形式逸出。
的分子氮用兩種方式與鋯結合,一種是兩頭端基絡合,另一種是單頭端基絡合。這個分子氮絡合物與質子酸反應,只有兩個氮分子被還原成肼,其餘以氮氣形式逸出。
一些分子氮絡合物可由重氮化合物或其他含氮化合物經化學反應而間接製得,例如,雙三苯基膦氫氯合釕RuHCl(PPh3)2是先通過硼烷重氮鹽反應,製得含有Ru—N匉N—B鍵的分子氮絡合物,然後間接製得。它們是一些比較穩定的化合物,N匉N鍵的紅外伸縮波數為2147厘米-1,不易釋放出氮氣。
此外還有一些分子氮與金屬晶體的絡合物,例如鎳絡氮Ni(N2)x,其氮分子基本保持原有分子氮的性質,不屬金屬有機化合物的範圍。