氫鍵的特徵
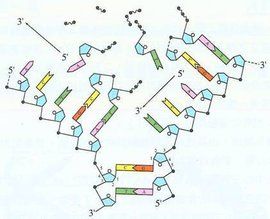 氫鍵
氫鍵弱作用力,與分子間力相當,小於40kJ·mol-1;
有方向性(Y的孤對電子有方向),有飽和性(H+排斥可能與Y電子云相吸引的其它H+)。
鍵能
氫鍵的結合能是2—8千卡(Kcal)。氫鍵是一種比分子間作用力(范德華力)稍強,比共價鍵和離子鍵弱很多的相互作用。其穩定性弱於共價鍵和離子鍵。
氫鍵鍵能大多在25-40kJ/mol之間。一般認為鍵能<25kJ/mol的氫鍵屬於較弱氫鍵,鍵能在25-40kJ/mol的屬於中等強度氫鍵,而鍵能>40kJ/mol的氫鍵則是較強氫鍵。曾經有一度認為最強的氫鍵是[HF2]中的FH…F鍵,計算出的鍵能大約為169kJ/mol。而事實上,用相同方法計算甲酸和氟離子間的[HCO2H…F]氫鍵鍵能,結果要比HF2的高出大約30kJ/mol。
常見氫鍵的平均鍵能數據為:
F—H … :F (155 kJ/mol 或 40 kcal/mol)O—H … :N (29 kJ/mol 或 6.9 kcal/mol)O—H … :O (21 kJ/mol 或 5.0 kcal/mol)N—H … :N (13 kJ/mol 或 3.1 kcal/mol)N—H … :O (8 kJ/mol 或 1.9 kcal/mol)HO—H … :OH3(18 kJ/mol或 4.3 kcal/mol)
概念辨析
關於氫鍵,論壇爭論最多的在於不同筆者對氫鍵與分子間作用力從屬關係的爭論。
傳統定義,將分子間作用力定義為:“分子的永久偶極和瞬間偶極引起的弱靜電相互作用”。隨著研究的深入,發現了許多用現有分子間作用力的作用機理無法說明的現象。比如鹵鍵,有機汞鹵化物時觀察到分子內鹵素原子與汞原子之間存在長距離弱的共價相互作用力,從而引入二級價鍵力(secondary valence forces)的概念。
現在學術上,已經不再用“分子間作用力”來涵蓋全部的弱相互作用,而是用更準確術語“次級鍵”。氫鍵、范德華力、鹽鍵、疏水作用力、芳環堆積作用、鹵鍵都統稱為“次級鍵”。
氫鍵是否屬於分子間作用力取決於對”分子間作用力“的定義。如果“分子間作用力”繼續被狹義指代“分子的永久偶極和瞬間偶極引起的弱靜電相互作用”。這樣氫鍵與分子間作用力性質也不完全相同,量子力學計算方法也不完全同……,更像並列關係,氫鍵就不屬於分子間作用力。而我們目前國內普通化學教材、百科大辭典等,就是這個定義,就是狹義指代范德華力。
如果”分子作用力“定義指代一切分子的相互作用(這個定義也包括了長程和短程的相互作用),那么氫鍵也屬於分子間作用力,不僅氫鍵屬於,離子鍵力也屬於分子間作用力。《高分子界面科學》一書,張開教授認為引力常數項可將各種極化能(偶極、誘導和氫鍵能)歸併為一項來計算從這一角度出發,范德華力偶極矩相互作用係數可擴大範圍寫成靜電相互作用係數。這樣得到了關於靜電力的廣義范德華力。這樣分子間相互作用的分類一些文獻也有報導。《流體的熱物理化學性質—對應態原理及其套用》作者項紅衛教授認為分子作用勢能的三個類型統稱范德華力,包括定向力、誘導力和色散力,定向力來源於偶極矩產生的引力包括電荷、偶極和四級矩其相互作用由玻爾茲曼權重因子按1/kT冪指數展開可得到平均勢能函式。電荷、偶極和四級矩這些類型的相互作用十分相似均可認為服從Berthelot規律。由於色散力不會產生誘導作用,實際誘導相互作用按靜電力比例修正。
 氫鍵示意圖
氫鍵示意圖張季爽和申成對於HF量子計算表明,氫鍵的形成至少四種不同類型的相互作用,1.HF偶極矩的取向力;2.HF分子最高被占用軌道與另一分子最低空餘軌道發生軌道重疊和電荷轉移作用,即類共價鍵。3,分子間電子云的排斥作用。4.分子間的誘導偶極作用,非常微弱。氫鍵的本質也是靜電相互作用,主要是偶極作用能和靜電作用能近似可以用廣義范德華力計算式計算,氫鍵作用是氫鍵力的幾何平均值服從Berthelot規律。
由此來看,氫鍵包含”分子間作用力“集合所構成的”元素“,兩個集合有交集。但是氫鍵還具有它所不具有的特徵軌道重疊與電荷轉移。
超強氫鍵具有類似共價鍵本質,在學術上有爭議,必須和分子間作用力加以區分。
很多弱相互作用,既存在於分子內又存在於分子間(從量子化學角度來看);而且可以向化學鍵轉化。所以筆者建議用更嚴格的辭彙統稱為“次級鍵”,而不再用分子間作用力來涵蓋全部的弱相互作用。
另外,由於存在爭議,其從屬概念的辨析取決於對”分子間作用“的基本定義。而加州大學伯克利分校的John M. Prausnitz指出:”我們對分子間作用力認識遠遠不夠,目前只局限於簡單理想情況“。 筆者認為因此在基礎教育,比如中學教育,不必嚴格區分從屬關係,重點在於了解性質。無論說氫鍵屬於或不屬於分子間作用力都不算錯誤。要將分子間作用力和氫鍵概念的辨析從屬關係的考試題可以從考試中剔除(考誰屬於誰是沒有意義的),可以休矣!學生更重要的在於了解,氫鍵的特性以及幾何平均關係、不嚴格飽和性和方向性、熔沸點、溶解度影響、穩定性以及π氫鍵等等。因為我們對分子間作用力認識遠遠不夠……
我們可以參見2011IUPAC對氫鍵的重新定義來看。
氫鍵是比我們以為的要更加模糊的實體。IUPAC的成員之一、印度科技大學的高塔姆·丹瑟拉朱表示:“它同明顯的邊界之間沒有相互關係。”
丹瑟拉朱表示,這不僅僅與語義學有關。一個新的定義將對抗化學家們普遍接受的一種有關氫鍵什麼時候、在什麼地方出現的誤解,並且鼓勵他們思考氫鍵在新的環境——比如考慮到形成有機分子並採用一種以前認為不可能的反應方式下的影響。探索這條道路可能有助於我們研發出更加便宜的、更加環保的有機物,遠離目前對有毒的、昂貴且包含了珍貴金屬元素的催化劑的依賴。
重新定義
 氫鍵研究
氫鍵研究多數定義是傳統鮑林定義,2011年IUPAC給出了重新定義。
氫鍵就是鍵合於一個分子或分子碎片X—H上的氫原子與另外一個原子或原子團之間形成的吸引力,有分子間氫鍵和分子內氫鍵之分,其X的電負性比氫原子強。可表示為X—H……Y—Z 。“……”是氫鍵。 X—H是氫鍵供體,Y是氫鍵受體,Y可以是分子、離子以及分子片段。受體Y必須是富電子的,可以是含孤對電子的Y原子也可以是含π鍵的Y分子,X,Y相同原子時形成對稱氫鍵。
IUPAC給出的氫鍵六準則:
氫鍵形成主要源於靜電作用力。由於供體和受體之間電荷遷移產生靜電相互作用,導致H原子核Y原子之間形成部分共價鍵,共價鍵的形成由離散作用所引起。
X與氫原子間形成正常的共價鍵X—H是極性鍵。H……Y的強度隨X電負性增加而增加。
X—H……Y之間的二面角是直線或接近180度。氫鍵越強H……Y距離越短。
氫鍵形成使得X—H距離增長,結構變化反映在X—H紅外伸縮頻率紅移。且增加X—H伸縮振動的紅外吸收有效截面。X—H……Y中X—H鍵長增加得越多,H……Y氫鍵就越牢固,一些新的振動模式也相繼形成。
NMR譜中X—H……Y—Z氫鍵的形成導致X和Y原子之間氫鍵自鏇-自鏇耦合以及核Overhauser效應增強氫鍵還產生特徵NMR信號,X—H上H原子質子去禁止。
氫鍵的吉布斯自由能大於體系熱能。
規則1指出,氫鍵源於靜電作用,色散相互作用不再認為是氫鍵,而規則6是為弱氫鍵提供能量判斷的底線。IUPAC規則指出,氫鍵形成可以看做質子遷移反應杯部分激活的先兆。氫鍵網狀結構表現出來的協同現象,導致氫鍵性質不具備按隊相加性。 氫鍵在成鍵方向的最優選擇影響晶體的結構堆積模式。氫鍵電荷遷移估算表明氫鍵相互作用能與供體和受體間電荷遷移程度密切相關。通過對氫鍵體系電荷密度拓撲分析,X,Y原子間會顯示一條連線X、Y以及鍵臨界點的鍵徑。
定義來源於:
Definition of the hydrogen bond (IUPAC Recommendations 2011)
Elangannan Arunan1*, Gautam R. Desiraju2, Roger A. Klein3, Joanna Sadlej4, Steve Scheiner5, Ibon Alkorta6, David C. Clary7, Robert H. Crabtree8, Joseph J. Dannenberg9, Pavel Hobza10, Henrik G. Kjaergaard11, Anthony C. Legon12, Benedetta Mennucci13 and David J. Nesbitt14
1 Department of Inorganic and Physical Chemistry, Indian Institute of Science, Bangalore 560012, India
2 Solid State and Structural Chemistry Unit, Indian Institute of Science, Bangalore 560012, India
3 30 Kimberley Road, Chesterton, Cambridge, CB4 1HH, UK
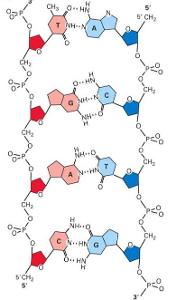 氫鍵示意圖
氫鍵示意圖4 Department of Chemistry, Laboratory of Intermolecular Interactions, University of Warsaw, Warsaw, PL-02093, Poland
5 Department of Chemistry and Biochemistry, 0300 Old Main Hall, Utah State University, Logan, UT 84322, USA
6 Medicinal Chemistry Institute, Juan de la Cierva 3, Madrid E-28006, Spain
7 Department of Physical and Theoretical Chemistry, Oxford University, South Parks Road, Oxford OX1 3QZ, UK
8 Department of Chemistry, 225 Prospect Street, Yale University, New Haven, CT 06511-8499 USA
9 Department of Chemistry and Biochemistry, City University of New York, Hunter College, 695 Park Avenue, New York, NY 10065, USA
10 Institute of Organic and Biochemistry, Academy of Sciences of Czech Republic, Flemingovo nam 2, Praha CZ 16610, Czech Republic
11 Department of Chemistry, University of Copenhagen, Universitetsparken 5, DK-2100 Copenhagen , Denmark
12 School of Chemistry, University of Bristol, Bristol BS8 1TS, UK
13 Department of Chemistry, University of Pisa, Via Risorgimento 35 Pisa 1-56125, Italy
14 Department of Chemistry and Biochemistry, University of Colorado, Boulder, CO 80309, USA
相關報導
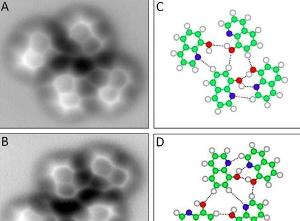
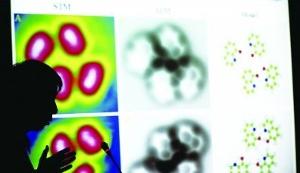
2013年即將過去,這一年中,從分子結構到遙遠的星球,科學界繼續帶給人們眾多驚奇,以下便是《自然》雜誌評選的年度圖片。運用原子力顯微鏡,來自中國科學院的紹興籍科學家裘曉輝和他的隊友們首次成功捕捉到了氫鍵的圖像。圖中加了黃色標示的即為氫鍵。
 氫鍵
氫鍵