反應速率
reaction rate化學反應體系中各物質濃度隨時間的變化率,即化學反應過程進行的快慢。在化學反應過程中,當外界條件(如溫度、體積)固定時,反應體系中各物質的濃度是隨時間變化的,反應物的濃度逐漸減小 ,而產物的濃度則逐漸增加[1]。但是反應速率是隨時間變化的 ,在某一時刻的反應速率叫作瞬時反應速率 ,一般以摩爾/(分米3·秒)為單位。對下列的計量反應:
aA+bB→cC+dD
反應速率r可以如圖表示。式中 〔A〕、〔B〕、〔C〕、〔D〕為物質A、B、C、D的濃度;t為時間;a、b、c、d分別為物質A、B、C、D的計量係數。
測定反應速率的最常用的實驗方法是把某一參加反應的物質的濃度對反應時間作圖,再從所得曲線求出某一時刻的斜率,此即瞬時反應速率。
在恆溫條件下,反應速率隨參加反應的各物質的濃度而變化,在一般情況下只和反應物濃度有關,例如碘化氫氣相合成反應:H2+I2→2HI,它的速率方程是:
r=k〔H2〕〔I2〕實驗證明,這是一個二級反應,式中k叫作速率常數,它的大小與反應物的濃度無關,用它可以表征一個反應體系的速率,k與r的意義是不同的。
反應速度的比為反應物和生成物的係數比,即V(A):V(B):V(C):V(D)=a:b:c:d
正文
化學反應過程進行的快慢。在反應過程中,當外界條件(如溫度、體積)固定時,參加反應的各物質濃度隨時間而變化,反應物的濃度減小而產物的濃度則增加。因此,可以用濃度隨時間的改變率來表示反應速率,一般以摩爾/(分米·秒)為單位。對於下列的計量反應:aA+bB─→cC+dD
反應速率r可以表示如下:
測定反應速率的最常用的實驗方法是把某一參加反應的物質的濃度對反應時間作圖,再從所得曲線求出某一時刻的斜率,此即瞬時反應速率,反應速率是隨時間而變的。
速率方程 在恆溫的條件下,反應速率隨參加反應的各物質的濃度而變化。這種變化的函式關係叫做速率方程,最常見的形式是:

對於一個常見的計量反應,速率方程只能由實驗確定,因此反應級數是經驗的數值。例如碘化氫氣相合成反應:H2+I2─→2HI被實驗證明是二級反應,因此,它的速率方程是:
r=k【H2】【I2】
但是,也有許多非簡單級數的反應,它們的反應機理大都是複雜的,例如溴化氫的氣相合成反應的速率方程是:
速率常數k可以用來表征一個反應體系的速率,因為它不受物質濃度的影響。一般文獻中列出的是化學反應在某一溫度的速率常數 k的值而不是速率r的值。k的單位隨反應級數的不同而異。例如一級反應的 k的單位是秒,而二級反應的k的單位則是分米/(摩爾·秒)。
化學反應的速率差別極大。慢的反應的速率所用時間單位可以年計,例如放射性元素鐳衰變為氡的一級反應要經過 1690年才能進行一半,這相當於速率常數k=1.3×10秒。但快的反應的時間單位常可以秒、毫秒甚至更短的時間計算。例如,用0.1Μ強酸滴定0.1Μ強鹼的反應在10秒內即能完成一半,這相當於k的數量級為10分米/(摩爾·秒)。一般而言, 當k值大於10時,該反應即可稱為快速反應。這類反應過去稱為瞬時反應,其速率無法測量,因為把反應物混合起來的時間比反應的時間還長。但是近20~30年來,由於測量技術的進步,發現在瞬時反應中反應速率的差別也是很大的。研究這類反應的動力學,現在常被稱為快速反應動力學。
半壽期 原則上說,除零級反應(反應速率與濃度無關的反應,常發生在氣、固體表面上)外,欲使反應進行完全,需要無限長的時間。這可以從一級反應速率方程的積分式〔ln(c0/c)=kt0〕看出。因此,如果用反應時間表示反應速率,只能取反應物起始濃度c0消耗至某一給定百分率所需的時間,最常用“半壽期”,就是相應於 c=c0/2的反應時間。如上例中的1690年,就是鐳衰變為氡反應的半壽期。
半壽期與反應速率常數k的關係,隨反應級數的不同而異,一級反應的半壽期是t┩=0.6932/k,與起始濃度無關。因此,改變反應物的起始濃度並不能使完成一定轉化率的時間縮短。二級以上的反應的半壽期則依賴於反應物的起始濃度。對於二級反應,半壽期與反應物的起始濃度呈反比。日常所謂的“反應進行完全”是指反應已進行到這樣的階段,即利用檢測手段已無法檢出其反應體系中物質濃度的變化。
決定速率的步驟 對於一串連續進行的反應體系來說,其總包反應的速率往往由一個或幾個元反應的動力學特性參數來確定,而與其他元反應的動力學特性參數無關。因此,前一類元反應是該總包反應的決定速率的步驟。
一般說來,在一串連續進行的反應中,決定速率步驟的是最難進行的反應。例如,對於連續進行的一級反應:
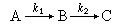
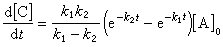
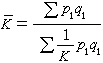
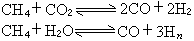 是決定速率的步驟。可以用類似的方法證明,在k1》k2條件下,得到:
是決定速率的步驟。可以用類似的方法證明,在k1》k2條件下,得到: 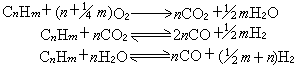
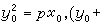 為決定速率的步驟,由此可見,決定速率的步驟是由相應的反應速率常數較小的元反應決定的。對於一串連續進行的反應來說,決定速率的步驟是那些難以進行的反應。習慣上常稱決定速率的步驟是進行得最慢的反應。但要注意,這裡所謂最慢的反應,其反應速率未必是最小的。例如,在上面的例子中,當決定速率的步驟為
為決定速率的步驟,由此可見,決定速率的步驟是由相應的反應速率常數較小的元反應決定的。對於一串連續進行的反應來說,決定速率的步驟是那些難以進行的反應。習慣上常稱決定速率的步驟是進行得最慢的反應。但要注意,這裡所謂最慢的反應,其反應速率未必是最小的。例如,在上面的例子中,當決定速率的步驟為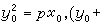 時,雖然k2《k1,但此元反應速率卻略大於
時,雖然k2《k1,但此元反應速率卻略大於 的反應速率。
的反應速率。 更廣義地說,決定速率的步驟不僅限於化學反應,也可以是某種物理輸運過程,例如,在復相催化反應中,擴散過程作為決定速率步驟的情況是常見的。
參考書目
F. Wilkinson, Chemical Kinetics and Reaction Mechanisms,Van Nostrand Reinhold Co., New York,1980.
