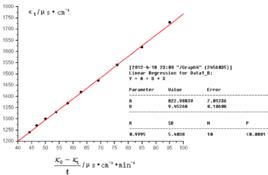
簡介
在化學動力學中, 反應速率常數,又稱 速率常數 k或 λ是化學反應速率的量化表示方式。
對於 反應物A和 反應物B反應成 生成物C的化學反應,反應速率可表示成此式:
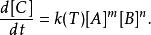 反應速率常數
反應速率常數k(T)是反應速率常數,會隨溫度改變
[X]是假定反應發生處遍布於固定容積的溶液內,物質X的容積摩爾濃度。(當反應發生於一定範圍,就能以X的單位面積摩爾數表示)
指數m和n稱為反應級數,取決於反應機理。可由實驗測定。
若為一次反應,亦可寫成以下形式:
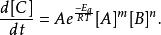 反應速率常數
反應速率常數E是活化能,R是氣體常數。因為溫度T的分子能量可依波茲曼分布(en:Boltzmann distribution)求得,我們可預知能量大於 E的碰撞比例隨 e變化, A是指數前因子(en:Pre-exponential factor)或頻率因子。
阿瑞尼斯方程式提供了反應進行中反應速率和活化能之關係的定量基礎。
化學反應速率
反應速率即化學反應進行的快慢,單位為mol/(L·s)或mol/(L·min)。用單位時間內反應物的濃度的減少或生成物濃度的增加量來表示。濃度單位一般用摩爾·升 ,時間單位用秒、分或小時。化學反應並非均勻速率進行:反應速率分為平均速率(一定時間間隔里平均反應速率)和瞬時速率(給定某時刻的反應速率),可通過實驗測定。反應物本身的性質,外界因素:溫度,濃度,壓強,催化劑,光,雷射,反應物顆粒大小,反應物之間的接觸面積和反應物狀態,x射線,γ射線,固體物質的表面積,與反應物的接觸面積,反應物的濃度也會影響化學反應速率。
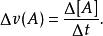 反應速率常數
反應速率常數碰撞學說
碰撞理論,是由德國的Max Trautz及英國的William Lewis 在1916年及1918年分別提出的。
碰撞學說:任何化學反應的發生,必需反應粒子互相接近碰撞,則反應速率與碰撞次數成正比。
活化能:所謂活化能就是能使粒子發生反應的最低能量。
有效碰撞:所謂有效碰撞是指碰撞的粒子其能量超過活化能,且碰撞方向(位向)要正確(發生化學反應所需的能量)。
1.碰撞學說:任何化學反應的發生,必需反應粒子互相接近碰撞,則反應速率與碰撞次數成正比。
2.活化能:所謂活化能就是能使粒子發生反應的最低能量。
3.有效碰撞:所謂有效碰撞是指碰撞的粒子其能量超過活化能,且碰撞方向(位向)要正確(發生化學反應所需的能量)。
影響反應速率的因素
除了反應物的性質以外,濃度、溫度和催化劑也是影響反應速率的重要因素。氣體反應的快慢還與壓力有關。增加反應物的濃度,即增加了單位體積內活化分子的數目,從而增加了單位時間內反應物分子的有效碰撞的次數,導致反應速率加快。提高反應溫度,即增加了活化分子的百分數,也增加了單位時間內反應物分子有效碰撞的次數,導致反應速率加快。使用正催化劑,改變了反應歷程,降低了反應所需的活化能,使反應速率加快。在化工生產中,常控制反應條件來加快反應速率,以增加產量。有時也要採取減慢反應速率的措施,以延長產品的使用時間。