理化性質
物理性質
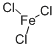 氯化鐵分子結構圖
氯化鐵分子結構圖外觀與性狀:黑棕色結晶,粉狀也略帶塊狀,
InChI=1/3ClHFe/h3*1H/q+3/p-3
熔點(℃):306
相對密度(水=1):2.90
沸點(℃):319
相對蒸氣密度(空氣=1):5.61
溶解性:易溶於水,不溶於甘油,易溶於甲醇、乙醇、丙酮、乙醚。
化學性質
1.與鹼反應Fe3++3OH-=Fe(OH)3
FeCl3+3NH3·H2O=Fe(OH)3↓+3NH4Cl
2.與還原劑反應
2FeCl3+SO2+2H2O=2FeCl2+H2SO4+2HCl
2FeCl3+H2S=2FeCl2+S↓+2HCl
3.氯化鐵與苯酚發生顯色反應
具有羥基與sp2雜化碳原子相連的結構(—C=C—OH)結構的化合物能與FeCl3的水溶液顯示特殊的顏色:苯酚、均苯三酚顯紫色;鄰苯二酚、對苯二酚顯綠色;甲苯酚顯藍色。也有些酚不顯色。
4.三價鐵離子的檢驗
FeCl3+3KSCN=Fe(SCN)3+3KCl
溶液由黃色(Fe3+)變為血紅色(Fe(SCN)3)
5.氯化鐵與相對於Fe的活潑金屬
鎂:3Mg+2FeCl3=3MgCl2+2Fe
溶液由黃色變成無色。
鋁:Al+FeCl3=AlCl3+Fe
溶液由黃色變成無色。
鋅:3Zn+2FeCl3=3ZnCl2+2Fe
溶液由黃色變成無色。
(以上均為金屬過量)
6.氯化鐵與其它金屬
銅:Cu+2FeCl3=2FeCl2+CuCl2
溶液由黃色變成藍色(FeCl2的淺綠色被掩蓋)。
鐵:Fe+2FeCl3=3FeCl2
溶液由黃色變成淺綠色。
註:氯化鐵不能與K、Ca、Na、Ba反應。
7.水解反應
氯化鐵是初高中範圍內接觸到的鹽中水溶液酸性最強的之一,這是由於Fe3+的強烈水解反應造成的:
Fe3++3H2O==可逆==Fe(OH)3+3H+
FeCl3+3H2O==可逆==Fe(OH)3+3HCl
(因為水解生成的Fe(OH)3量極少,不能沉澱出來,所以不寫沉澱符號)
這也是蒸發氯化鐵溶液只能得到氫氧化鐵或鹼式氯化鐵的原因(如需得到氯化鐵需在氯化氫氛圍內蒸發,抑制水解)
FeCl3·6H2O==加熱==Fe(OH)Cl2+HCl+5H2O(若繼續加熱,則會繼續脫去HCl得到氫氧化鐵)
實驗室可利用氯化鐵的水解反應製成氫氧化鐵膠體。
化學製備
固體產品採用氯化法,低共熔混合物反應法和四氯化鈦副產法,液體產品採用鹽酸法和一步氯化法。
將含鐵酸洗液或廢鹽酸置於反應釜裝置中,同時加入鐵粉或鐵屑,酸與鐵發生放熱反應產生的熱能對物料預加熱,然後加入催化劑並通入氧氣,再開啟循環泵,使反應液循環3-5小時,待聚合反應完全;將反應液轉入沉澱槽沉澱或以過濾方式對產品進行分離和富集。採用含鐵酸洗液或廢鹽酸生產聚合氯化鐵的方法降低生產成本,實現廢物的資源綜合利用。
1.氯化法
以廢鐵屑和氯氣為原料,在一立式反應爐里反應,生成的氯化鐵蒸氣和尾氣由爐的頂部排出,進入捕集器冷凝為固體結晶,即是成品。尾氣中含有少量未反應的游離氯化鐵。用氯化亞鐵溶液吸收氯氣,得到氯化鐵溶液作為副產品。生產操作中氯化鐵蒸氣與空氣中水分接觸後強烈發熱,並放出鹽酸氣,因此管道和設備要密封良好。整個系統在負壓下操作。
2.低共熔混合物反應法(熔融法)
在一個帶有耐酸襯裡的反應器中,令鐵屑和乾燥氯氣在氯化亞鐵與氯化鉀或氯化鈉的低共熔混合物(例如,70%FeCl和30%KCl)內進行反應。成氯化鐵,升華被收集在冷凝室中,該法製得的氯化鐵純度高。
3.氯化鐵溶液的合成方法
將鐵屑溶於鹽酸中,先生成氯化亞鐵,再通往氯氣氧化成氯化鐵。
冷卻氯化鐵濃溶液,便產生氯化鐵的六水物結晶。
4.複分解法
用氧化鐵與鹽酸反應結晶得氯化鐵成品。
用途
主要用於金屬蝕刻,污水處理.其中蝕刻包括銅,不鏽鋼,鋁等材料的蝕刻,對低油度的原水處理,具有效果好、價格便宜等優點,但帶來水色泛黃的缺點。也用於印染滾筒刻花、電子工業線路板及螢光數字筒生產等。建築工業用於製備混凝土,以增強混凝土的強度、抗腐蝕性和防水性。也能與氯化亞鐵、氯化鈣、氯化鋁、硫酸鋁、鹽酸等配製成泥凝土的防水劑,無機工業用作製造其他鐵鹽和墨水。染料工業用作印地科素染料染色時的氧化劑。印染工業用作媒染劑。冶金工業用作提取金、銀的氯化侵取劑。有機工業用作催化劑、氧化劑和氯化劑。玻璃工業用作玻璃器皿熱態著色劑。制皂工業用作肥皂廢液回收甘油的凝聚劑。
氯化鐵的另外一個重要用途就是五金蝕刻,蝕刻產品如:眼鏡架,鐘錶,電子元件,標牌銘牌。
化學成分
價格比固體氯化鐵成本低50%,省去固體配製溶液的操作和溶解不完
全的難題。可以取代固體或液體PAC,且成本低於PAC40%以上。
與其它廢水處理絮凝劑相比,其主要特點如下:
1、比固體三氯化鐵價格低40%以上(相同濃度),可完全替代固體氯化鐵;
2、本身為水溶液,省去固體配製溶液的操作及溶解不完全的問題;
3、取代液體或固體硫酸鋁、聚氯化鋁、聚合硫酸鐵等絮凝劑,處理成本降低30%以上;
4、絮凝性能優良,沉降速度高於鋁鹽系列絮凝劑(如硫酸鋁、聚合氯化鋁等),且形成的礬花密實;
5、產生污泥量少,大大節省污泥處理費用;
6、適應水體PH值範圍廣,為4-12,最佳PH值範圍6-10。
7.固體直接配製有溶解不完全現象,用真可謂省去人力,減少財力。
化學特性
1、水解速度快,水合作用弱。形成的礬花密實,沉降速度快。受水溫變化影響小,可以滿足在流動過程中產生剪下力的要求。
2、固態產品為棕褐色,紅褐色粉末,極易溶於水。
3、可有效去除源水中的鋁離子以及鋁鹽混凝後水中殘餘的游離態鋁離子。
4、適用範圍廣,生活飲用水,工業用水,生活用水,生活污水和工業污水處理等。
5、用藥量少,處理效果好,比其它混凝劑節約10-20%費用。
6、使用方法和包裝用途以及注意事項同聚合氯化鋁基本一樣。
氯化鐵是城市污水及工業廢水處理的高效廉價絮凝劑,具有顯著的沉澱重金屬及硫化物、脫色、脫臭、除油、殺菌、除磷、降低出水COD及BOD等功效。
檢驗
檢測方法
原子吸收法 《食品中添加劑的分析方法》,馬家驤等譯。
比色法(EPA方法 9250)
滴定法(EPA方法 9252)
檢驗標準
GB 4482-2006
| 氯化鐵(FeC l3 )的質量分數/% ≥ | 96.0 | 41.0 | 93.0 | 38.0 |
| 氯化亞鐵(FeCl 2 )的質量分數/% ≤ | 2.0 | 0.30 | 3.5 | 0.40 |
| 不容物的質量分數 ≤ | 1.5 | 0.50 | 3.0 | 0.50 |
| 游離酸(以HCl計)的質量分數/% ≤ | — | 0.40 | — | 0.50 |
| 砷(As)的質量分數/% ≤ | 0.0004 | 0.0002 | — | — |
| 鉛(Pb)的質量分數/% ≤ | 0.002 | 0.001 | — | — |
| 汞(Hg) 的質量分數/% ≤ | 0.00002 | 0.00001 | — | — |
| 鎘(Cd)的質量分數/% ≤ | 0.0002 | 0.0001 | — | — |
| 鉻[Cr(VI)]的質量分數/% ≤ | 0.001 | 0.0005 | — | — |
表格參考資料來源:分析化學
安全風險
健康危害
侵入途徑:吸入、食入、經皮吸收。
健康危害:吸入該品粉塵對整個呼吸道有強烈刺激腐蝕作用,損害黏膜組織,引起化學性肺炎等。對眼有強烈腐蝕性,重者可導致失明。皮膚接觸可致化學性灼傷。口服灼傷口腔和消化道,出現劇烈腹痛、嘔吐和虛脫。
慢性影響:長期攝入有可能引起肝腎損害。
毒理學資料及環境行為。
急性毒性:LD50:1872mg/kg(大鼠經口)
危險特性:受高熱分解產生有毒的腐蝕性氣體氯化氫。
燃燒(分解)產物:氯化物。
泄漏處理
隔離泄漏污染區,周圍設警告標誌,建議應急處理人員戴好防毒面具,穿化學防護服。不要直接接觸泄漏物,避免揚塵,收集運至廢物處理場所處置。使其溶於a.水、b.酸、或c.氧化成水溶液狀態,再加硫化物發生沉澱反應,然後廢棄。也可以用大量水沖洗,經稀釋的洗水放入廢水系統。如大量泄漏,收集回收或無害處理後廢棄。
防護措施
呼吸系統防護:可能接觸其粉塵時,應該佩帶防塵口罩。必要時佩帶防毒面具。
眼睛防護:戴化學安全防護眼鏡。
防護服:穿工作服(防腐材料製作)。
手防護:戴橡皮手套。
其它:工作後,淋浴更衣。單獨存放被毒物污染的衣服,洗後再用。保持良好的衛生習慣。
急救措施
皮膚接觸:立即用水沖洗至少15分鐘。若有灼傷,就醫治療。
眼睛接觸:立即提起眼瞼,用流動清水或生理鹽水沖洗至少15分鐘。就醫。
吸入:迅速脫離現場至空氣新鮮處。保持呼吸道通暢。必要時進行人工呼吸。就醫。
食入:患者清醒時立即漱口,給飲牛奶或蛋清。就醫。
滅火方法:霧狀水、火場周圍可用的滅火介質。
風險術語
R22吞食有害。
R38刺激皮膚。
R41對眼睛有嚴重傷害。
安全術語
S26不慎與眼睛接觸後,請立即用大量清水沖洗並徵求醫生意見。
S39戴護目鏡或面具。
S36/37/39穿戴適當的防護服、手套和護目鏡或面具。

