概述
 新生兒B鏈球菌感染
新生兒B鏈球菌感染英文名:groupBstreptococcalinfectionofnewborn
在新生兒期因B鏈球菌(groupBstreptococci,簡稱GBS)感染引起的疾病為新生兒B鏈球菌感染。B鏈球菌與圍生期感染關係密切,20世紀70年代已證明是新生兒敗血症和腦膜炎的一個重要病原。北京兒童醫院新生兒病房在肺炎、敗血症、腦膜炎等患兒105例中,確定GBS感染27例,占25.9%。
流行病學
 新生兒B鏈球菌感染
新生兒B鏈球菌感染新生兒感染多為母嬰垂直傳播,如羊膜早破可致上行感染,或接觸了產道的細菌,而羊膜完整者胎兒吸入了受羊膜炎污染的羊水,也可致病。少數新生兒感染為水平傳播,但晚發的GBS感染罕見在嬰兒室內流行。
早髮型感染(≤7天,平均生後20h發病)由母帶菌的型別和妊娠合併症而定據報導活產兒發病率0.7‰~3.7‰,帶菌母親的新生兒有菌血症者0.5‰~2.0‰,宮內感染者50%在出生時有症狀。<1500g者發病率2‰~2.6‰,>2500g者0.8‰~1.8‰足月兒在早發感染中占50%。晚發感染(>7天,平均24天發病),活產兒發病率0.5‰~1.8‰,無產科危險因素者,最晚發病可在3個月。
病因
鏈球菌根據溶血與否分為α(不完全溶血)、β(完全溶血)、γ(不溶血)三種。Lance-field根據抗原結構不同將B溶血性鏈球菌分為18個族、其中A族(GAS)引起咽炎、猩紅熱、皮膚感染,並與風濕熱和腎炎等有關;GBS則與孕、產婦和新生兒感染有關。GBS根據型特異的莢膜多糖抗原(S物質)不同,分為至少6個血清型:Ⅰa、Ⅰb、Ⅰc、Ⅱ、Ⅲ、Ⅳ型,不能定型者與新生兒疾病無關新生兒早發感染可由任何血清型所致,晚發感染中90%為Ⅲ型所致
發病機制
 症狀
症狀血清GBS特異莢膜多糖抗體IgG水平>2µg/ml時,可加強白細胞調理吞噬作用,並能殺死GBS未成熟兒缺乏來自母體的型特異抗體,易發生GBS感染,一旦發生,可使未成熟兒本來已有的調理吞噬作用的缺陷進一步受累。
早髮型GBS感染是以菌血症、肺炎及肺動脈高壓為其特徵,敗血症後期可發生周圍血中性粒細胞減少肺部粒細胞浸潤血管通透性增加、心肌功能障礙血壓下降、中心靜脈壓升高和DIC。
晚髮型GBS感染的發病與患兒早期帶菌有關,當發生呼吸道感染時,破壞了黏膜屏障,GBS便乘虛繁殖,產生大量GBSⅢ型莢膜多糖抗原,或母親自身抗體減少等原因。GBS骨髓炎的發病是由於早髮型GBS菌血症,雖無症狀,但可將細菌接種入受傷的骨骼(肱骨)中而後引起局限性的骨髓炎,患兒可無全身症狀。由於患兒已產生少量抗體,血中Ⅲ型特異IgG抗體升高,可使感染局限於乾骺端。
臨床表現
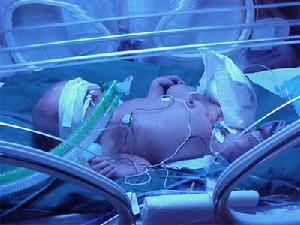 新生兒B鏈球菌感染
新生兒B鏈球菌感染近二十年來,美國、英國、芬蘭等國家的GBS感染為新生兒感染的首位,發生率分別高達61%、28%、30%,病死率達20%~50%。申阿東等報導由GBS引起的新生兒肺炎占25.71%[15]。根據感染髮生的時間分為早發疾病、晚發疾病及復發疾病。由早發疾病引起的新生兒病死率為11.1%,晚發疾病者為27.8%。
1.早發疾病(early-onsetdisease,EOD):指生後一周內發生的GBS感染,占新生兒GBS疾病的80%[16],以暴發性肺炎和膿毒血症為特徵,常伴發腦膜炎。主要表現為生後半小時內出現呼吸系統症狀,如紫紺、呼吸暫停、呼吸窘迫,X線以炎性浸潤性片狀陰影及雲絮狀改變為主。由窒息、低血壓、DIC引起的死亡占40%~60%,最常見於發病12~24小時內,早產兒常在6小時內發生。主要併發症有呼吸衰竭、代謝紊亂。據隨訪,15%~30%的腦膜炎存活者出現長期神經系統後遺症[17]。產科高危因素:生殖道GBS感染,尤其嚴重感染孕婦發生EOD的危險比未感染者高29倍;低水平的抗莢膜多糖抗體;分娩過GBS感染嬰兒;孕期GBS菌血症;多產次;早產、破膜時間長、產時發熱者EOD發生率增高7倍。
2.晚發疾病(late-onsetdisease,LOD):常發生於生後5天~16周,可由產時垂直傳播、院內感染或其它因素所致,90%為Ⅲ型GBS。常為隱匿性發病,最初表現為腦膜炎症狀,如發熱、昏睡、嘔吐、囟門張力大等,其它尚可有膿毒血症性關節炎、蜂窩組織炎、骨髓炎及無症狀菌血症等。LOD受感染者多為有產科併發症的早產兒,發病率為足月兒的7倍,因膿毒血症死亡者高達90%,足月兒在5%以下。
3.復發疾病(recurrentdisease):指新生兒GBS菌血症、腦膜炎等治癒後,經過一段時間間隔發生了與GBS有關的新的臨床疾病,並從血液、腦脊液、腦室液中找到GBS。發病高峰在生後90天內,發生率在0~8.8%。Chua等6年的研究表明,約6%的早發疾病和4%的晚發疾病會復發[18]。復發疾病常為菌血症或菌血症合併腦膜炎。原因有:(1)GBS初次感染所用抗生素療程短,劑量小,未達殺菌濃度,停藥後同型細菌反跳。(2)外源不同血清型GBS的侵入,稱為重複感染,可為院內感染。(3)新生兒口腔GBS感染引起母親乳頭炎,繼而引起復發感染。(4)Ⅲ型GBS可長期存在於黏膜表面,早產兒免疫功能不成熟,使復發感染機會增加。
併發症:早髮型可見窒息、持續胎兒循環、胸膜炎、肺水腫、腦膜炎腦室膜炎。晚髮型可並發骨髓炎、泌尿系感染等。
檢查
 專家答疑
專家答疑確定診斷需靠細菌培養陽性(自血液、腦脊液、尿液、局部病灶中)而皮膚和黏膜的陽性只表示帶菌。
細菌的抗原診斷進展很快,不論用過抗生素與否,均可用抗原檢測方法,常用的有乳膠凝集、協同凝集、對流免疫電泳和酶聯免疫吸附試驗等以對流免疫電泳的準確性較好,對GBS含量少的標本則優於抗原檢測細菌培養。
特異性GBS抗體升高可以提示近期GBS感染,抗鏈球菌溶血素O(ASO)和抗去氧核糖核酸酶B(DNAseB)只對GAS的診斷有助,不適用於GBS。
GBS的檢出率依賴於多項因素,多數學者建議從宮頸、陰道及肛周聯合取材以提高陽性率。多數學者認為,越接近產時篩查GBS陽性率越高,故美國婦產科協會(ACOG)、美國兒科協會(AAP)建議對孕35~37周的所有孕婦進行檢測。檢測方法主要有細菌培養和抗原測定。
1.細菌學檢查:GBS對培養基要求較高,肉湯選擇性培養基可顯著提高陽性率,是明確GBS的基本手段。首選SMB或Lim肉湯選擇性培養基。由菌落形態、溶血特性、顯微鏡下所見及生化反應可以確定鏈球菌,採用族和型特異性血清進行免疫學試驗可最後確定GBS。中國已有自製抗血清用於鑑定GBS。Field採用陰道分泌物塗片進行革蘭染色快速診斷GBS,診斷符合率較高,有一定實用價值。
2.細菌抗原檢測:近年用於GBS檢測的有乳膠微粒凝集試驗(LA)、協同凝集試驗(COA)、對流免疫電泳試驗(CIE)及酶聯免疫試驗(ELISA)等,前兩種國外均有商品試劑盒出售。GBS全身感染時抗原檢測陽性率可達50%~80%,甚至100%。
3.特異性抗體檢測:免疫螢光抗體檢測培養6小時的標本,敏感度和特異度分別為49%和99%,陽性預測值和陰性預測值分別為89%和92%,標本直接檢查敏感度較低。
4.分子生物學檢查:有人用脈衝場凝蝕電泳法(PFGE),限制性酶切片段長度多態性分析(RFLP),核酸探針法及核酸內切酶法等檢測GBS,均取得較好的效果,但均未能套用於臨床。
其它輔助檢查:
應常規做X線檢查了解心肺情況做腦電圖、心電圖檢查,必要時做腦CT檢查,B超等檢查。
相關檢查:
脫氧核糖核酸染色
感染途徑
早髮型GBS肺炎母嬰配對的GBS菌株的血清型均一致,血清型為III/R;核酸雜交結果表明,其毒力因子SCAA、ScpB、glnA、α和β基因片段大小均相同;RAPD檢測結果證明,GBS菌株RAPD的DNA指紋圖完全一致。晚髮型GBS腦膜炎患兒腦脊液和血中分離的GBS菌株血清型、毒力因子基因片段大小、RAPD的DNA指紋圖譜完全一致,而與母親陰道攜帶的GBS菌株RAPD的DNA指紋不同。從分子生物學角度證明,早髮型GBS是由母親陰道攜帶GBS引起,傳播途徑為母嬰垂直傳播;晚髮型GBS與母親陰道攜帶GBS菌株無關,可能與生後水平傳播有關。治療
 新生兒B鏈球菌感染
新生兒B鏈球菌感染復發罕見,可在治療後2~43天(平均16天)發生,由於療程過短(菌血症<10天,腦膜炎<14天)劑量小所致鶒因為抗生素治療不能消滅黏膜帶菌,以前的感染不產生保護性抗體。復發感染可來自母親乳腺炎、新生兒腦膿腫或心內膜炎等。若用大劑量青黴素,重複治療,療程長,仍可有效。
治療GBS感染時應同時治療合併症,如低氧、休克、DIC驚厥、顱內壓增高、抗利尿激素分泌異常綜合徵等。
預後預防
 食療
食療早髮型GBS的病死率是10%~40%,極低出生體重兒、粒細胞絕對值<1500、Apgar評分低、低血壓呼吸暫停、持續胎兒循環伴嚴重青紫、抗生素使用過晚等,則病死率最高。持續胎兒循環若用體外膜肺治療者病死率明顯下降。早發和晚發腦膜炎無合併症者病死率較低(10%~20%),影響腦膜炎死亡的因素包括休克、昏迷腦脊液蛋白超過3000mg/L(300mg/dl)健康搜尋,驚厥難以控制、粒細胞減少等。神經系統嚴重後遺症占20%~30%,包括智力低下、癱瘓、驚厥反覆發作難以控制,視丘下功能障礙、皮質盲、腦積水、耳聾、偏癱等此外,神經發育障礙占15%~25%包括輕度智力低下、皮質輕度萎縮癲癇語言發育遲緩和其他的學習困難等。北京兒童醫院早髮型病死率27.8%,晚髮型11.1%,腦膜炎2例病情甚嚴重,家長放棄治療。
預防:
GBS型特異抗原為其莢膜多糖,提純的Ⅰa、ⅡⅢ型可用作菌苗,孕婦在妊娠30周若證實無GBS抗體者,經注射Ⅲ型GBS菌苗後,孕婦和新生兒臍血均可產生抗體,新生兒的抗體可持續1~2個月。但多糖抗原對孕婦只有54%有免疫反應。
新生兒在出生時肌注青黴素用來預防並不適宜,因為50%的嬰兒已在宮內受感染,出生時或生後6h內即有症狀,經對照觀察在預防菌血症和減少死亡方面均無效除非在雙胎中一個已受感染而用於另一個無症狀者。
對高危帶菌孕婦合併早產發熱早破水(大於12h),或疑似絨毛膜羊膜炎者,選擇性藥物治療,可有效地預防新生兒的早發感染。在妊娠26~28周時檢查孕婦是否GBS帶菌對帶菌者在分娩時用氨苄青黴素靜脈治療(首劑2g以後每4小時用1g),可減少新生兒的帶菌和感染。另一方法是產婦臨產時用快速抗原檢測法(在5h內出結果)來檢查產道GBS對帶菌多者用氨苄治療。
預防GBS感染主要集中於給新生兒保護性免疫(主/被動)或從母嬰雙方消除GBS帶菌狀態(藥物預防)著手。
一、藥物預防及治療
孕期藥物預防指對已臨產或胎膜早破者,分娩前給以抗生素治療,以預防母體GBS感染和新生兒早期疾病。經過多年實踐,國際上用於推廣的方案有兩種[20]:
方案Ⅰ:所有孕婦於孕35~37周取陰道下1/3、肛門直腸分泌物作GBS培養,結果陽性及有感染高危因素者給以青黴素G。這一方案為ACOG和AAP所肯定,但尚未有大樣本試驗支持,Rouse等估計此方案使近30%的。
兒科疾病
| 兒科病就是兒童易患疾病的統稱。比如腸胃疾病,營養不良,呼吸疾病等等。 |
