疾病概述
 進行性系統性硬化症
進行性系統性硬化症症狀體徵
 進行性系統性硬化症
進行性系統性硬化症2.腎臟表現PSS出現臨床腎臟病的頻率明顯少於形態學上的腎臟病變,依臨床觀察時間的長短不同,估計在1.5%~97%不等。本病患者36%出現蛋白尿,24%出現高血壓,19%出現氮質血症,7%出現惡性高血壓綜合徵。在一項報導中,不伴臨床腎臟病表現的116例患者,僅有10%在20年隨訪期內死亡,但伴有蛋白尿、高血壓或腎功能不全的94例患者則有60%於同期內死亡。PSS的臨床腎臟病表現為:
(1)蛋白尿:蛋白尿是PSS的常見表現,但很少有腎病綜合徵表現。早期常為輕度、間歇性或持續性蛋白尿,一般24h尿蛋白定量<500mg,可伴有輕度的鏡下血尿及白細胞尿。蛋白尿可以是惟一的表現,但大部分患者同時有輕、中度高血壓及慢性腎功能損害,單純蛋白尿的預後遠較同時伴高血壓及氮質血症患者好。大約50%的蛋白尿患者與高血壓、氮質血症的發生有關。持續存在的蛋白尿提示預後不良,3年內死亡率約64%,而無蛋白尿者僅5%在同期內死亡。
(2)高血壓:高血壓被認為是PSS患者腎受損的一個臨床標誌,也是腎損害的常見表現,發生率25%~58%,對PSS患者的預後影響較大。合併高血壓的患者死亡率比血壓正常者高2.5倍,2/3有高血壓的患者於20年內死亡。PSS患者的高血壓可分為兩種類型:一種為慢性高血壓,占本病高血壓患者的75%~80%,一般起病隱襲,呈慢性經過,為持續性或間歇性,很少發生急性腎功能衰竭。這種良性高血壓常發生在病程的晚期,對預後影響不大。只有約15%的慢性高血壓患者可導致死亡。
另一種為惡性高血壓;有些PSS患者在一段時間後,發展為惡性高血壓綜合徵和少尿型腎功能衰竭。學者認為惡性高血壓綜合徵通常出現在某些損害腎血流灌往的疾病之後,例如充血性心衰、心包積液、腹部外傷、脫水或感染。Cannon等報導,本病30%的高血壓患者表現為惡性高血壓綜合徵,其特點是,血壓突然升高,腎功能急劇惡化,最終發展為少尿型腎功能衰竭,常與視網膜病(出血、滲出、視盤水腫)、心衰和腦病並存。該綜合徵又可稱為PSS腎臟危象。儘管危象患者血壓急劇上升,但當腎功能繼續惡化時,血壓通常降至中度高血壓水平。80%~90%的惡性高血壓綜合徵患者在發病後2個月內死亡。個別患者惡性高血壓綜合徵可發生在皮膚變硬之前,應於注意。
3.氮質血症PSS發展為氮質血症的患者預後較差。紐約學者研究表明,血尿素氮超過25mg/dl的患者,死亡率達77%。大多數研究表明PSS並高血壓的患者發展為少尿型腎衰時會發生氮質血症,但人們注意到,少數血壓不高的患者也可發展為氮質血症。血壓正常的PSS患者,氮質血症往往繼發於心衰、感染、脫水、外傷或心包積液等,一般不會發展為腎衰。但是,一些有廣泛內臟器官受累的病人,氮質血症的發生可能預示著即將發展為少尿症和腎皮質壞死,後者的腎臟病變包括腎小球和血管損害,這些損害與PSS腎臟危象的高血壓患者相似。
4.腎臟危象Traub等總結1955年到1981年期間的臨床資料,將PSS腎臟危象定義為:出現高血壓或高血壓惡化(血壓大於160/90mmHg),出現Ⅲ級或Ⅳ級視網膜病變,血漿腎素活性較正常水平增加2倍以上,1個月內腎功能迅速惡化。匹茲堡的一項研究觀察了131例PSS腎臟危象患者,觀察期限超過33年,其中15例(11%)血壓正常。與血壓升高者相比,血壓正常的腎衰患者表現出更多的微血管病性溶血性貧血和血小板減少性紫癜,有人認為先前使用腎上腺糖皮質激素治療對其中部分患者可能是一種促發因素。
臨床類型
 進行性系統性硬化症
進行性系統性硬化症2.局限型:局限型PSS患者平均年齡大於瀰漫型PSS5~10年,在其他症狀出現以前通常有持續多年甚至幾十年的雷諾現象。患者肢體遠端皮膚增厚,累及指、手、前臂和顏面,肢體病變一般不超過肘部。皮膚增厚通常伴有面部毛細血管擴張。內臟受損較晚,約在起病10年後,部分患者可發生食管運動功能障礙和(或)肺間質損害,腎損害較少。
既往稱這種以無痛性皮膚症狀為主要表現的疾病為CREST綜合徵,該縮寫詞於1964年首次用來命名輕度局限型PSS,其臨床特點為鈣化(calcinosis)多見於手指軟組織,雷諾現象(Raynaudphenomenon),食管運動功能障礙(esophagealdysmotility),硬指(sclerodactyly)和毛細血管擴張(telangiectasis)。近期臨床觀察顯示,並非全部患者均具備上述特徵,因此這個名稱並不完全適用。
3.重疊型:上述任何一型PSS伴有另一種結締組織病,如PSS與多發性肌炎或皮肌炎或系統性紅斑狼瘡或舍格倫綜合徵重疊,稱重疊型PSS。僅有PSS內臟損害而無硬皮者不足1%。
疾病病因
 進行性系統性硬化症
進行性系統性硬化症1.遺傳和環境因素本病有明顯家庭史,可能與HLA-DR3、DR6、C4null等基因有關。
2.結締組織代謝異常本病有廣泛的結締組織病變,成纖維細胞培養顯示膠原合成的活性明顯增高,並發現纖維連線素基因有突變,致結締組織代謝異常而導致PSS的發生。
3.感染因素許多患者發病前常有急性感染,如鼻竇炎、咽峽炎、扁桃體炎、肺炎、猩紅熱等。在患者的橫紋肌和腎臟中曾檢出副黏病毒樣包涵體。
4.細胞因子很多細胞因子可對膠原成分的表達起調節作用。如TGFβ不僅對細胞外基質有較強的調節作用,還可影響其他細胞因子,包括IL-1β、TNFα1、PDGF、鹼性成纖維細胞生長因子等。
5.免疫異常在PSS患者體內可測出多種自身抗體(如抗核抗體、抗DNA抗體、抗ssR-NA抗體、抗硬皮病皮膚提取液的抗體等),並見B細胞數增多,體液免疫明顯增強,CIC陽性率高達50%以上,多數患者有高丙球蛋白血症,部分病例常與系統性紅斑狼瘡、皮肌炎、類風濕性關節炎、舍格倫綜合徵等並發而形成重疊綜合徵。
病理生理
 進行性系統性硬化症
進行性系統性硬化症1.微循環假說本假說認為PSS繼發於微血管病變,原發性內皮損傷導致血管痙攣,損傷部位血小板黏附、聚集、活化,發生血管內凝血,內膜細胞增殖,富含黏多糖的物質沉積,導致血管狹窄,局部組織缺血,毛細血管滲透性改變,並通過對鄰近間質成纖維細胞的免疫介導,增加膠原沉積,導致組織纖維化。多種血管加壓物質被認為是血管不穩定性的介質,包括5-羥色胺(5-HT)、兒茶酚胺、腎素、血栓素A2(TXA2)、前列腺素等。近來認識到局部血管活性物質如內皮源性舒張因子(EDRF)和內皮素在PSS發病機制中的作用。已證明PSS患者的血清內皮素濃度較對照組大約高3倍,受到寒冷刺激後會迅速升高,同時觀察到內皮素能促使成纖維細胞有絲分裂,刺激膠原合成。轉移生長因子β(TGF-β)也可能參與了PSS的組織纖維化。
2.免疫假說大量研究表明,免疫反應可能是PSS血管損傷和組織纖維化的起因。臨床上PSS可出現自身免疫性疾病的表現,如多發性肌炎、系統性紅斑狼瘡、舍格倫綜合徵和原發性膽汁性肝硬化。若將人類口腔癌細胞株IIep-2作為底物,95%~98%的PSS患者可發現ANA陽性。70%~80%的局限型PSS患者有抗著絲點抗體陽性,30%的瀰漫型PSS患者和2%伴其他膠原血管病的PSS患者抗Scl-70抗體陽性。其他抗體包括抗SS-A(Ro)抗體、淋巴細胞毒抗體和Ⅳ型膠原基膜抗體等。用敏感的細胞分析方法可在55%~72%的PSS患者中檢測到循環免疫複合物(CIC)。CIC的出現與內臟受損有關,尤其是與肺受損有關。50%的PSS患者在硬皮症狀出現以前的水腫期可觀察到皮膚外周血管的炎症細胞浸潤,提示細胞免疫在PSS發病機制中可能發揮作用。這些浸潤細胞主要由活化的CD4+細胞所構成,肥大細胞也較多見。推測肥大細胞是內皮損傷和纖維化形成中的重要中介,它主要通過釋放組胺刺激成纖維細胞增殖和基質合成。據報導,PSS患者具有各種不同類型的細胞免疫異常。目前仍未確定這些免疫異常是原發性抑或繼發性,以及是否具有特異性。這些免疫異常包括淋巴細胞對植物血凝素和刀豆蛋白的增殖反應受損,CD8+細胞百分率下降,自然殺傷細胞減少,血循環中活化的單核細胞增加。PSS患者未受刺激的外周血單核細胞能產生一種細胞因子,這種細胞因子可促進成纖維細胞生長和膠原合成。PSS患者血清中所含白介素-2(IL-2)的水平較對照組明顯增高,其淋巴細胞表達高親和力的IL-2受體水平更高。
對移植物抗宿主反應的研究,給免疫調控參與PSS發病機制提供了強有力的證據。接受骨髓移植的患者生存1~2年後發生的全身性疾病在臨床病理和血清學方面的異常都與PSS非常相似。這些患者可發生類似PSS的皮膚改變,並可伴有雷諾現象、乾燥面容、多關節痛,以及CIC、ANA和淋巴細胞毒抗體陽性。另外,PSS血管損傷的病理特徵與同種移植腎排斥反應非常相似。
3.膠原合成假說許多研究證實,將PSS患者的單層成纖維細胞進行培養,能夠產生多於對照組2~4倍的膠原蛋白和基質多肽,並且能夠連續傳代。這些增加的膠原蛋白主要是Ⅰ型和Ⅲ型膠原、蛋白多糖、透明質酸和纖維連線素(fibronectin),這些物質的mRNA表達可能通過旁分泌和自分泌途徑產生的細胞因子來調節。TGF-β、血小板源性生長因子(PDGF)、IL-1和腫瘤壞死因子α(TNFα)均能刺激成纖維細胞生長,調節纖維母細胞的膠原產物。正常的成纖維細胞暴露於PSS患者的血清後,與正常對照組相比,能產生更多的膠原蛋白。這些發現支持PSS患者的炎症細胞和血小板產生的細胞因子,能誘導成纖維細胞生長和膠原蛋白合成的假說。同時提示PSS患者成纖維細胞的結締組織合成能力增強不是原發的,可能是上述細胞因子和其他炎症介質相互作用的結果。
 進行性系統性硬化症
進行性系統性硬化症5.腎損害發病機制PSS致腎血管損傷的發病機制目前尚不清楚。通過分析目前關於動脈粥樣硬化和器官移植中由於嚴重的內膜增殖而產生的阻塞性血管病的發病機制,本病腎臟硬化症的發病可能涉及到某些免疫紊亂,引起內皮細胞損傷和促有絲分裂原釋放,從而導致合成黏多糖和膠原纖維的細胞移行和增殖。腎臟病理學研究提示,這些病變包括增殖階段和穩定的纖維化階段。腎血管損傷可以重新修復,這可解釋有些PSS患者腎功能衰竭數月以後可停透析治療,其腎功能可得到自發改善的原因。
目前已清楚,PSS患者的弓形和小葉間動脈損害並不僅僅由於動脈血壓升高所致。在許多研究中,死於腎功能衰竭的PSS患者腎臟發生了組織病理學改變,但並未發現血壓升高。大量證據表明,腎循環異常伴腎素-血管緊張素系統的活化在腎臟硬化的發病機制中發揮著重要作用:
(1)PSS高血壓患者的腎活檢或腎切除標本中經常發現腎血管損傷。
(2)伴良性或惡性高血壓的PSS患者常有腎皮質血流異常和腎動脈造影的異常。
(3)許多PSS患者在惡性高血壓發生之前常先有血壓增高。已證實這些患者腎素-血管緊張素系統被激活,且幾乎所有PSS腎臟危象患者均可出現這種激活。
(4)有些伴頑固性高血壓和腎素活性增高的PSS患者,雙側腎切除可使其血壓恢復正常,少數患者其他症狀也得到改善。
(5)抑制腎素釋放和血管緊張素產生的藥物能改善PSS患者的高血壓症狀,並使少尿症的發生減少。
PSS伴惡性高血壓和腎功能衰竭的一個不常見特徵是其發病突然且迅速進展為少尿症。病理學上表現為雙側腎皮質斑片狀壞死。可以假設,腎皮質血管阻塞性內膜損傷與功能性血管收縮相結合(部分是腎素-血管緊張素系統活化的結果),導致這種結果。部分堵塞的腎弓形和小葉間動脈因功能性血管痙攣導致完全堵塞,產生缺血性皮質壞死區。這些發現與臨床中所觀察到的惡性高血壓及腎功能衰竭最常見於秋冬季(雷諾現象最常見季節),以及常見於充血性心力衰竭、心包積液、外傷、貧血、脫水等能引起腎素-血管緊張素系統活化和腎血管收縮的疾病之後一致。PSS蛋白尿的發生機制還不清楚,急性期患者可發生嚴重的腎小球結構改變,導致腎小球毛細血管通透性增加而濾過蛋白質,但尚不清楚血流動力學改變發展到什麼程度才能導致蛋白質漏出,實驗研究表明血管緊張素Ⅱ能誘發蛋白尿。Reilly等用氣相色譜-質譜儀技術檢測了10位PSS患者尿中TXA2和前列環素(PGI)的代謝產物,與健康對照組相比,這些患者血栓烷的主要尿代謝產物血栓烷B2的分泌顯著增多。用足以使指、趾血管收縮的寒冷刺激時,它的分泌進一步增加。患者尿中6-酮-前列腺素F2α亦增加,採用寒冷刺激後進一步增加。這些資料支持以下假說,即PSS患者體內血小板激活(可能位於受損的內皮表面),寒冷刺激產生的血管收縮物質進一步促進PSS患者體內血小板活化。有報導顯示PSS患者血漿內皮素水平增加,受到寒冷刺激後進一步增加。內皮素對PSS患者血管收縮和纖維化等具體作用機制仍在進一步研究。Furchgott的研究指出,在各種刺激下,內皮細胞釋放出一種擴血管物質,使血管平滑肌舒張。已確定這種物質的化學成分是一氧化氮(即EDRF),它可通過對抗周圍血管收縮因子的作用維持血管張力。當血管內皮細胞受到損傷或內膜增厚時,就像在動脈粥樣硬化中所觀察到的那樣,由刺激反應誘導EDRF釋放所產生的血管擴張作用減弱。另外,EDRF活性的缺乏可能導致PSS患者已有內皮細胞損傷和增殖性內膜損害的血管發生異常收縮反應。
診斷檢查
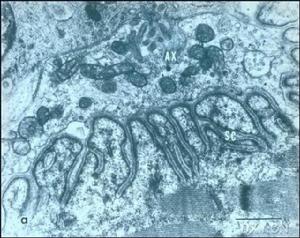 進行性系統性硬化症
進行性系統性硬化症根據1980年美國風濕病學會制訂的PSS分類標準:凡具備以下1個主要指標或2個次要指標可以診斷為PSS。
1.主要指標近端硬皮,有對稱性手指及掌指或跖趾近端皮膚增厚,緊硬,類似病變也見於整個四肢、面、頸、軀幹(胸腹)。
2.次要指標
(1)上述皮膚改變僅限於手指。
(2)指端可凹性瘢痕形成或指墊變薄。由於缺血指端有下陷區,指墊組織喪失。
(3)肺底部纖維化:無原發性肺疾患者雙肺底部出現網狀線索、結節、密度增加,亦可呈瀰漫斑點狀或蜂窩狀。
當PSS患者出現蛋白尿、高血壓或氮質血症時可診斷PSS腎損害。但不少患者,尤其在疾病早期,常無明顯腎損害表現而被漏診。對PSS患者應該結合臨床表現、腎動脈造影及腎活檢,以提高腎損害的診斷。
實驗室檢查:
1.尿液檢查蛋白尿<500mg/24h,鏡下血尿及顆粒管型。
2.血液檢查部分病例血中可找到狼瘡細胞,血沉正常或輕度升高;蛋白電泳約半數患者丙種球蛋白升高;血BUN、Scr升高,血尿素氮>25mg/dl,Ccr下降;血漿腎素水平升高。
3.免疫學檢查
(1)類風濕因子(RF):1/3PSS患者RF陽性。
(2)ANA:70%PSS患者ANA陽性。
(3)抗Scl-70抗體:為瀰漫型PSS的標記性抗體,見於50%~60%的患者。
(4)抗著絲點抗體:為局限型PSS的標記性抗體,70%~80%的局限型PSS患者抗著絲點抗體陽性。
(5)抗核仁抗體:30%~40%PSS患者該抗體陽性,瀰漫型PSS陽性率高。
(6)抗核糖核蛋白抗體(抗rnp抗體)和抗SS-A(Ro)抗體有時陽性。
其他輔助檢查:
1.腎活檢腎活檢是評價PSS患者腎損害的重要途徑。組織學上將腎損害分為急性和慢性兩種形式,為評價腎損害的嚴重性和分型提供了幫助。急性病變(動脈黏液樣水腫、小動脈纖維素樣壞死、腎小球毛細血管內血栓以及腎梗死)總是見於急性少尿型腎衰,多數提示病情嚴重。慢性非活動性病變(動脈內膜硬化、腎小球硬化、腎小管萎縮和腎間質纖維化)提示患者為急性腎衰後遺的腎功能損害。輕到中度的慢性病變通常見於病程長、慢性經過或以腎功能不全和輕度蛋白尿伴或不伴輕度高血壓為特徵的病情穩定者。有些無臨床腎病病史的患者,這些非活動性病變僅在屍解時才被發現。
2.腎活檢指征PSS患者腎活檢指征有限,而且沒有明確定義。對於PSS、狼瘡性腎炎和混合性結締組織病患者的鑑別,腎活檢具有相當大的價值。PSS伴急性腎功能衰竭患者,如不能明確診斷為PSS腎臟危象,而且又無法排除間質性腎炎等疾病所致,可通過腎活檢而明確診斷。由於PSS患者腎臟病變不能從臨床和其他實驗室資料來估計,因此腎活檢可為PSS的預後提供有用的資料。
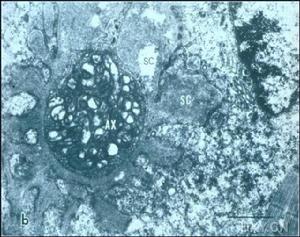 進行性系統性硬化症
進行性系統性硬化症(1)動脈組織學改變:PSS患者腎血管組織學改變的主要病變部位在小葉間動脈和小動脈。血管病變可分為急性和慢性。急性血管病變有以下兩種類型:一種為內膜增殖呈黏液水腫樣,該類型主要影響較大的動脈。另一種為纖維素樣壞死,主要影響小動脈。這些病變可能是局灶性的,也可能是全身性的。
①急性期:黏液水腫性內膜增殖首先出現在小葉間動脈,少數出現於小弓形動脈,大弓形動脈和葉間動脈常不被累及。血管受累的典型病變為同心圓狀黏液水腫性內膜增生,細胞相對少見,管腔變狹窄。內皮細胞水腫,局部脫落,內膜基質鬆散,蘇木精-嗜伊紅染色基質呈輕度嗜鹼性或透明,三色染色黏液樣基質呈透明或淡藍色。基質中存在少量拉長的肌內膜細胞,這些細胞呈螺鏇式同心圓狀排列,即所謂“洋蔥皮”樣結構。有些動脈黏液樣基質內含有嗜鹼性粒細胞、嗜品紅的小簇纖維蛋白樣物質,這些物質對纖維蛋白染色呈陽性反應。數量不等的纖維蛋白沉積在狹窄的管腔,狹窄的管腔常充斥淤積的紅細胞,碎片紅細胞沉積在深層內膜基質,這為微血管病性溶血性貧血參與本病發病機制提供了形態學依據。血管中層變薄擴展,圍繞擴張的內膜,血管外徑增加,三色染色法顯示血管中層輕度硬化。外膜改變不明顯,有些可觀察到外膜輕度纖維化,可見極少量的單核細胞。PSS患者腎臟超微結構改變報導較少。與光鏡下所觀察到的黏液樣內膜增殖一致,急性小葉間動脈損害的超微結構呈同心圓樣線狀排列,具有中等電子緻密度。小葉間動脈的血管中層變薄,僅有1~2層細胞,其中部分肌纖維萎縮,內質網腫脹,吞噬體增多。外膜超微結構無明顯改變。
②慢性期:慢性動脈損害因管腔緻密同心圓狀的內膜纖維彈性組織增生而變狹窄,不存在黏液水腫性內膜增生。增生的纖維彈性組織在三色染色下呈深藍色,說明存在豐富的基質。血管中層一般正常或輕度硬化,具有正常厚度,無急性動脈損傷時所見的擴展現象。外膜改變不明顯。超微結構檢查可見慢性動脈損害表現為內膜增厚,增厚的內膜由緻密的同心圓狀的肌內膜細胞層組成,肌內膜細胞被內膜基質構成的緻密帶、增厚的彈性組織膜以及膠原蛋白束所分隔。血管中層可見輕度增厚的環繞肌纖維的基底膜套。外徑50~15μm的小動脈較少出現黏液樣內膜增生。PSS小動脈主要表現為纖維素樣壞死,既內皮細胞和中層肌纖維腫脹、壞死,強嗜酸性纖維素樣物質占據血管腔和內膜,受累血管嚴重狹窄或堵塞;偶見少量多形核白細胞、淋巴細胞浸潤於受損血管內膜或附集於血管壁。此為PSS血管損害的第2種特徵性病變。
(2)腎小球:
①急性期:嚴重PSS患者急性期腎小球損害表現各異。部分小球毛細血管內可見纖維蛋白血栓,呈節段性或小球性分布。這些部位毛細血管內常見紅細胞淤積和內皮細胞腫脹變性。偶見輕度毛細血管內或系膜區細胞增多。急性梗死區腎小球出現部分或完全壞死。PSS腎臟危象患者,球旁細胞可出現增生。
②慢性期:PSS慢性期腎小球病理改變為腎小球硬化,可見血管內凝血、腎小球局部缺血、腎小球毛細血管壁增厚等。電鏡觀察可見腎小球基底膜增厚,可有輕度、不規則的足突融合。
(3)腎小管和間質:PSS患者腎小管和間質的改變取決於血管和腎小球損傷害的分布、嚴重程度和病程。急性血管損傷時可見皮質壞死灶,出現間質水腫和淋巴細胞浸潤,集合管內可見紅細胞、白細胞和脫落的小管上皮細胞。在慢性損害部位,可見輕到重度的小管萎縮、少量淋巴細胞浸潤和間質纖維化。PSS患者腎小球和血管免疫螢光檢查呈多種多樣的改變。與組織學改變相似,血管損傷的免疫螢光染色通常是局灶性的。急性損傷時,內膜可見IgM、C3和纖維蛋白原強陽性,也可見IgG、IgA、C1q和C4沉積。慢性血管損傷,可見少量IgM和C3沉積,但無纖維蛋白原沉積。腎小球和腎小管的病變與動脈一樣,染色最深、最普遍的是IgM和C3。少數情況下可見IgG、IgA、C1q和C4沉積。
4.X線檢查系統型患者往往顯示牙周膜增寬;食管、胃腸道蠕動消失,下端狹窄,近側增寬,小腸蠕動減少,近側小腸擴張,結腸袋呈球形改變;指端骨質吸收;兩肺紋理增粗,或見囊狀改變;軟組織內有鈣鹽沉積陰影等。
鑑別診斷
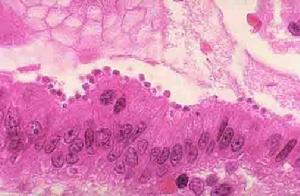 進行性系統性硬化症
進行性系統性硬化症2.瀰漫性筋膜炎伴嗜酸性粒細胞增多多在不習慣的劇烈運動後發病,多見於青年男性。本病特徵為上下肢突然出現壓痛性腫脹,肌肉樣硬結。面、手、足一般不受累。缺乏雷諾現象和內臟受累。抗核抗體陰性,嗜酸性粒細胞顯著增多。組織學特點為深部筋膜、皮下組織及真皮(程度較輕)有廣泛性炎症與硬化。
3.化學物、毒物所致硬皮樣綜合徵
(1)食用毒性油後先發生急性中毒症狀,然後轉為慢性病,出現周圍神經病、舍格倫綜合徵、硬皮及內臟損傷。發病是因為變性油所產生的自由基損害血管內皮,不牽涉到免疫機制。長期接觸二氧化矽,聚氯乙烯導致的硬皮、雷諾現象等也是毒性反應,因此臨床不象典型PSS,無自身抗體。
(2)乳房矽酮置入術後所出現的各種結蒂組織病現很受關注。有些患者的臨床與抗核抗體檢查結果均與典型PSS相似。
治療方案
 進行性系統性硬化症
進行性系統性硬化症2.瀰漫型PSS
(1)去除感染病灶,增加營養,注意保暖,避免過度勞累與精神緊張。
(2)抑制膠原增生:
①青黴胺(D-penicillamine):該藥有干擾膠原分子間交聯作用,抑制新膠原生物合成。開始250mg/d口服,逐漸增至1.0~1.5g/d,連服2~3年。對皮膚增厚和營養性改變有一定療效。但應密切注意可能產生的副性反應,如皮疹、肝、腎損害、骨髓抑制等。
②秋水仙鹼(colchicine):能阻止原膠原轉化為膠原、抑制膠原積聚。劑量為0.5~1.5mg/d,連服3個月至數年,對皮膚硬化、雷諾征及食管改變有一定療效。
③對氨基苯甲酸鉀potassiumpara-aminobenzoate):能增強單胺氧化酶活性,促使過多的5-HT分解,改善皮膚症狀,口服3~4g/d,連服數月至數年。
(3)血管擴張劑:對頻發的雷諾現象,可試用鈣通道阻滯藥,如硝苯地平(硝苯吡啶)等。此類藥物能一時性擴張痙攣的血管,療效有限。對PSS腎臟危象患者,用血管緊張素轉換酶抑制藥(ACEI)卡托普利(巰甲丙脯酸)治療,已取得積極效果,不僅能控制腎臟危象,而且對PSS其他症狀也有一定療效。研究提示PSS患者腎素-血管緊張素系統的激活先於腎臟危象的發生,因此,很難將繼發於PSS腎損害的高血壓和與PSS並存的原發性高血壓區分。伴有輕度高血壓的PSS患者應檢測血漿腎素活性。如果血漿腎素活性增高,應使用ACEI類藥物進行抗高血壓治療。如果腎素水平不高或存在ACEI類藥物使用的禁忌證,則可使用其他藥物如β受體阻滯藥、利尿劑、α受體阻滯藥、鈣通道阻滯藥、中樞興奮藥物甲基多巴或可樂定等。但β受體阻滯藥有可能加劇雷諾現象,應予以注意。
(4)生物製劑:隨著對PSS發病機制的深入研究,某些生物製劑已開始試用於治療PSS,如基因重組γ干擾素注射劑能向下調節成纖維細胞合成膠原,效力持久,用於臨床已收到初步效果。前列腺素E1也有較好療效並可改善雷諾現象。
(5)糖皮質激素:糖皮質激素可減輕皮膚的炎症水腫、減輕肺動脈高壓,但對腎損害無效。
(6)透析治療和腎移植:雖然上述抗高血壓和其他治療已使PSS腎臟危象患者1年生存率顯著提高,但之後仍有大量PSS伴惡性高血壓或腎衰的患者發生持續性腎功能惡化,需要長期腹膜透析、血液透析或腎移植。PSS患者大動脈痙攣、皮膚硬化、血管病變致動靜脈瘺關閉,使血液透析遇到較多困難,而腹膜纖維化和腹膜血流功能性減少致腹膜清除能力下降又使腹膜透析效果減低,並易發生感染。少數報導表明,有些伴惡性高血壓和腎衰的本病患者進行腎移植後,其腎功能在數月至1年自行恢復,尿量增加,不再需要透析。另一項研究表明,20例患者透析治療3月以後繼續使用ACEI,11例患者腎功能得到改善,不再需要透析。這種遲發性病情緩解的原因並不清楚,可能與血管痙攣的減輕、腎血管損傷的修復導致腎灌注、腎小球濾過和腎小管功能得到部分恢復有關。
1973年Richardson首次報導1例PSS患者經雙側腎切除治療高血壓後成功地進行了腎移植術,之後在更多的PSS患者也成功地進行了腎移植術。但是累及到腎、肺、心臟或胃腸道的廣泛病變則成為這種治療模式的絕對或相對禁忌證。雖然有報導移植腎中PSS復發者較多見,組織學檢查也支持復發的診斷,但這些組織學發現很難與排斥反應或環孢素毒性相鑑別,伴有內皮細胞毒性和血管痙攣特性的環孢素是否增加了同種異體腎移植後PSS復發的可能,或是接受腎移植的PSS患者對環孢素毒性易感性增加,目前尚不清楚。
採用轉換酶抑制藥和其他血管擴張劑進行有力的抗高血壓治療,以及採用透析和腎移植治療,能明顯改善PSS並發腎損害患者的預後。有關報導表明,PSS患者10年生存率達60%,而在30年前,其7年存活率僅為35%。
流行病學
 進行性系統性硬化症
進行性系統性硬化症