膜轉運(membranetransportprotein)也叫膜運輸蛋白。能選擇性地使非自由擴散的小分子物質透過質膜。
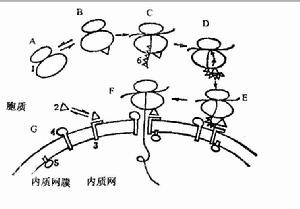 膜轉運
膜轉運細胞膜是脂雙分子層、蛋白質和少量糖組成的,就其化學本質而言,是半透膜。用人工脂膜測定證實,脂溶性分子和不帶電的極性小分子易於通過質膜擴散,例如O2、N2、乙醇、尿素、甘油等;不帶電的較大的極性分子如胺基酸、葡萄糖、蔗糖等難以透過;人工脂膜對帶電的分子和離子是高度不通透的。水分子與脂不相溶,但作為不帶電的雙極小分子,它能迅速地通過質膜。
細胞膜
細胞膜是防止細胞外物質自由進入細胞的屏障,它保證了細胞內環境的相對穩定,使各種生化反應能夠有序運行。但是細胞必須與周圍環境發生信息、物質與能量的交換,才能完成特定的生理功能。因此細胞必須具備一套物質轉運體系,用來獲得所需物質和排出代謝廢物,據估計細胞膜上與物質轉運有關的蛋白占核基因編碼蛋白的15~30%,細胞用在物質轉運方面的能量達細胞總消耗能量的三分之二。
細胞膜上存在兩類主要的轉運蛋白,即:載體蛋白(carrierprotein)和通道蛋白(channelprotein)。載體蛋白又稱做載體(carrier)、通透酶(permease)和轉運器(transporter),能夠與特定溶質結合,通過自身構象的變化,將與它結合的溶質轉移到膜的另一側,載體蛋白有的需要能量驅動,如:各類APT驅動的離子泵;有的則不需要能量,以自由擴散的方式運輸物質,如:纈氨酶素。通道蛋白與所轉運物質的結合較弱,它能形成親水的通道,當通道打開時能允許特定的溶質通過,所有通道蛋白均以自由擴散的方式運輸溶質。
被動運輸
一、簡單擴散
也叫自由擴散(freediffusing),特點是:①沿濃度梯度(或電化學梯度)擴散;②不需要提供能量;③沒有膜蛋白的協助。
某種物質對膜的通透性(P)可以根據它在油和水中的分配係數(K)及其擴散係數(D)來計算:
P=KD/t,t為膜的厚度。
脂溶性越高通透性越大,水溶性越高通透性越小;非極性分子比極性容易透過,小分子比大分子容易透過。具有極性的水分子容易透過是因水分子小,可通過由膜脂運動而產生的間隙。
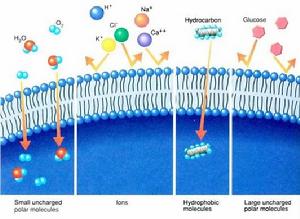 (圖5-1)不同物質透過人工脂雙層的能力
(圖5-1)不同物質透過人工脂雙層的能力事實上細胞的物質轉運過程中,透過脂雙層的簡單擴散現象很少,絕大多數情況下,物質是通過載體或者通道來轉運的。離子、葡萄糖、核苷酸等物質有的是通過質膜上的運輸蛋白的協助,按濃度梯度擴散進入質膜的,有的則是通過主動運輸的方式進行轉運。
二、協助擴散
也稱促進擴散(faciliatieddiffusion),其運輸特點是:①比自由擴散轉運速率高;②存在最大轉運速率;在一定限度內運輸速率同物質濃度成正比。如超過一定限度,濃度再增加,運輸也不再增加。因膜上載體蛋白的結合位點已達飽和;③有特異性,即與特定溶質結合。這類特殊的載體蛋白主要有離子載體和通道蛋白兩種類型。
(一)離子載體
離子載體(ionophore),是疏水性的小分子,可溶於雙脂層,提高所轉運離子的通透率,多為微生物合成,是微生物防禦被捕食或與其它物種競爭的武器,離子載體也是以被動的運輸方式運輸離子,可分成可動離子載體(mobileioncarrier)和通道離子載體(channelformer)兩類:
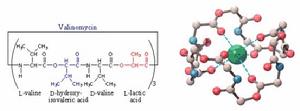 (圖5-2)纈氨黴素的分子結構
(圖5-2)纈氨黴素的分子結構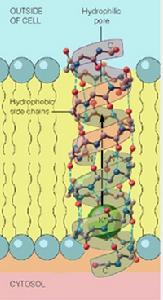 (圖5-3)短桿菌肽構成的通道
(圖5-3)短桿菌肽構成的通道(二)通道蛋白
通道蛋白(channelprotein)是衡跨質膜的親水性通道,允許適當大小的離子順濃度梯度通過,故又稱離子通道。有些通道蛋白形成的通道通常處於開放狀態,如鉀泄漏通道,允許鉀離子不斷外流。有些通道蛋白平時處於關閉狀態,即“門”不是連續開放的,僅在特定刺激下才打開,而且是瞬時開放瞬時關閉,在幾毫秒的時間裡,一些離子、代謝物或其他溶質順著濃度梯度自由擴散通過細胞膜,這類通道蛋白又稱為門通道(gatedchannel)。
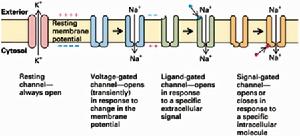 (圖5-4)各類離子通道
(圖5-4)各類離子通道不同通道對不同離子的通透性不同,即離子選擇性(ionicselectivity)。這是由通道的結構所決定的,只允許具有特定離子半徑和電荷的離子通過。根據離子選擇性的不同,通道可分為鈉通道、鈣通道、鉀通道、氯通道等。但通道的離子選擇性只是相對的而不是絕對的,比如,鈉通道除主要對Na+通透外,對NH4+也通透,甚至於對K+也稍有通透。
1、配體門通道
表面受體與細胞外的特定物質(配體ligand)結合,引起門通道蛋白發生構象變化,結果使“門”打開,又稱離子通道型受體。分為陽離子通道,如乙醯膽鹼、谷氨酸和五羥色胺的受體,和陰離子通道,如甘氨酸和γ-氨基丁酸的受體。
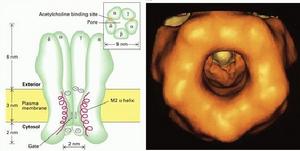 (圖5-5)乙醯膽鹼受體
(圖5-5)乙醯膽鹼受體Ach門通道具有具有三種狀態:開啟、關閉和失活。當受體的兩個α亞單位結合Ach時,引起通道構象改變,通道瞬間開啟,膜外Na+內流,膜內K+外流。使該處膜內外電位差接近於0值,形成終板電位,然後引起肌細胞動作電位,肌肉收縮。即是在結合Ach時,Ach門通道也處於開啟和關閉交替進行的狀態,只不過開啟的機率大一些(90%)。Ach釋放後,瞬間即被乙醯膽鹼酯酶水解,通道在約1毫秒內關閉。如果Ach存在的時間過長(約20毫秒後),則通道會處於失活狀態。
筒箭毒和α銀環蛇毒素可與乙醯膽鹼受體結合,但不能開啟通道,導致肌肉麻痹。
2、電位門通道
電位門通道(voltagegatedchannel)是對細胞內或細胞外特異離子濃度發生變化時,或對其他刺激引起膜電位變化時,致使其構象變化,“門”打開。如:神經肌肉接點由Ach門控通道開放而出現終板電位時,這個電位改變可使相鄰的肌細胞膜中存在的電位門Na+通道和K+通道相繼激活(即通道開放),引起肌細胞動作電位;動作電位傳至肌質網,Ca2+通道打開引起Ca2+外流,引發肌肉收縮。
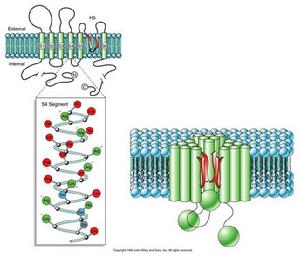 (圖5-6)鉀電位門通道
(圖5-6)鉀電位門通道K+通道具有三種狀態:開啟、關閉和失活。目前認為S4段是電壓感受器,S4高度保守,屬於疏水片段,但每隔兩個疏水殘基即有一個帶正電荷的精氨酸或賴氨酸殘基。S4段上的正電荷可能是門控電荷,當膜去極化時(膜外為負,膜內為正),引起帶正電荷的胺基酸殘基轉向細胞外側面,通道蛋白構象改變,“門”打開,大量K+外流,此時相當於K+的自由擴散。K+電位門它和Ach配體門一樣只是瞬間(約幾毫秒)開放,然後失活。此時N端的球形結構,堵塞在通道中央,通道失活,稍後球體釋放,“門”處於關閉狀態。
鏈黴菌(Streptomyceslividans)的鉀離子通道KcsA也是由四個亞單位構成的,但每個亞基只有兩個跨膜片段,結構較為簡單。1998年,RoderickMacKinnon等用X射線衍射技術獲得了高分辨的KcsA通道圖像,發現離子通透過程中離子的選擇性主要發生在狹窄的選擇性過濾器中。選擇性過濾器長1.2nm,孔徑約為0.3nm(K+脫水後直徑約0.26nm),內部形成一串鉀離子特異結合位點,從而只有鉀離子能夠“排隊”通過通道。
河豚毒素(Tetrodotoxin,TTX)能阻滯鈉通道,毒素帶正電荷的胍基伸人鈉通道的離子選擇性過濾器,和通道內壁上的游離羧基結合,毒素其餘部分堵塞通道外側端,妨礙鈉離子進入,導致肌肉麻痹。
3、環核苷酸門通道
與電壓門控性通道家族關係密切的是CNG通道,從蛋白質序列來看,它們與電壓門鉀通道結構相似,也有6個跨膜片段,各為帶電荷片段,P區構成孔道內側,整個通道為四聚體結構。在CNG通道中,細胞內的C末端較長,上面含有環核苷酸的結合位點。
環核苷酸門通道分布於化學感受器和光感受器中,與膜外信號的轉換有關。如氣味分子與化學感受器中的G蛋白偶聯型受體結合,可激活腺苷酸環化酶,產生cAMP,開啟cAMP門控陽離子通道(cAMP-gatedcationchannel),引起鈉離子內流,膜去極化,產生神經衝動,最終形成嗅覺或味覺。
4、機械門通道
細胞可以接受各種各樣的機械力刺激,如摩擦力、壓力、牽拉力、重力、剪下力等。細胞將機械刺激的信號轉化為電化學信號最終引起細胞反應的過程稱為機械信號轉導(mechanotransduction)。
目前比較明確的有兩類機械門通道,其一是牽拉活化或失活的離子通道,另一類是剪下力敏感的離子通道,前者幾乎存在於所有的細胞膜,研究較多的有血管內皮細胞、心肌細胞以及內耳中的毛細胞等,後者僅發現於內皮細胞和心肌細胞。牽拉敏感的離子通道是指能直接被細胞膜牽拉所開放或關閉的離子通道。其特點為對離子的無選擇性、無方向性、非線性以及無潛伏期。這種通道為2價或1價的陽離子通道,有Na+、K+、Ca2+,以Ca2+為主。研究表明,當內皮細胞被牽拉時,由於通道開放引起Ca2+內流,使以Ca2+介導的血管活性物質分泌增多,Ca2+還可作為胞內信使,導致進一步的反應。
內耳毛細胞頂部的聽毛也是對牽拉力敏感的感受裝置,聽毛彎曲時,毛細胞會出現暫短的感受器電位。從聽毛受力而致聽毛根部所在膜的變形,到該處膜出現跨膜離子移動之間,只有極短的潛伏期,
5、水通道
長期以來,普遍認為細胞內外的水分子是以簡單擴散的方式透過脂雙層膜。後來發現某些細胞在低滲溶液中對水的通透性很高,很難以簡單擴散來解釋。如將紅細胞移入低滲溶液後,很快吸水膨脹而溶血,而水生動物的卵母細胞在低滲溶液不膨脹。因此,人們推測水的跨膜轉運除了簡單擴散外,還存在某種特殊的機制,並提出了水通道的概念。
1988年Agre在分離純化紅細胞膜上的Rh血型抗原時,發現了一個28KD的疏水性跨膜蛋白,稱為CHIP28(Channel-Formingintegralmembraneprotein),1991年得到CHIP28的cDNA序列,Agre將CHIP28的mRNA注入非洲爪蟾的卵母細胞中,在低滲溶液中,卵母細胞迅速膨脹,並於5分鐘內破裂,純化的CHIP28置入脂質體,也會得到同樣的結果。細胞的這種吸水膨脹現象會被Hg2+抑制,而這是已知的抑制水通透的處理措施。這一發現揭示了細胞膜上確實存在水通道,Agre因此而與離子通道的研究者RoderickMacKinnon共享2003年的諾貝爾化學獎。
目前在人類細胞中已發現的此類蛋白至少有11種,被命名為水通道蛋白(Aquaporin,AQP),均具有選擇性的讓水分子通過的特性。在實驗植物擬南芥(Arabidopsisthaliana)中已發現35個這類水通道。
水通道的活性調節可能具有以下途徑:通過磷酸化使AQP的活性增強;通過膜跑運輸改變膜上AQP的含量,如血管加壓素(抗利尿激素)對腎髒遠曲小管和集合小管上皮細胞水通透性調節;通過調節基因表達,促進AQP的合成。
[1]按照受體結構和對藥物反應的不同,Ach受體分為兩大類:被毒蕈鹼(Muscarine)激動的Ach受體稱為毒蕈鹼型Ach受體(M-AchR),被菸鹼(Nicotine)激動的Ach受體稱為菸鹼型Ach受體(N-AchR),前者主要分布於副交感神經節後纖維和極少數交感神經節後纖維支配的效應器膜上,後者可分為神經型和肌肉型。
主動運輸
主動運輸的特點是:①逆濃度梯度(逆化學梯度)運輸;②需要能量(由ATP直接供能)或與釋放能量的過程偶聯(協同運輸);③都有載體蛋白。
主動運輸所需的能量來源主要有:
1.協同運輸中的離子梯度動力;
2.ATP驅動的泵通過水解ATP獲得能量;
一、鈉鉀泵
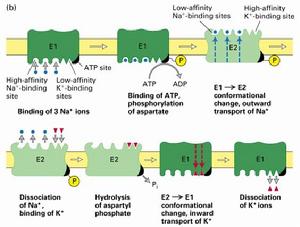 (圖5-7)鈉鉀泵
(圖5-7)鈉鉀泵鈉鉀泵的一個特性是他對離子的轉運循環依賴自磷酸化過程,ATP上的一個磷酸基團轉移到鈉鉀泵的一個天冬氨酸殘基上,導致構象的變化。通過自磷酸化來轉運離子的離子泵就叫做P-type,與之相類似的還有鈣泵和質子泵。它們組成了功能與結構相似的一個蛋白質家族。
Na+-K+泵作用是:①維持細胞的滲透性,保持細胞的體積;②維持低Na+高K+的細胞內環境,維持細胞的靜息電位。
烏本苷(ouabain)、地高辛(digoxin)等強心劑能抑制心肌細胞Na+-K+泵的活性;從而降低鈉鈣交換器效率,使內流鈣離子增多,加強心肌收縮,因而具有強心作用。
二、鈣離子泵
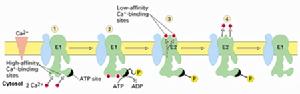 (圖5-8)鈣離子泵
(圖5-8)鈣離子泵位於肌質網(sarcoplasmicreticulum)上的鈣離子泵是了解最多的一類P型離子泵,占肌質網膜蛋白質的90%。肌質網是一類特化的內質網,形成網管狀結構位於細胞質中,具有貯存鈣離子的功能。肌細胞膜去極化後引起肌質網上的鈣離子通道打開,大量鈣離子進入細胞質,引起肌肉收縮之後由鈣離子泵將鈣離子泵回肌質網。
三、質子泵
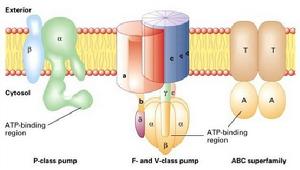 (圖5-9)四種ATP驅動的離子泵
(圖5-9)四種ATP驅動的離子泵1、P-type:載體蛋白利用ATP使自身磷酸化(phosphorylation),發生構象的改變來轉移質子或其它離子,如植物細胞膜上的H+泵、動物細胞的Na+-K+泵、Ca2+離子泵,H+-K+ATP酶(位於胃表皮細胞,分泌胃酸)。
2、V-type:位於小泡(vacuole)的膜上,由許多亞基構成,水解ATP產生能量,但不發生自磷酸化,位於溶酶體膜、動物細胞的內吞體、高爾基體的囊泡膜、植物液泡膜上。
3、F-type:是由許多亞基構成的管狀結構,H+沿濃度梯度運動,所釋放的能量與ATP合成耦聯起來,所以也叫ATP合酶(ATPsynthase),F是氧化磷酸化或光合磷酸化偶聯因子(factor)的縮寫。F型質子泵位於細菌質膜,線粒體內膜和葉綠體的類囊體膜上。F型質子泵不僅可以利用質子動力勢將ADP轉化成ATP,也可以利用水解ATP釋放的能量轉移質子。
四、ABC轉運器
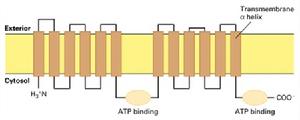 (圖5-10)ABC轉運器
(圖5-10)ABC轉運器在大腸桿菌中78個基因(占全部基因的5%)編碼ABC轉運器蛋白,在動物中可能更多。雖然每一種ABC轉運器只轉運一種或一類底物,但是其蛋白家族中具有能轉運離子、胺基酸、核苷酸、多糖、多肽、甚至蛋白質的成員。ABC轉運器還可催化脂雙層的脂類在兩層之間翻轉,這在膜的發生和功能維護上具有重要的意義。
第一個被發現的真核細胞的ABC轉運器是多藥抗性蛋白(multidrugresistanceprotein,MDR),該基因通常在肝癌患者的癌細胞中過表達,降低了化學治療的療效。約40%的患者的癌細胞內該基因過度表達。
ABC轉運器還與病原體對藥物的抗性有關,如臨床常用的抗真菌藥物有氟康唑、酮康唑、伊曲康唑等,真菌對這些藥物產生耐藥性的一個重要機制是通過MDR蛋白降低了細胞內的藥物濃度。
五、協同運輸
協同運輸(cotransport)是一類靠間接提供能量完成的主動運輸方式。物質跨膜運動所需要的能量來自膜兩側離子的電化學濃度梯度,而維持這種電化學勢的是鈉鉀泵或質子泵。動物細胞中常常利用膜兩側Na+濃度梯度來驅動,植物細胞和細菌常利用H+濃度梯度來驅動。根據物質運輸方向與離子沿濃度梯度的轉移方向,協同運輸又可分為:同向協同(symport)與反向協同(antiport)。
1、同向協同
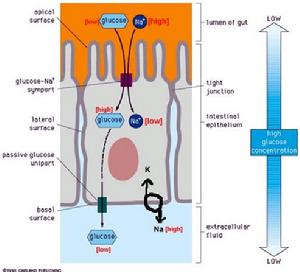 (圖5-11)小腸對葡萄糖的吸收
(圖5-11)小腸對葡萄糖的吸收2、反向協同
反向協同(antiport)物質跨膜運動的方向與離子轉移的方向相反(圖5-12),如動物細胞常通過Na+/H+反向協同運輸的方式來轉運H+以調節細胞內的PH值,即Na+的進入胞內伴隨者H+的排出。此外質子泵可直接利用ATP運輸H+來調節細胞PH值。
還有一種機制是Na+驅動的Cl--HCO3-交換,即Na+與HCO3-的進入伴隨著Cl-和H+的外流,如紅細胞膜上的帶3蛋白。
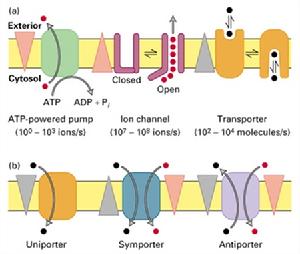 (圖5-12)幾類轉運蛋白的比較
(圖5-12)幾類轉運蛋白的比較膜泡運輸的基本概念
真核細胞通過內吞作用(endocytosis)和外排作用(exocytosis)完成大分子與顆粒性物質的跨膜運輸。在轉運過程中,質膜內陷,形成包圍細胞外物質的囊泡,因此又稱膜泡運輸。細胞的內吞和外排活動總稱為吞排作用(cytosis)。
一、吞噬作用
細胞內吞較大的固體顆粒物質(圖5-13),如細菌、細胞碎片等,稱為吞噬作用(phagocytosis)。吞噬現象是原生動物獲取營養物質的主要方式,在後生動物中亦存在吞噬現象。如:在哺乳動物中,中性顆粒白細胞和巨噬細胞具有極強的吞噬能力,以保護機體免受異物侵害。
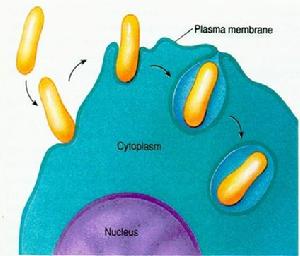 (圖5-13)吞噬作用
(圖5-13)吞噬作用二、胞飲作用
細胞吞入的物質為液體或極小的顆粒物質(圖5-14),這種內吞作用稱為胞飲作用(pinocytosis)。胞飲作用存在於白細胞、腎細胞、小腸上皮細胞、肝巨噬細胞和植物細胞。
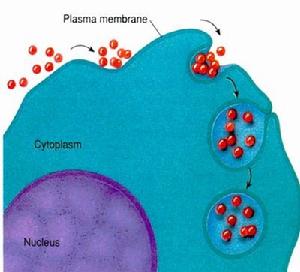 (圖5-14)胞飲作用
(圖5-14)胞飲作用三、外排作用
與內吞作用的順序相反,某些大分子物質通過形成小囊泡從細胞內部移至細胞表面,小囊泡的膜與質膜融合,將物質排出細胞之外,這個過程稱為外排作用(exocytosis),細胞內不能消化的物質和合成的分泌蛋白都是通過這種途徑排出的(圖5-15)。
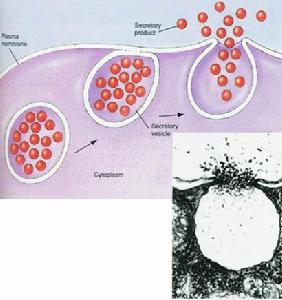 (圖5-15)外排作用
(圖5-15)外排作用四、穿胞運輸
在動物組織中,有的細胞通過內吞和外排相偶聯,在細胞的一側形成胞飲小泡穿越細胞質,另一側使小泡中的物質釋放出去。如:肝細胞從血竇中吸收免疫球蛋白A(IgA),通過穿胞運輸輸送到膽微管;大鼠中,母鼠血液中抗體經穿胞運輸進入乳汁。
五、胞內膜泡運輸
細胞內部內膜系統各個部分之間的物質傳遞也通過膜泡運輸方式進行。如從內質網到高爾基體;高爾基體到溶酶體;細胞分泌物的外排,都要通過過渡性小泡進行轉運。胞內膜泡運輸沿微管運行,動力來自馬達蛋白(motorproteins)。目前已發現的馬達蛋白有兩種:一種是動力蛋白(dynein),可沿微管向負端移動;另一種為驅動蛋白(kinesin),可牽引物質向微管的正端移動。通過這兩種蛋白的作用,可使膜泡被運抵一定區域。
相關詞條
物質、能量、生理功能、基因編碼蛋白、載體蛋白、通道蛋白、通透酶、纈氨酶素、溶質、小分子、大分子、尿素、甘油、葡萄糖、蔗糖、雙脂層、微生物、虹吸管、羰基-氰、三氟甲氧基苯肼、離子黴素、跨膜通道、陽離子、短肽、鉀離子、配體門通道、電位門通道、鈉通道、鈣通道、鉀通道、氯通道、乙醯膽鹼、谷氨酸、五羥色胺、電位差、遠祖基因、鏈黴菌、河豚毒素、摩擦力、壓力、牽拉力、重力、剪下力、卵母細胞、溶血、諾貝爾化學獎、毒蕈鹼、大亞基、小亞基、靜息電位、高爾基、細菌質膜、離子、胺基酸、核苷酸、多糖、多肽、氟康唑、酮康唑、伊曲康唑
