組分
由於蛋白質化學和免疫化學技術的進步,自血液中分離、純化補體成分成功,
 補體系統
補體系統已證明補體是單一成分的論點是不正確的,它是由三組球蛋白大分子組成。即第一組分是由9種補體成分組成,分別命名為C1、C2、C3、C4、C5、C6、C7、C8、C9。其中C1是由三個亞單位組成,命名為Clq、Clr、Cls,因此第一組分是由11種球蛋白大分子組成。發現一些新的血清因子參予補體活化,但它們不是經過抗原抗體複合物的活化途徑。而是通過旁路活化途徑。這此些因子包括B因子、D因P因子,它們構成補體的第二組分。其後又發現多種參矛控制補體活化的抑制因子或滅活因子,如CI抑制物、I因子、H因子、C4結合蛋白、過敏毒素滅活因子等。這些因子可控制補體分子的活化,對維持補體在體內的平衡起調節作用,它們構成了補體的第三組分。
由於補體活化另一途徑的深入研究,對補體系統的生物學意義有了新的識別,從而打破了對補體的傳統觀點,建立了新的概念。即補體系統是由將近20多種血清蛋白組成的多分子系統,具有酶的活性和自我調節作用。它至少有二種不同的活化途徑,其生物學意義不僅是抗體分子的輔助或增強因子,也具有獨立的生物學作用,對機體的防禦功能、免疫系統功能的調節以及免疫病理過程都發揮重要作用。
1968年世界衛生組織(WHO)的補體命名委員會對補體進行了統一命名。分別以C1-C9命名,1981年對新發現的一些成分和因子也進行了統一命名。每一補體的肽鏈結構用希臘字母表示,如C3a和β鏈等。每一分子的酶解斷片可用小寫英文字母表示如C3a和C3b等酶解斷片,具有酶活性分子可在其上畫橫線表示之,如C1為無酶活性分子,而C1為有酶活性分子。對具有酶活性的複合物則套用其斷片表示,如C3轉化酶可用C4B,2a表示。
補體分子是分別由肝細胞、巨噬細胞以及腸黏膜上皮細胞等多種細胞產生的。其理化性質及其在血清中的含量差異甚大。全部補體分子的化學組成均為多糖蛋白,各補體成分的分子量變動範圍很大,其中C4結合蛋白的分子量最大,為55萬,D因子分子量最小僅為2.3萬。大多數補體成分的電泳遷移率屬β球蛋白,少數屬a球蛋白及γ球蛋白。血清中補體蛋白約占總球蛋白的10%,其中含量最高的為C3,約含1mg/ml,而D因子僅含1μg/ml,二者相差約千倍。人類某些疾病其總補含量或單一成分含量可發生變化,因而對體液中補體水平的測定,或組織內補體定位觀察,對一些疾病的診斷具有一定意義。
類型
經典激活(classicalpathway)
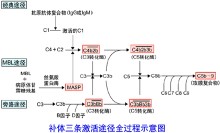 補體三條激活途徑
補體三條激活途徑補體在溶菌或溶血反應時被激活的過程中,11種成分可分為3個功能單位,即①識別單
位:包括C1q、C1r、C1s;②活化單位:包括C2、C3、C4,③膜攻擊單位:包括C5、C6、C7、C8和C9。同一功能單位的補體成分彼此間有化學親和性,激活後可相互結合在一起,共同執行使細胞溶解這一生物學功能。因此,補體的經典激活途徑可分為識別、活化和膜攻擊3個階段。這3個階段一般在靶細胞膜的3個不同部位進行。補體在激活過程中C2、C3、C4、C5均分別裂
解成2個或2個以上的片段,分別標以a、b等符號,如 C3a、C3b、C3c等。其中C2a、C3b、C4b、C5b直接或間接結合在靶細胞上,以固相的形式參與溶細胞過程,C3a、C5a游離在液相。補體在激活過程中, C5、C6、C7經活化後還可聚合成 C567.並與C3a、C5a一起發揮特殊的生物學功能。(圖1)
替代激活
替代激活途徑(alternative pathway)是直接由C3開始的補體激活途徑。此途徑既不需要抗原-抗體複合物,也不需激活C1、C2和C4。由於早年認為備解素是替代激活途徑的主要成分,所以也稱為備解素途徑。參與替代激活途徑的成分有多種(圖2)。
凝集素激活
凝集素激活途徑(lectin pathway)是由炎症期產生的蛋白與病原體結合啟動激活,同旁路激活途徑(alternative pathway)一樣,無需依賴抗體(antibody independent)。與旁路途經不同的是,雖不需激活C1(即與抗體FC位點結合形成C1qr2s2),但與經典途徑一樣,仍需進行C2和C4的激活,再進行C3(即C4b2a3b)。
激活途徑
補體系統各成分通常多以非活性狀態存在於血漿之中,當其被激活物質活化之後, 才表現出各種生物學活性。補體系統的激活可以從C1開始;也可以越過C1、C2、C4,從C3開始。前一種激活途徑稱為經典途徑(classical pathway),或傳統途徑。“經典”,“傳統”只是意味著人們早年從抗原體複合物激活補體的過程來研究補體激活的機制時,發現補體系統是從C1開始激活的連鎖反應。從種系發生角度而言,旁路途徑是更為古老的、原始的激活途徑。從同一個體而言,在尚未形成獲得性免疫,即未產生抗體之前,經旁路途徑激活補體,即可直接作用於入侵的微生物等異物,作為非特異性免疫而發揮效應。由於對旁路途徑的認識,遠遠晚在經典之後,加上人們先入為主觀念,造成了命名的不合理。
經典途徑
參與補體經典激活途徑的成分包括C1-C9。按其在激活過程中的作用,人為地分成三組,即識別單位(Clq、Clr、Cls)、活化單位(C4、C2、C3)和膜攻擊單位(C5-C9),分別在激活的不同階段即識別階段、活化階段和膜功擊階段中發揮作用。
(一)識別階段
Clq:Clq分子有6個能與免疫球蛋白分子上的補體結合點相結合的部位。當兩個以上的結合部位與免疫球蛋白分子結合時,即Clq橋聯免疫球蛋白之後,才能激活後續的補體各成分IgG為單體,只有當其與抗原結合時,才能使兩個以上的IgG分子相互靠攏,提供兩個以上相鄰的補體結合點不能與Clq接觸,只有當IgM與抗原結合,發生構型改變,暴露出補體結合部位之後,才能與Clq結合。一個分子的IgM激活補體的能力大於IgG。Clq與補體結合點橋聯後,其構型發生改變,導致Clr和Cls的相繼活化。
Clr:Clr在C1大分子中起著連線Clq和Cls的作用。Clq啟動後可引起Clr構型的改變,在活性的Clr,後者可使Cls活化。
Cls:Clr使Cls的肽鏈裂解,其中一個片段Cls具有酯酶活化,即CI的活性。此酶活性可被C1INH滅活。
在經典途徑中,一旦形成Cls,即完成識別階段,並進入活化階段。
(二)活化階段
CI作用於後續的補體成分,至形成C3轉化酶(C42)和C5轉化酶(C423)的階段。
C4:C4是CI的底物。在Mg2 存在下,CI使C4裂解為C4a和C4b兩個片段,並使被結合的C4b迅速失去結合能力。CI與C4反應之後能更好地顯露出CI作用於C2的酶活性部位。
C2:C2雖然也是CI的底物,但CI先在C4作用之後明顯增強了與C2的相互作用。C2在Mg2 存在下被CI裂解為兩個片段C2a和C2b。當C4b與C2a結合成C4b2b(簡寫成C42)即為經典途徑的C3轉化酶。
C3:C3被C3轉化酶裂解在C3a和C3b兩個片段,分子內部的疏酯基(-S-CO-)外露,成為不穩定的結合部位。硫酯基經加水分解,成為-SH和-COOH也可與細菌或細胞表面的-NH2和-OH反應而共價結合。因此,C3b通過不穩定的結合部位,結合到抗原抗體複合物上或結合到C42激活C3所在部位附近的微生物、高分子物質及細胞膜上。這點,對於介導調理作用和免疫粘附作用具有重要意義。C3b的另一端是個穩定的結合部位。C3b通過此部位與具有C3b受體的細胞相結合。C3b可被I因子滅活。C3a留在液相中,具有過敏毒素活性,可被羥肽酶B滅活。
(三)膜攻擊階段
C5轉化酶裂解C5後,繼而作用於後續的其他補體成分,最終導致細胞受損、細胞裂解的階段。
C5:C5轉化酶裂解C5產生出C5a和C5b兩個片段。C5a游離於液相中,具有過敏毒素活性和趨化活性。C5b可吸附於鄰近的細胞表面,但其活性極不穩定,易於衰變成C5bi。
C6-C9:C5b雖不穩定,當其與C6結合成C56複合物則較為穩定,但此C5b6並無活性。C5b6與C7結合成三分子的複合物C5b67時,較穩定,不易從細胞膜上解離。
C5b67即可吸附於已致敏的細胞膜上,也可吸附在鄰近的,未經致敏的細胞膜上(即未結合有抗體的細胞膜上)。C5b67是使細胞膜受損傷的一個關鍵組分。它與細胞膜結合後,即插入膜的磷脂雙層結構中。
若C5b67未與適當的細胞膜結合,則其中的C5b仍可衰變,失去與細胞膜結合和裂解細胞的活性。
C5b67雖無酶活性,但其分子排列方式有利於吸附C8形成C5678。其中C8是C9的結合部位,因此繼續形成C5-9,即補體的膜攻擊單位,可使細胞膜穿孔受損。
-不C5b、C6、C7結合到細胞膜下是細胞膜仍完整無損;只有在吸附C8之後才出現輕微的損傷,細胞內容物開始滲漏。在結合C9以後才加速細胞膜的損傷過程,因而認為C9是C8的促進因子。
旁路途徑
旁路激活途徑與經典激活途徑不同之處在於激活是越過了C1、C4、C2三種成分,直接激活C3繼而完成C5至C9各成分的連鎖反應,還在於激活物質並非抗原抗體複合物而是細菌的細胞壁成分—脂多糖,以及多糖、肽聚糖、磷壁酸和凝聚的IgA和IgG4等物質。旁路激活途徑在細菌性感染早期,尚未產生特異性抗體時,即可發揮重要的抗感染作用。
(一)生理情況下的準備階段
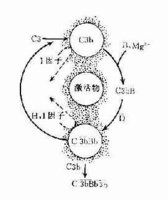
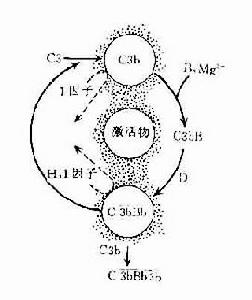
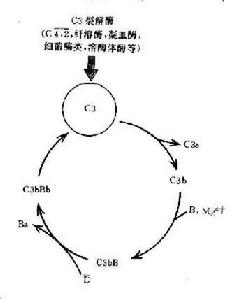
在正常生理情況下,C3與B因子、D因子等相互作用,可產生極少量的C3B和C3bBb(旁路途徑的C3轉化酶),但迅速受H因子和I因子的作用,不再能激活C3和後續的補體成分。只有當H因子和I因子的作用被阻擋之際,旁路途徑方得以激活。
C3:血漿中的C3可自然地、緩慢地裂解,持續產生少量的C3b,釋入液相中的C3b迅速被I因子滅活。
B因子:液相中緩慢產生的C3b在Mg2 存在下,可與B因子結合形成C3Bb。
D因子:體液中同時存在著無活性的D因子和有活性的D因子(B因子轉化酶)。D因子作用於C3bB,可使此複合物中的B因子裂解,形成C3bBb和Ba游離於液相中。C3bBb可使C3裂解為C3a和C3b,但烊際上此酶效率不高亦不穩定,H因子可置換C3bBb複合物中的Bb,使C3b與Bb解離,解離或游離的C3b立即被I因子滅活。因此,在無激活物質存在的生理情況下,C3bBb保持在極低的水平,不能大量裂解C3,也不能激活後續補體成分。但是這種C3的低速度裂解和低濃度C3bBb的形成,具有重大意義。可比喻為處於“箭在弦上,一觸即發”的狀態。
(二)旁路途徑的激活
旁路途徑的激活在於激活物質(例如細菌脂多糖、肽聚糖;病素感染細胞、腫瘤細胞,痢疾阿米巴原蟲等)的出現。激活物質的存在為C3b或C3bBb提供不易受H因子置換Bb,不受Ⅰ因子滅活C3b的一種保護性微環境,使旁路激活途徑從和緩進行的準備階段過渡到正式激活的階段。
(三)激活效應的擴大
C3在兩條激活途徑中都占據著重要的地位。C4是血清中含量最多的補體成分,這也正是適應其作用之所需。不論在經典途徑還是在旁路途徑,當C3被激活物質激活時,其裂解產物C3b又可在B因子和D因子的參與作用下合成新的C3bBb。後者又進一步使C3裂解。由於血漿中有豐富的C3,又有足夠的B因子和Mg2 ,因此這一過程一旦被觸發。就可能激活的產生顯著的擴大效應。有人稱此為依賴C3Bb的正反饋途徑,或稱C3b的正反饋途徑。
補體的兩條激活途徑有共同之處,又有各自的特點。在補體激活過程中,兩條途徑都是補體各成分的連鎖反應,許多成分在相繼活化後被裂解成一大一小兩個片段;不同的片段或片段的複合物可在靶細胞表面向前移動,如C42,C423,C5b,C567,雖亦可原始的激活部位就地形成複合物,但仍以移動為主,在激活過程中,補體成分和(或)其裂解產物組成更大的複合物,同時又都在擴大其激活效應,這一過程可形象地比喻為“滾雪球”。l實際兩條途徑相互作用,發揮協同作用,增加補體系統對機體的保護,過激後成為免疫過激(也就是過敏反應),造成對機體的損害。
理化性質
補體系統中各成分的理化性狀,補體成分大多是β球蛋白,少數幾種屬a或γ球蛋白,分子量在25~390KD之間。在血清中的含量以C3為最高,達1300μg/ml,其次為C4、S蛋白和H因子,各約為C3含量的1/3;其他成分的含量僅為C3的1/10或更低。
補體受體
補體成分激活後產生的裂解片段,能與免疫細胞表面的特異性受體結合。
 補體系統
補體系統這對於補體發揮其生物學活性具有重要意義。
補體受體(complementruceptor,CR)曾按其所結合配體而命名為C3b受體、C3d受體等;但經詳細研究後發現,補體受體並非僅與C3裂解產物反應,因而按其發現先後依次命名為CR1(CD35),CR2(CD21),CR3(CD11b/CD18),CR4(gp150,90:CD11c/CD18)。其主要特徵列於表3-5。此外,尚有其他補體成分的受體,如Ciq受體、C3a受體、C5a受體等。因對其了解不夠清楚,不擬介紹。
一、CR1(CD35)
CR1作為免疫粘附(immuneadherent,IA)受體而引起免疫粘附現象早已熟知。此受體也稱為C3b受體或C3b/C4b受體。據報導,紅細胞上的CR1數約為50-1400個/細胞,其數目顯著少於B細胞和吞噬細胞,但體內90%的CR1卻存於紅細胞上。
提純的CR1為分子量約200kD的糖蛋白,但後來發現它有4種分子量不同的同種異型。Wong等(1986)已經闡明,分子量的差異是由於基因不同所致。
CR1的免疫功能可能有以下幾方面:①中性粒細胞和單核-巨噬細胞上的CR1,可與結合在細菌或病毒上的C3b結合,促進吞噬細胞的吞噬作用;②促進兩條激活途徑中的C3轉化酶(C42),C3bBb)的激活;③作為I因子的輔助因子,促使C3b和C4b滅活;④紅細胞上的CR1可與被調理(結合有C3b)的細胞、病毒或免疫複合物等結合,以便運送到肝、脾進行處理,SLE病人免疫複合物量明顯增多,其紅細胞膜上的CR1在體內有運送免疫複合物的作用;⑤B淋巴細胞膜上的CR1與CR2協同作用下,可促使B細胞活化。
二、CR2(CD21)
CR2舊稱C3d受體,已經證明,它是B細胞上的EB病毒受體。CR2配體按其親和性的高低程度依次為C3dg、C3d、Ic3b。C3b親和性雖低,但亦可與其反應。
CR2的免疫功能尚未闡明清楚,但實驗表明,當加入CR2配體時可使B細胞活化。據此推想,在抗體的二次應答中它也許會想某種作用,即借結合在抗原複合物上的C3裂解產物,引起針對該抗原的二次抗體應答。
三、CR3(CD11b/CD18)
CR3亦稱為Ic3b受體,CR3的配體是iC3b,但CR1、CR2、也和iC3b反應。CR3與配體結合時尚需有二價離子存在,為其特點。
CR3是由分子量165kD的α鏈(CD11b)和95kD的β鏈(CD18)非共價結合的糖蛋白,識別此分子的單克隆抗體有Mac-1和Mo-1等。CR3與CR4(CD11C/CD18)有共同的β鏈,因此其功能也多有相似之處,白細胞粘附缺陷病(leucocyteadhesion deficiency)病人缺乏這種共同的β鏈。病人的中性粒細胞雖正常,但不能停留在感染的部位,因此病人易反覆遭受感染。這表明CR3和CR4均與吞噬功能密切相關。
四、CR4(gp150/95,CD11c/CD18)
中性粒細胞和單核-巨噬細胞高度表達本受體。其配體為iC3b,但針對其他補體受體的單克隆抗體不能阻斷CR4與iC3b的結合,證明CR4的存在。CR4與gp150/95為同一分子,對其功能尚有諸多不明之處。據認為CR4在排除組織內與iC3b的結合的顆粒上起作用。它和CR3一樣,與配體結合需有二價離子的存在。CR3很可能在機體防禦上有重要作用。
免疫系統/ 免疫學
| 免疫系統 | 它是人體抵禦病原菌侵犯最重要的保衛系統。 |
| 系統 | |
| 抗原與抗體 | 抗原 (超抗原, 變應原) | 半抗原 表位 (線性表位, 構象表位) 抗體 (單克隆抗體, 多克隆抗體, 自身抗體) | 多克隆B細胞反應 | 同種異型 | 免疫球蛋白同種異型 | 遺傳型 | 免疫複合物 |
| 免疫細胞/白細胞 | 淋巴系細胞:T細胞 | B細胞 | NK細胞 髓系細胞:肥大細胞 | 嗜鹼性粒細胞 | 嗜酸性粒細胞 | 巨噬細胞 吞噬細胞:中性粒細胞 | 巨噬細胞 | 網狀內皮系統 抗原遞呈細胞:樹突狀細胞 | 巨噬細胞 | B細胞 |
| 免疫 與 耐受 | 作用:免疫性 | 自身免疫 | 變態反應 | 炎症 | 交叉反應性 無作用:耐受 (中樞耐受, 外周耐受, 克隆無能, 克隆缺失) | 免疫缺損 |
| 免疫遺傳學 | 體細胞超突變 | V(D)J 重組 | 免疫球蛋白類別轉換 | MHC/HLA |
| 免疫物質 | 細胞因子 | 調理素 | 溶細胞素 |
| 其他 | 診斷免疫學 |