結構
補體的分子生物學進展迅猛,對補體系統的活化機理和功能得到了分子
 補體成分
補體成分一、補體蛋白結構的共同性
通過對補體系統的蛋白結構進一步探查,表現了一些頗具特色的結構功能域(module),並根據它們在胺基酸序列上的同源性,將它們歸為幾個不同的蛋白家族。同一家族中的各個成員通常具有相類似的結構和功能。此外,根據不同補體蛋白基因間的同源性,提示每個家族的成員可能是由一個共同的祖基因複製而來,出現結構上的多樣性,進而使各種補體蛋白又具有各自特定的功能。
(一)C1q與其相關的分子
C1q與其相關的分子:甘露糖結合蛋白(mannose-bindingproteinMBP)、肺表面活性物質脫輔基蛋白A和D(surfactantproteinAandDSP-ASP-D)、類風濕因子(RF)和膠固素(conglutinin)等,為具有以膠原樣蛋白和凝集素區結構為特徵的一組蛋白。因此有人將collagen與lectin兩字縮合,歸納稱為“collectin”(可暫譯為膠凝素)。這些相關分子均能以抗體依賴或非依賴的方式被激活,再激活補體系統,或具有結合C1q-R的能力,從而模擬和放大C1q的功能作用。
(二)絲氨酸蛋白酶補體分子
在補體固有成分和調節蛋白中,共有6個絲氨酸蛋白酶(原)。即:C1r、Cls、C2、B因子(Bf)、D因子和I因子。它們除彼此在胺基酸序列上有同源性外,還與非補體性絲氨酸蛋白酶(如胰蛋白酶和糜蛋白酶)高度同源。但C2和Bf的催化部位比常見的絲氨酸蛋白酶約多210個胺基酸殘基。在6個補體性絲氨酸蛋白酶中,C1r和C1s,C2和Bf又具有更大的相似性。
C1r和C1s均為單鏈長形結構,兩端呈球形似啞鈴狀,分子量均為85kDa。二者除在C端有共同的絲氨酸蛋白酶結構功能域外,其N端有約450個胺基酸彼此同源。均含有2個拷貝的SCR和1個拷貝的EGF前體結構功能域。
C2和Bf均為單肽鏈糖蛋白,它們除在形成兩條補體激活途徑中和C3轉化酶方面十分相似外,在合成部位、合成途徑、分子大小、亞單位結構、半胱氨酸位置及數目,以及保守殘基替代及活性部位等方面也有很大的相似性。C2和Bf分子中相同的結構功能域是均有3個CSR、1個與vonWillebrand因子(vWF)共同的胺基酸序列和1個絲氨酸蛋白酶結構功能域。
(三)末端補體分子
末端補體分子C6,C7,C8和C9是構成膜攻擊複合體(MAC)引起靶細胞溶解破壞的重要組成成分。功能上的相似性反映了它們結構上的共同性。均具有420kDa的I型凝血敏感蛋白重複序列(thrombospondintypeIrepeatTSP-1),而且與TSP-1特有的β片層、和β螺鏇結構的立體配體也是類似的。此種結構單位也存在於備解素(properdin)和瘧原蟲的羧箕末端。除TSP-1外,它們還具有1個拷貝的低密度脂蛋白受體結構功能域(lowdensitylipoproteinreceptormoduleLDL-R),1個表皮生長因子前體結構功能域(EGfprecusormodule)。在肽鏈的中央還有1個半胱酸貧乏區與細胞毒性細胞和NK細胞釋放的perforin的結構具有相似性(圖5-19)。其中C6和C7具有更大的同源性。二者除上述的結構功能域外,在C端還存在著富含半胱氨酸的重複序列,即為2個CSR和2個與I因子重鏈中有一個區具有同源性的結構功能域(factorImoduleFIM)。二者的分子量也相近似,分別為128kDa和121kDa。顯著的差別僅僅是C6的N端多1個由59個胺基酸組成的TSP-1。
(四)具有SCR的6種補體調節蛋白
補體活化調節蛋白(requlatorofcomplementactivationRCA)包括:CR1、CR2、H因子、C4Bp、DAF和MCP。它們共同的結構特徵是均具有多個類似的短同源重複序列(SCR)。SCR也稱Shushi單位。一個SCR約由60-70個胺基酸殘基所組成,大小為4.5nm。SCR之間有20-40%的同源性。所有的SCR均具有固定的保守骨架序列(其中有4個半胱氨酸形成兩個二硫鍵),並與脯氨酸、色氨酸、酪氨酸/丙氨酸、甘氨酸相維繫而形成一獨特的結構單位。這一結構單位在CR1中有32個,CR2中有15-16個,H因子中有20個,C4b中有12個,DAF和MCP中各有4個,而且是構成這些補體蛋白肽甸的主要結構。SCR在RCA中的功能是與C3、C4和C5結合,發揮其調節作用。在前述的C1r、Cls、C2、Bf、C6和C7中也含有幾種非補體性蛋白如IL-2R、β2糖蛋白1(β2-1)、內皮細胞-白細胞粘附分子-1(ELAM-1)、淋巴細胞的歸位受體和凝血因子Ⅻ的b亞單位中也含有SCR,但其意義不詳。值得注意的是,牛痘病毒具有SCR的編碼DNA,且與C4bp的SCR相類似,可逃避補體經典途徑對其發揮作用。
特徵
補體的遺傳學特徵學特徵表現為多種補體分子具有遺傳的 激活補體
激活補體(一)補體的遺傳多態性
補體的遺傳多態性(geneticpolymorphism)是指在同一集團中,兩個或兩個以上非連續性突變體或基因型(稱型態),以極小的頻率有規律地同時發生的現象。補體成分的多態性是Alpert和Propp1986年在人的C3中首次發現的。此後,已從基因型和表型水平獲得有關不同種內補體缺陷與補體多態性的知識,並從四個水平研究了補體的多態性:①通過對血清中天然補體成分同種型的分析(表型水平);②通過確定它們的亞單位組成(亞表型水平);③通過建立群體遺傳學和形式遺傳學(即同種異型的頻率和各個基因等位基因的頻率與分離);④通過對它們DNA結構的定位和測序,提示限制性片段長度多態性(restrictionfragmentlenghtpolymorphismRFLP)。已發現許多補體分子具有多態性,其中以C2、Bf、C4、C3和C6最為顯著。
(二)定位於第1號染色體長臂32區的RCA基因簇
這一基因簇包括:CR1、CR2、H因子、C4bp、DAF和MCP的基因。由於這一緊密連鎖的基因簇調控著補體系統的活性,因此可以得出下面的結論:基因的連鎖是維持密切相關功能的進化的現象。變異體的罕見可能是進行選擇的有利條件,或有時是一種致病的因子。
(三)定位於第5號染色體上的MAC補體基因簇
確定在5號染色體的短臂存在著補本末端成分C6、C7和C9的基因簇,並發現C6和C7的基因通常是緊密連鎖著的,證據主要來自一個C6/C7聯合缺陷的病例。C6缺陷者與反覆發作的腦膜炎奈瑟氏菌的感染有很強的相關性。某些C7缺陷的個體也易感染奈瑟氏菌。其餘個體則是健康的。驚奇的是所有C9缺陷的個體(1便除外)似乎都健康。這些現象說明,在MAC補體分子中,包括定位於其他染色體的基因編碼的C8在內,存在著某種程度的互補性。即一種補體分子的缺陷,可補其他末端補體分子的功能所補償。C8的3個亞單位(α、β和γ)分別為第1號染色體上的C8A、CIB基因和定位於第9號染色體長臂的基因C8G的產物。
(四)定位於第6號染色體短臂21.3區的MHCⅢ類基因
有許多證據表明,C2、C4和Bf由位於MHCI、Ⅲ類基因間一段長80kb的DNA所編碼。C2和Bf基因的500kb之中有一部分相重合。C4由2個緊密連鎖的位點上的基因C4A(22kb)和C4B(16kb)所編碼。純合性的Bf缺陷尚末見報導,但偶可見一純合性C4和C2的缺陷。並常與SLE或SLE樣疾病相關聯。約有2/3純合性C2缺陷的個體是健康的,說明C2的缺陷至少有一部分可被無缺陷的C4所補償。C2和Bf均具有多態性。人的C2主要由三個等位基因(C2A、C2B和C2C)所編碼。在補體成分的缺陷中,C2的遺傳性缺陷所占比使例較高,為常染色體共顯性遺傳。C2缺陷者發生免疫複合物病及SLE的危險性較大。Bf的遺傳多態性最常見的表型為S(slow)和F(fast),另外還發現近20種罕見型,基因頻率均<0.02-0.03。B因子的多態性與某些自身免疫病和感染性疾病有關。C4A和C4B則具有複雜的多態性,已發現有30多個同種異型,分別有15和14個等位基因。由C4A和C4B基因編碼的兩種蛋白有99%的序列同源性,但二者在功能上卻有明顯的差別。兩種同型的差別只是1個決定簇的不同。如將1101位的亮氨酸置換為脯氨酸,在SDS-PAGE上即可出現2kDa的表觀分子量的改變;若將1106位的天冬氨酸置換為組氨酸,可使基溶血活性出現3-4倍的變化。另有2個位點含有所謂的Null基因稱為:“零基因”(C4quantitativezero,C4QO)或靜息基因,檢不出基因產物的頻率為10-20%,系由於基因的缺失、基因轉換或不表達所致。C4A和C4B在功能上的送別表現為:①溶血活性不同,C4B明顯高於C4A,因C4B與羥因形成酯鍵的速度大於C4A的10倍,而C4A與氨基形成醯胺鍵的速度大於C4B的100倍。②C4A在抑制免疫沉澱中的作用較C4B大1.7倍,對腮腺炎病毒的中和作用較C4B大10倍;③抗原性上也有差別;幾乎所有C4A分子中都含Rodgers血型抗原,而C4B則含有ChidO血型抗原。C4A缺陷與多種疾病的關聯,如SLE、RA、全身性硬化、亞急性硬化性全腦炎(SSPE)、慢性多發性關節炎、重症肌無力、內臟利什曼病、普通變異型腎小球腎炎、麻風、巴西芽生菌病、IgA缺陷、胰島素依賴的糖尿病(IDDS)、恰加氏病(非洲錐蟲病)和愛滋病。
已對大多數補體分子的結構和遺傳學特徵進行了較深入地研究,發現許多補體分子遺傳上的異常與某些疾病的關聯。但將體外功能上的改變就視為與體內的某一現象有關尚為時過早。研究的重要任務,在於闡明補體相關疾病發病機理中的致病因子來取代統計學上的相關性。
固有成分
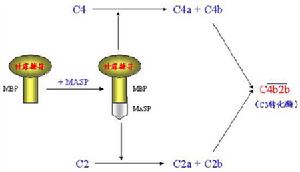
補體系統兩條激活途徑中,涉及到14個補體蛋白(C1-9,及B、D、P因子)的參與。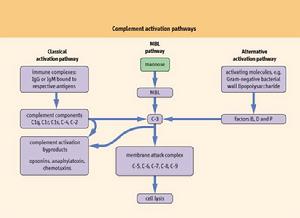 補體
補體一、C1分子
C1是經典激活途徑中的起始成分。它是由1個分子的C1q和2個分子的C1r及2個分子的Cls借Ca2 連線而成的大分子複合物。分子量約為750kDa。其中C1q為具有識別作用的亞單位,C1r和C1s為具有催化作用的亞單位。
(一)C1q
C1q為各種補體分子中分子量最大(410kDa)的γ球蛋白。其分子結構較特殊和複雜,由A、B、C三種不同類型的肽鏈所組成。其中A、B、C鏈各6條,共18條。A、B、C三種肽鏈的分子量不盡相同,分別為24、23和22kDa,各含有222-226個胺基酸殘基,且彼此同源。每條肽鏈由含半胱氨酸殘基的一個短的N末端區所組成,接著為一段81個胺基酸的膠原序列(即重複的三股序列Gly-X-Y,Y處通常為羥脯氨酸或賴氨酸殘基)。該序列的其餘部分為非膠原性的。A、B鏈間及兩條C鏈間各有一個二硫鍵相連線。18條肽鏈中每三條不同的肽鏈組成一條三股螺鏇,故共有6條這樣的結構。每條螺鏇的肽鏈均由絲狀膠原樣成分組成。在6條螺鏇結構C端由於胺基酸序列的隨機捲曲而形成6個花蕾狀的球形頭部,呈花朵形展開。在近N端約為1/2全長的螺鏇結構呈束狀並平行排列,其N末端為C1q的尾部。
C1q的膠原樣區有結合C1r和C1s的部位。並證實聚合的C1q刺激B細胞增強其產生Ig的作用,也是通過其尾部而完成的。C1q的關部含有能識別IgFc片段上補體結合部位的位點(C1q與C1q-R相互作用),且由於6個球形頭部呈花朵形展開,更增加了其與Ig接觸的機會。C1q同1個分子的IgM結合即可被活化,但至少需同兩個IgG分子結合才能被活化,而且兩個IgG分子在細胞膜上的距離不得少於700nm。C1q對人4種IgG亞類的結合親和力依次為:IgG3>IgG1>IgG2>IgG4。
Reid等已對C1q分子的A、B鏈做了部分胺基酸分析,並完成了A、B鏈的cDNA克隆及序列分析。因此,C1q分子的大部分一級結構已經明確。編碼C1qA、B、C三條肽鏈的基因均定位於人的第1號染色體的短臂34.1-36.1區。
(二)Clr和Cls
Clr和Cls均為單一多肽鏈分子,又都是絲氨酸蛋白酶(原)。Clr和Cls多肽鏈均由接近700個胺基酸所組成。位於C末端的約250個胺基酸為絲氨酸蛋白酶區,與胰蛋白酶和糜蛋白酶同源。同大多數補體蛋白一樣,它們都是鑲嵌(mosaic)蛋白,即由不同胺基酸組成的固定基序組合而成,並且很可能代表獨立的摺疊功能區或結構功能域(module)。
兩個分子的Clr和同等分了的Cls借Ca2 連線成扭曲的“8”字形,盤架於C1q近頭部的6條螺鏇結構間。Clr和Cls的分子量條螺鏇結構間。Clr和Cls的分子量均為85kDa。它們激活後,在分子內的精氨酸與亮氨酸殘基間斷裂,形成分子量分別為57kDa和28kDa的A、B兩個片段,但鏈間仍以二硫鍵相連線,故整個分子並末分離。在B片段上含有絲氨酸蛋白酶活性點,為其催化英勇區。A片段上有Clr和Cls相互反應的的功能區。反應功能區朝向中心,催化功能區位於外側。在一般C1INH與C1r結合著,而一旦有免疫複合物結合到Clq時,C1INH的抑制作用即行移除,並通過C1q的膠原性柄將其頭部的移動傳遞到其核心區,並從此處再傳遞到與其相連線的C1r,誘導C1r構鍾愛改變並裂解活化。活化的C1r(C1r),再作用於C1s使之成為活化型C1s(C1s)。
C1r和C1s的cDNA克隆均已成功,並進行了全部序列分析。編碼C1r的基因定位於人的第12號染色體短臂13-ter,與編碼C1s的基因相連。
二、C4分子
C4是經典激活途徑中第二個被活化的補體成分,分子量約為210kDa,由α(90kDa)、β(78kDa)及γ(33kDa)三條肽鏈借二硫鍵連線組成C4的分子結構較為特殊,其α鏈中含有一個在半胱氨酸和谷氨酸殘其間形成的內硫酯鍵。α鏈的N端有C1s絲氨酸蛋白酶的作用點。當C1s將C4α鏈的精氨酸-丙氨酸鍵(76-77位)裂解後,形成大小不等的兩個片段。小片段C4a(8.6kDa)釋放入液相中,其為一弱的過敏毒素,具有激酞樣作用,可誘導肥大細胞釋放組胺,增加血管的通透性引起局部滲出性炎症,但其活性不到C3a或C5a的1%。大的片段C4b其α`鏈的內硫酯鍵被水解,並暴露出一個自由的硫氫基和一個谷氨醯胺殘基的高度反應性醯基,通過轉酯反應而將C4b固定到膜固相上。但C4b只能在其產生處或附近部位結合,因高度反應性的醯基能迅速與H2O反應,生成穩定的無共價結合功能的羧基。
一個C1s絲氨酸蛋白酶可以裂解多個C4分子,但產生的C4b只有1/10能結合到膜固相上,而且其中也僅少數與C2結合。C4b的功能,除主要參與經典激活途徑中C3轉化酶(C4b2a)和C5轉化酶(C4b2a3b)的形成進一步介導補體後續成分的級聯反應外,還可通過與效應細胞膜上的CR1結合促進吞噬、調節補體活化,以及參與防止免疫複合物的沉積及中和病毒的作用。C4可能與免疫識別及維持免疫自穩功能也有關。
編碼人C4的基因定位於第6號染色體的HLA-DR和HLA-B位點間一段基因組DNA上。C4由兩個基因C4A*和C4B*所編碼,因此血清中的C4分子也有兩種類型即C4A和C4B,但二者具有高度同源性(僅有少數胺基酸不同)C4A*和C4B*的cDNA克隆均已成功並進行了序列分析。C4A、C4B、B因子及C2均屬於MHC的第Ⅲ類分子。
三、C2分子
C2的序號似是補體的第2個成分,但在經典激活途徑的激活順序上卻在C4以後被活化。C2分子的一級結構已全部搞清楚,它是由723個胺基酸殘基組成的單肽鏈糖蛋白,分子量約110kDa。當C2與已固定於細胞膜固相上的C4b結合為複合物時,C1s絲氨酸蛋白酶可從C2肽鏈的精氨酸和賴氨酸(223-234)間,將C2裂解為兩個片段,即C2a和C2b。C2b由N端223個胺基酸殘基構成,分子量為35kDa,由細胞膜表面釋放入液相中,其生物學活性至今不明。C2a由509個胺基酸殘基組成,分子量為75kDa,它是構成經典激活途徑中C3轉化酶(C4b2a)和C5轉化酶(C4b2a3b)的酶原部分。C2a的肽鏈上含有裂解C3和C5的蛋白酶活性點,C3轉化酶與C5轉化酶對C3和C5的裂解,均是由C2a的酶活性點起催化作用。
四、C3分子
C3處於兩條激活途徑的匯合點,在補體系統活化過程中起著樞紐作用,並為替代途徑激活的關鍵分子。C3的α、β兩條肽鏈組成,之間以二硫鍵相連結,分子量為195kDa,其中α鏈為115kDa,β鏈為75kDa。其在血清中的含量高於其它補體分子,約為0.55-1.2mg/ml。同C4分子一樣,C3分子的α鏈在半胱氨酸和谷氨酸殘基之間也有一個內硫酯鍵(Cys-S-CO-Glu)。此環狀結構水解後,可形成一個轉移性結合點,認為這是C3b由液相結合到固相上的結構條件,也是C3以緩慢的速率水解導致其構象改變出現能與B因子具有親和力的“變構”C3b的分子基礎。當C3轉化酶從C3α鏈N端一個精氨酸-絲氨酸鍵(第77-78位)外將C3裂解後,可產生一個9kDa的小片段C3a(釋放到液相中去),其餘部分為C3b。同時,新生的C3bα`鏈內距N端5kDa的硫酯鍵斷裂,在谷氨醯胺基上出現一個具有轉酯作用的高度或多糖等分子中的羥基(R-OH)共價結合,形成新的酯鍵。同樣,也可與靶細胞上的氨基形成醯鍵(-CONH-)。這樣,新生的C3b便可結合於靶細胞表面,而其半胱氨酸則通過接受1個質子形成硫氫基(-SH),從而獲得轉移性。需要提及的是,上述形成的反應性醯基極不穩定,若在60秒內未同碳水化物發生轉酯反應,則反應性醯基即與水分子反應形成羧基,從而使C3b失去共價結合的能力。一般細胞表面都有足夠的糖類(常以糖蛋白、糖脂或多糖形式存在)因此新生C3b得以通過上述轉酯作用而固定於細胞上(外來的或自身的)。通過上述轉酯反應而獲得結合活性的C3b可與c4b2a結合形成經典途徑的C5轉化酶(C4b2a3b),或與Bb結合形成替代途徑的C3轉化酶(C3bBb)和C5轉化酶(C3bnBbC3b也可在H因子和I因子的作用下,變為無活性的C3bi,並再I因子裂解為C3Dg和C3c。C3d可能是C3裂解的最終產物,只有在細菌或炎灶分解產物的作用下,才能裂解為C3d和C3c。還報導有C3e片段,可能來源於C3c。
C3各個裂解片段的生物學活性不一。C3a為過敏毒素,能直接作用於肥大細胞和嗜性粒細胞,使之釋放組胺,引起血管擴張,通透性增加,平滑肌收縮及局部水腫。但其作用遠較C5a弱。此外,C3a還具有使吞噬細胞定向移動以促進吞噬的趨化作用,以及抑制特異抗體反應、非特異性多克隆反應和抑制白細胞移動抑制因子(LIF)產生的作用。C3b的生物學活性烄廣,概括起來有以下幾個方面:(1)參與替代途徑中兩種C3轉化酶[起始C3轉化酶(C3bB)和放大C3轉化酶(C3bBb),以及兩條途徑中兩種C5轉化酶(C4b2a3b和C3bnBb)的形成;(2)啟動替代激活途徑中的正反饋放大迴路;(3)調理促進吞噬及免疫粘連作用;(4)參與免疫調節,如作為B細胞活化的非特異性刺激信號,作為B細胞的致有絲分裂原促進B細胞增殖,與抗體協同增強ADCC作用和刺激單核細胞釋放前列腺素E(PGE),嵌入抗原、抗體複合物的格線結構中,使二者的結合鍵斷裂從而是產生對可溶性免疫複合物的溶解作用等。C3bi具有促進吞噬和與抗體協同增強ADCC反應的作用。C3c和C3dg可的抑制抗原、有絲分裂原或同種異型抗原誘導的T細胞增殖,C3e則可引起白細胞增多。
人的C3基因定位於第19號染色體,有兩種常見的同種型C3S和C3F。此外還有十餘種少見型及罕見型,其中C3F與腎小球毛細血管性腎炎和部分脂質性營養不良有關。C3遺傳性缺陷少見,但如發生缺陷,則易引起反覆化膿性和革蘭氏陰性菌的感染。
五、C5分子
C5是形成膜攻擊複合體(MAC)的第1個補體分子。C5由以二硫鍵相連線的α、β鏈組成,分子量190kDa,其中α鏈為115kDa,β鏈為75kDa。C5與C3和C4的結構相類似,但沒有鏈內硫酯鍵。靠近N端的第74-75位精氨酸一亮氨酸鍵為C5轉化酶作用的部位。在C5轉化酶的作用下,C5α鏈N末端裂解出一個分子量為11kDa的小片段C5a進入液相中,其餘部分為110kDa的大片段C5b,仍結合在細胞膜表面。親生的C5b在極短時間內能保持與C6結合的構象,可與C6非共價結合形成一牢固的C5b6複合物,並通過與C3b的可逆性結合而固定的細胞膜上。但C5b生成後其潛在的生物學活性存在時間非常短促,若無C6結合則迅速衰變為C5bi。
C5b只形成MAC參與細胞溶解效應,而C5a卻具有廣泛的生物學活性。概括起來有以下幾方面:(1)過敏毒素作用:C5a是具有過敏毒素作用的補體裂解片段中作用最強的介質,較C3a強20倍,較C4a強2500倍。此外,C5a還可不依賴於肥大細胞釋放組胺,即通過直接作用於血管內皮細胞而增加血管的通透性。(2)趨化作用:高濃度的C5a是中性粒細胞、嗜酸性粒細胞和單核細胞的趨化劑,可刺激這些細胞沿著濃度定向移動。值得注意的是,被血清羧肽酶N切C5aC端精氨酸殘基而形成的去精C5a雖喪失了使肥大細胞分泌組胺的能力,但仍具有較強的趨化活性,是補體活化後產生趨化作用的主要因素。(3)促代謝作用:高濃度的C5a可刺激中性粒細胞和單核細胞的氧化代謝,提高其cGMP的水平,有利於促進溶酶體與細胞膜的融合,釋放溶酶體酶。此外,C5a還可刺激中性粒細胞粘附及增強其產生超氧化物。(4)免疫調節作用:近年體外研究表明,C5a對免疫應答有明顯增強作用,如可誘導單核細胞分泌IL-1、IL-6、IL-8及TNF-α等細胞因子,促進抗原及同種異體抗原誘導的T細胞增殖及B細胞產生抗體等。C5a的上述生物學活性的利於增強機體的防禦機能,但由其導致的炎症反應也可造成對機體的損傷。編碼入C5的基因定位於第9號染色體長臂32-34區。
六、C6和C7
C6和C7有許多相似之處,均為單鏈糖蛋白,且分子量也相近分別為128kDa和121kDa。編碼C6和C7分子的基因可能由共同的祖基因進化而來。C6和C7在胺基酸水平上有33.5%的同源性。對C6的結構及功能進行了較深入的研究,由cDNA序列推導成熟C6的全部多肽鏈含有913個氨基殘基,前面還有21個獨特胺基酸殘基組成的信號肽,其碳水化物的含量為4-6%。在肽鏈的第303位和834位胺基酸殘基處,可能為兩個天冬醯胺連線的糖基化部位。C6中還含有大量的半胱氨酸殘基(總數為64個),集中在多肽鏈的氨基末端和羧基末端部分,其中氨基末端的位置由半胱氨酸殘基所占據。
C6和C7中都含有低密度脂蛋白(LDL)受體結構功能域、EGF前體結構功能域、Ⅰ型凝血敏感蛋白(TSP-1)結構功能域和SCR結構功能域,且排列方式相同。套用濾紙結合的C6片段進行研究表明,C6與C5b的結合部位為由2個SCR和2個Ⅰ因子結構功能域(FIMs)所組成的大小為34kDa的羧基末端的片段。在C6和C7活化過程中,二者均無分子的裂解,推測可能是由於其分子構型的改變而成為具有結合活性的形式。C6和C5b以非共價形式結合形成的C5b6複合物仍疏鬆的與C3b呈可逆性結合,且具有親水性不能插入膜內。而一經與C7結合,即出現親水-疏水兩性轉換,同時產生亞穩態膜結合部位。這樣,c5b67便脫離C3b附著部位轉移至膜表面,然後通過複合物中C7的疏水性緊緊固定在膜脂質雙層中。疏水區的暴露系由於C5b67複合物的構象變化所致。但新生的亞穩態C5b67複合物僅有100毫秒的生存其,如不及時同膜結合,又可因複合物重排使疏小區摺疊而失去膜結合活性。此外,無論液相或結合到膜上的C5b67複合物均可自行聚合而喪失其介導的溶細胞活性,但仍具有趨化作用。C6和C7可能還有觸發淋巴細胞母細胞化的作用,因在單相混合淋巴細胞反應(MLR)中,加入抗C6及C7的抗體Fab能抑制淋巴細胞增殖。
編碼C6和C7和的基因定位於人的第5號染色體上且相連鎖。C6及C7均具有遺傳多態性,編碼C6的兩個等位基因(C6A和C6B)已確定,東方人群中C6B的基因頻率較高。C6及C7的cDNA已克隆成功,發現它們與C8和C9具有一定的同源性。
七、C8分子
C8是由α、β、γ三條肽鏈組成的三聚體糖蛋白,分子量為155kDa。其中α鏈和β鏈均為64kDa,γ鏈為22kDa。α鏈和γ鏈間以二硫鍵共價結合,而α鏈與β鏈間則為非共價鍵結合。C8分子中也含有TSP-1和LDL受體結構功能域。在C8α和C8β多肽鏈的中央(157-501個胺基酸殘基間),幾科不含半胱氨酸殘基,為與細胞毒性T細胞及NK細胞產生的穿孔蛋白(perforin)有同源性的結構功能域。在α和β鏈中含有極高比使的疏水性胺基酸。β鏈分布在C8分子的表面,其與C5b的相互作用是極性的,並具有高度特異性。C8與C5b-7的結合部位為其β鏈。當C8與c5b-7結合後,通過C8分子的構象變化,使其α鏈插入膜脂質雙層的烴核中,形成直徑約1.6nm的空膜孔道,可使細胞同的離子緩緩流出,但不會導致細胞溶解。C5b-8複合物能促使C9的聚合但機理尚不清楚,可能是降低了C9聚合的活化能所致。另外研究表明,C9是通過C8而同c5b-8結合的,因C9不能同C5b-7相結合,而其同C5b-8的結合則可被抗C8的抗體所抑制。
C8的基因定位較複雜,其中編碼α鏈和β鏈的基因C8A和C8B定位於人的第1號染色體,而編碼γ鏈的基因C8G則定位於第9號染色體的長臂。目前已對C8β鏈的cDNA克隆成功,並做了序列分析,發現其與C9具有高度的同源性,而且二者均含有豐富的半胱氨酸的膜嵌入區。C8的α鏈和β鏈在遺傳上也呈高度多態性,二者約有33%的胺基酸序列相同,而與C7和C9則約25%相同
八、C9分子
C9是形成膜攻擊複合體(MAC)的最後個分子,為一單鏈糖蛋白,分子量79kDa。經對cDNA推導的胺基酸序列分析發現,C9為一兩性分子。C端37kDa由疏水性胺基酸組成稱C9b,N端34kDa由親水性胺基酸組成稱C9a因此C9以其羧基端部分嵌入細胞膜的脂質雙層中。而N端則為與c5b-8相結合的結構域。C9具有自發聚合的作用,但聚合很慢,在37℃下需3天才能完成,而在C>5b-8的催化下,10分鐘內即可完成。由12-16個C9分子聚合形成的多聚體C9,可形成內徑10nm、壁厚2nm的中空穿膜孔道嵌入膜內。孔道的內面由許多親水性胺基酸殘基和碳水化物組成,而與雙層脂接觸的管壁外面則是疏水性胺基酸殘基。由於細胞內容物的外漏,最終可導致細胞溶解破壞。C9分子的多肽鏈與C8α和C8β結構上相類似,也含有TSP-1、LDL受體前體結構功能域及與穿孔蛋白同源的結構功能域。由於C9和穿孔蛋白在結構和功能上均非常相似,推測二者可能具有共同的祖基因。編碼入C9的基因定位於第5號染色體上,末發現C9有多態性。
九、B因子
B因子(factorBBf)替代激活途徑中的重要成分,由Blum於1959年首先發現。B因子為由733個胺基酸殘基組成的單鏈糖蛋白(糖含量約7%),分子量93kDa。由於這些胺基酸的迂迴摺疊形成三個大小相近似的球形區。其中1個為Ba,其餘兩個呈啞鈴狀為Bb。Bb中靠近N端的一個球形區可同C3b結合,另一個球形區可能是催化區。在Mg2 存在的情況下,B因子可與C3b結合形成C3bB,被血清中的D因子裂解為分子量為33kDa的Ba和63kDa的Bb兩個片段。後者3再與C3b結合形成替代途徑的C3轉化酶(c3bBb)和C5轉化酶(C3bnBb)。兩種酶中的Bb均具有絲氨酸蛋白酶活性,是裂解C3和C5的活性部位,但C3bBb和C3bnBb均不穩定,易衰變失去活性。
十、D因子
D因子是啟動替代途徑激活的重要成分,為由222個胺基酸殘基組成的單鏈絲氨酸蛋白酶,分子量僅25kDa。D因子在血清中的濃度很低(1-2μg/ml),主要以活化形式而存在。但可能還有一種以酶原形式而存在的由239個胺基酸殘基組成的D因子。具有活性的D因子(D)可能在第234-235位的精氨酸-賴氨酸鍵處將B因子裂解為Ba和Bb兩個片段,從而啟動替代途徑的級聯活化反應。D因子的部分cDNA已克隆成功,並進行了序列分析,發現其與其它幾種絲氨酸蛋白酶(如胰蛋白酶、糜蛋白酶、纖溶酶及弱性蛋白酶)具有同源性。
十一、P因子
P因子又稱備解素(properdin),是替代途徑中除C3以外最先發現的一種血漿蛋白,P因子以聚合體形式而存在:即三聚體(54%)、二聚體(26%)和四聚體(20%)都有,但特異活性的順序依次為:四聚體>三聚體>二聚體。P因子為由4條相同的肽鏈(分子量各55kDa)組成的四聚體分子,鏈間以非共價鍵相連線,分子量為220kDa。P因子的生物學活性是以高親和力與c3bBb和C3bnBb相結合,結合後通過發生構象改變而加固C3b與Bb間的結合力,從而可使其半衰期由2分鐘延長至26分鐘。另外,P因子還可封閉H因子的抑制作用,更增加了上述兩種酶的穩定性及活性,有利於促進替代途徑級聯反應的繼續進行。因此,P因子實際上是替代途徑中的一個重要的正調節分子。因其常成為c3bBb和C3bnBb複合物中的組成成分之一,故將其作為補體系統的固有成分在此一併描述。此外,在膜增生性腎小球腎炎病人血清中發現有一種C3腎炎因子(C3nephriticfactorC3NeF)實際為C3bBb的自身抗體,也可與C3bBb結合而增加c3bnBb的穩定性,使其半衰期處長10-30倍。
補體受體的結構及功能
1930年Duke和Wallace發現,被補體調理的結合到靈長類紅細胞膜上的錐蟲可產生免疫粘附現象。其後Nelson(1953)報導,與紅細胞或中性粒細胞的免疫粘附只需要激活C3,而不需要激活具有溶解活性的補體末端成分,並將紅細胞和中性粒細胞上具有免疫粘附作用的結構稱為CR1。以後又相繼發現了另外4種C3受體,即CR2(1973)、CR3(1979)、CR4(1984)和CR5(1984)。另外,還有4種補體受體則是根據它們的補體配體特異性而命名的,即C1q受體(C1q-R,1975).C5a的受體(C5a-R,1978)、C3a的受體(C3a-R,1979)和H因子的受體(fH-R,1980)等。
受體結構
補體受體是細胞表面的重要膜結構。補體系統激活的級聯反應產生的多種生物學效應, 補體
補體一、C1q受體
套用C1q-瓊脂糖親和層析由類淋巴母細胞和髓樣細胞膜分離的C1q受體(C1q-R)為一種類似65kDa的糖蛋白,具有非共價結合的蛋白聚糖成分。也可能還有CD43參與,從而構成一個多單位的糖蛋白複合體。由於各種細胞上表達的C1q-R具有類似的結合親和力和與抗游離C1q抗體有共同的反應性,表明不同細胞上表達的C1q-R結構類似。C1q-R的某些肽段含有與RO/SSA(一種核糖核蛋白自身抗原)、舒網素、小鼠B50黑素瘤抗原、大鼠425蛋白等相似的序列,表明它們屬於同一蛋白超家族。表達C1q-R的細胞類型B細胞及其母細胞株、NK細胞、單核-巨噬細胞、中性粒細胞、嗜酸性粒細胞、內皮細胞、成纖維細胞及血小板等。最近報導,外周血T細胞及Molt4T淋巴細胞株也表達C1q-R。C1q-R的天然配體為C1q,C1q與C1q-R的相互作用具有特異性、可飽和性、可逆性及親和性等特點。由於單獨的C1q分子對C1q-R的親和力很低,因此C1q-R常優先與免疫複合物(IC)結合的C1q相結合。C1q-R的功能主要有兩方面:(1)免疫調節作用:C1q-R具有多種免疫增進作用,如促進B細胞產生Ig,促進吞噬細胞的ADCC效應及對IgC或C3bn/C4b包被顆粒的吞噬作用。通過魯米諾化學發光法和檢測磷酸已糖旁路的活化表明,刺激中性粒細胞的C1q-R可激發呼吸爆發,刺激內皮細胞的氧化代謝,促進IC的沉積與清除等。(2)調節血小板的功能:已證明游離的C1q與血小板上C1q-R相互作用可抑制膠原誘導的血小板聚集與釋放反應,而結合於IC上成簇的C1q則可模擬膠原的作用,誘導血小板聚集和釋放5-HT。此外,C1q-R與其配體的相互作用,還可刺激成纖維細胞趨化、DNA合成導致其增生。因此認為,在損傷癒合和組織再生中,C1q-R也可能起著重要作用。C1q-R複合體中的CD43可能起傳導信號的作用。在促進過氧化物產生、增強吞噬作用和對不易吞噬的微生物的細胞毒作用中,C1q與中性粒細胞、單核-巨噬細胞和嗜酸性粒細胞上的FcR也可協同而發揮作用。
二、I型補體受體(CD35)
I型補體受體(CR1、C3b/C受體,又稱CD35) 為單鏈穿膜糖蛋白,分子量160-260kDa。CRI有四種同種異型,其分子量與基因頻率分別為,A:190kDa(0.83)、B:220kDa(0.16)、C:160kDa(0.01)和D:260kDa(0.002),但它們的功能相同。CR1廣泛分布於紅細胞、粒細胞、單核細胞、肥大細胞、濾泡樹突狀細胞、腎小球足突細胞、B細胞及部分CD4 T細胞。CR1的配體為C3b/C4b(高親和力)及C3bi/C3c(低親和力)。其主要功能有:(1)作為調理素受體,增強吞噬細胞對C3b/C4b包被顆粒及微生物的吞噬作用,以及對較小IC的內吞;(2)為I因子的輔助因子之一,協同I因子裂解C3b和C4b,抑制C3轉化酶與C5轉化酶的活性並促使其降解;(3)通過紅細胞的CR1運送IC至肝臟等處經I因子裂解C3b,使IC與紅細胞解離,再被單核細胞所清除;(4)為B細胞激活的調節劑。當CR1被含多個配體的IC交聯時可激活B細胞,反之則產生抑制效應。並發現C1q-R與CR1在激活B細胞產生Ig的過程中有協同作用。有人認為CR1可通過將帶有C3b或C3bi的抗原附著於B細胞表面而促進對抗原的識別。此外,CR還有促進NK細胞殺傷結合CR1(sCR1),存在於血漿中,正常值為13-81ng/ml。關於sCR1的來源,發現體外培養的中性粒細胞、單核細胞和淋巴細胞上清中有sCR1;將人的外周血白細胞移入嚴重免疫缺陷(SCID)小鼠體內後在其血清中也可檢出sCR1,表明轉移的白細胞可以合成sCR1。另外,通過以sCR1cDNA轉染的COS細胞既可表達膜CR1,也可分泌sCR1,且與膜sCR1的分子量相同,說明sCR1由細胞分泌產生。血液中sCR1的水平與某此疾病具有一定的關聯。發現sCR1水平升高與機體重要臟器的功能損害相平行,如晚期腎功衰竭和肝硬化的病人血液中sCR1的水平明顯高於正常人,但經腎移植或肝移植後sCR1的水平可明顯下降,甚至可降至正常水平。因此測定血中sCR1的水平對了解某些疾病的病情和判定治療反應可能具有一定的意義。
sCR1的基因位於人的第1號染色體長臂32區,屬於RCA家族中的成員。經對CR1N端的cDNA分析表明,CR1多肽結構有3-5個連線的蛋白片段,它們的內部序列有高度的同源性,稱為長同源重複序列(longhomologousrepeat,LHR)。每個CR1的LHR在數目上的同種異型變異性,說明不同個體的CR1在大小有很大差別。此外,每個LHR由7個SCR組成。CR1最常見的形式有32個SCR,其中28個排列成4個LHR。每一個LHR的第2個SCR內具有同C3b/C4b相結合的部位。
三、Ⅱ型補體受體(CD21)
Ⅱ型補體受體(CR2)按白細胞分化抗原歸類為CD21。CD2為分子量140kDa的單鏈糖蛋白,主要分布於B細胞、單核細胞、某些T細胞、咽上皮細胞及淋巴結濾泡樹突狀細胞上。其配體C3bg、C3d和C3bi中的C3d部分。CR2也是EB病毒的受體,CR2與C3d結合的部位和同EB病毒結合的部位相距甚遠。另外,最近報導CR2還可與IFN-α結合。CR2主要功能是對B細胞的分化、增殖、記憶和Ig產生起重要的調節作用。如B細胞表面交聯的C3d為B細胞由G1其進入到S期提供了活化信號,可取代單核因子的作用,而可溶性C3d則可通過與CR2結合而阻止B細胞化分。帶有C3片段的IC可經CR2定位於生髮中心激活記憶性B細胞。另外,多克隆和單克隆CR2的F(ab)2片段、C3bg-瓊脂糖和EB病毒都能通過與CR2結合而引起B細胞活化。套用抗IgM抗體刺激B細胞可導致CR2磷酸化。而EB病毒則可借CR2感染B細胞(感染性單核細胞增多)或使B細胞或上皮細胞惡性轉化,引起伯基特淋巴瘤或鼻咽癌。
CR2的基因定位於人第1號染色體上的長臂32區,也屬於RCA家族成員。以cDNA探針的分子雜交研究表明,CR2與CR1的cDNA順序有高度的同源性(包括20個胺基酸的信號肽、954個胺基酸的胞膜外區,24個胺基酸的穿膜區和34個胺基酸的胞漿區),以致CR1的一些cDNA探針,也可同CR2基因雜交。胺基酸序列分析表明,CR2也具有與CR1同樣類型的SCR(15-16個)。
四、Ⅲ型補體受體(CD11b/CD18)
Ⅲ型補體受體(CR3)為由α、β兩條肽鏈以非共價鍵結合而構成的異二聚體糖蛋白,分子量分別為165kDa和95kDa。CR3屬於粘附分子整合素(integrin)家族中的成員,與淋巴細胞功能相關抗原-1(LFA-1)和CR4的結構極為相似,三者的β鏈完全相同(命名為CD18),而α鏈則各不相同:LFA-1為CD11a、CR3為CD11b、CD4為CD11c,故CR3又稱為CD11b/CD18分子。CR3作為整合素家族中的成員,在炎症反應中可介導中性粒細胞粘附於內皮細胞。在體外某些情況下,CR3還可表達能同膠原蛋白、ICAM-1和血纖維蛋白原相結合的部位。經C5a刺激的吞噬細胞表達CR3和CR4可輕度增多,這有助於中性粒細胞粘附於血管內皮成為有粘附性細胞,由血管中游出至炎症部位。感染部位的CR3可將吞噬細胞連線到帶有C3bi和/或β葡聚糖或LPS的細菌或酵母菌上,促進吞噬作用和呼吸爆發。另外,由於CR3最初是通過用Mac-1單克隆抗體的白細胞上發現的,因而也稱其為Mac-1抗原。CR3和CR4對固相的C3bi具有相似的結合特異性,二者均需要有二價的陽離子參與,並均可被EDTA所抑制。與CD4不同的是,CR3還具有能與細菌LPS和酵母菌細胞壁上β葡聚糖相結合的部位,也需2價陽離子參與。CR3分布於中性粒細胞、單核-巨噬細胞、嗜酸性粒細胞、NK細胞及細胞毒性T細胞和B細胞,其配體為C3bi。CR3的主要生物學活性是細胞粘附作用。它可促使效應細胞與靶細胞之間的密切接觸增強吞噬作用,因而在抗感染免疫中具有重要作用。CR3的缺陷可出現反覆細菌性感染。另外,CR3可能還是HIV-1感染細胞的入口之一,並可與β葡聚糖結合、激活補體,以及與大腸桿菌、鼠傷寒沙門氏菌、LPS及脂質A等結合。因此,CR3似乎是一種可結合多種配體的分子。CR3的α鏈和β鏈由不同染色體上的基因所編碼。合成後在細胞膜裝配成完整的CR3。遺傳性CR3和CR4缺陷的病人,是因為編碼它們共同β鏈的基因有缺陷,但在細胞漿中仍可檢出正常α鏈的前體。
五、Ⅳ型補體受體
Ⅳ型補體受體(CR4)、又稱CD11c/CD18,或P150,95,也是由α、β兩條肽鏈借非共價鍵而結合的異二聚體糖蛋白,α鏈的分子量為150kDa,β鏈與CD3的β甸相同為95kDa.CR4主要分布於中性粒細胞、單核細胞、巨噬細胞和血小板上,其配體為C3bi和C3bg。CR4的功能是增強Fc受體介導的吞噬作用,但也可介導Fc受體非信賴性吞噬作用。在組織巨噬細胞上CR4呈優勢表達,而只表達少量的CR1和CR3。吞噬細胞上表達的CR3和CR4分子,它們與細胞骨架的連線有別,這可調節兩種受體介導顆粒附著與吞噬作用的能力。由於CR3受細胞骨架連線的限制較小,因此CR3的遊動性較CR4大。這樣便可使數量相對較少的CR3很快集聚在與C3bi包被顆粒相接觸的部位,促使這些顆粒附著於巨噬細胞膜上。通過CR3將C3bi包被的顆粒捕獲在吞噬細胞膜表面後,此時遊動性較小但數量較多的CR4便可與C3bi包被的顆粒結合併促進吞噬作用。
編碼CR4α鏈和β鏈基因分別定於第16號和第21號染色體上。經序列分析表明,CR4與CR3的α鏈有87%的同源性。
六、Ⅴ型補體受體
Ⅴ型補體受體受體(CR5)中C3bi中的C3d部分、C3dg和C3d片段的特性受體,但只能與液相中的上述片段起反應。CR5的生物學活性是通過125I標記的液相C3dg二聚體而被確定的。未標記的C3bi、C3dg與C3d對125I標記的C3dg二聚體的結合有競爭性抑制作用,而C3b則無此作用。曾認為中性粒細胞上的C3dg二聚體受體與該細胞上的紅細胞-C3dg花環形成受體為同一受體,因此將其稱為CR4。後來研究表明,能形成花環的受體活性在幾種特性上與C3dg二聚體受體不同,如CR4與固定的C3bi的結合可被EDTA阻斷,面EDTA對C3dg二聚體的攝取則無影響。因此將C3dg二聚體受體命名為CR5。除中性粒細胞外,在血小板上也已鑑定有CR5的活性。
