概述
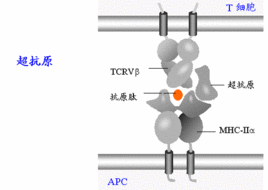
 超抗原
超抗原只需極低濃度(1-10ng/ml)既可激活大量的T細胞克隆,產生極強的免疫應答效應,但其激活機制與方式有別於常規抗原與有絲分裂原。與T細胞受體(TCR)的β鏈V區結合。例如中毒性休克綜合徵毒素(TSST)激活表達Vβ2的T淋巴細胞,葡萄球菌外毒素B(SEB)激活表達Vβ3、Vβ12、Vβ14、Vβ15、Vβ17、Vβ20的T淋巴細胞。而人類T淋巴細胞總共只表達大約24種主要的Vβ成分,因而每種超抗原都能夠激活大約20%的T淋巴細胞,而普通抗原僅僅能夠激活10-5~10-6個T淋巴細胞。超抗原激活大量的T淋巴細胞的同時,使得機體釋放大量的促炎性細胞因子,例TNF2α,IL21β,IFN2γ以及IL22,而這些細胞因子可以間接的增強超抗原對機體的毒性反應。
細菌性
 超抗原
超抗原也有超抗原存在於C族鏈球菌中,例如馬鏈球菌產生致熱外毒素H,I,L,M(SePE2H,I,L,M),它們相應的與化
膿性鏈球菌產生的超抗原SPE2H,SPE2I,SPE2L以及SPE2M的序列同源性超過98%。這些由馬鏈球菌超抗原很有可能是由化膿性鏈球菌超抗原水平轉移而來。此外無乳鏈球菌也含有兩種超抗原:SDM與SPE2Gdys。SDM和SPE2Gdys分別與化膿性鏈球菌超抗原SPE2M3,SPE2G同源性較高。這些C族鏈球菌超抗原相對於化膿性鏈球菌超抗原的胺基酸序列的變異並不會影響它們與MHCⅡ類分子和T細胞受體的結合,說明它們與A族鏈球菌超抗原功能也相似。SPE2H與SPE2I均位於缺陷型前噬菌體SF370.2內,SPE2L則位於有活性的前噬菌體Φnih1.1。這些發現均表明超抗原基因在A族鏈球菌與非A族鏈球菌之間的水平轉移相對於在A族鏈球菌與金黃色葡萄球菌之間更容易發生。
超抗原也存在於G2菌株中,例如假結核耶爾森氏菌與關節炎支原體菌。假結核耶爾森氏菌超抗原主要與人類T細胞受體Vβ3,9,13.1和13.2結合。而關節炎支原體菌超抗原(MAM)則與人類T細胞受體Vβ6與Vβ8結合。假結核耶爾森氏菌與關節炎支原體菌產生的超抗原與前面提到的傳統超抗原相比,其胺基酸序列差異極大,並且缺乏傳統超抗原共有的標籤序列,因此推測它們發揮作用的方式也將不同於前面提到的傳統超抗原,有待於進一步研究證實。
在2000年,在已經完成基因組測序工作的葡萄球菌中發現一個含有5個基因的新的基因簇。這些基因的表達產物被命名為葡萄球菌外毒素樣毒素125(SET125),在這些基因的表達產物中存在超抗原的標籤序列:K2X(2)2〔LIVF〕2X(4)2〔LIVF〕2D2X(3)2R2X(2)2L2X(5)2〔LIV〕2Y(PS00278)。並且這些蛋白與中毒性休克綜合徵毒素(TSST)的的胺基酸序列同源性很高。葡萄球菌外毒素樣毒素125(SET125)均由金黃色葡萄球菌分泌並可刺激機體產生高滴度的抗體。葡萄球菌外毒素樣毒素3(SET3)的晶體結構研究顯示其為典型的超抗原。儘管它們的功能沒有明確,但它們均位於毒力島內,提示它們可能是新的毒力因子,極有可能參與了細菌逃避機體免疫系統攻擊的機制。
病毒性
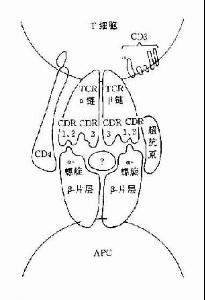
 病毒性超抗原
病毒性超抗原人們首先在小鼠乳腺病毒(MMTV)發現了超抗原成分。小鼠乳腺病毒(MMTV)是B型逆轉錄病毒。該成分早在1973年就被發現,並被命名為次要淋巴細胞刺激抗原。但直到上世紀90年代才確定其為超抗原。這個超抗原基因後來被發現位於小鼠乳腺病毒(MMTV)基因組的3’長末端重複序列(LTR)內,其序列與已知細菌超抗原的序列完全不同。其基因產物為一個45kD的Ⅱ型跨膜蛋白,在C末端擁有10214個胺基酸多變區。這個超抗原成分在小鼠乳腺病毒(MMTV)的生命周期中起非常關鍵的作用。當小鼠乳腺病毒(MMTV)剛感染腸道B細胞時這個超抗原成分可通過刺激B細胞大量增殖的方式來促進病毒的複製。這個內源性超抗原成分可以按照孟德爾遺傳法則進行遺傳,從而在胸腺內造成T淋巴細胞自我耐受,並導致T淋巴細胞數量的大量減少。當這種T淋巴細胞數量大量減少的小鼠再次遇到攜帶相同超抗原的小鼠乳腺病毒(MMTV)時就會由於缺乏可反應的T淋巴細胞而避免被感染。因而完整的免疫系統是其感染的必備條件。
1996年,Sutkowski等在EB病毒(EBV)中發現可以表達的超抗原成分。2001年,這一研究小組發現表達這一超抗原蛋白的其實是人類內源性逆轉錄病毒K218(HERVK218)病毒包膜蛋白基因的等位基因,而EB病毒可激活該基因轉錄。該基因位於人類1號染色體上CD48的第一個內含子中,其上游含有一個EB病毒(EBV)誘導的增強子。除EB病毒(EBV)之外,IFN2α也可以誘導這一基因的表達。
最近有一種HIV編碼的調節蛋白(Nef)被認為是一種超抗原。Nef可以刺激大量T淋巴細胞增殖,同時產生大量的細胞因子,如IL22,IFN2γ。並且這種大量增殖的T淋巴細胞可以促進HIV病毒的複製〔19〕。在HIV感染的過程中,Nef的作用推測如下:當感染HIV的細胞裂解後,Nef以可溶的狀態被釋放出來,結合到抗原提呈細胞的HLA2DR位點,或者與感染HIV的T淋巴細胞整合成為其細胞膜的一部分。然後再提呈給未感染的T淋巴細胞,促進T淋巴細胞大量增殖,同時釋放大量的細胞因子,例如IL22與IFN2γ。
效應
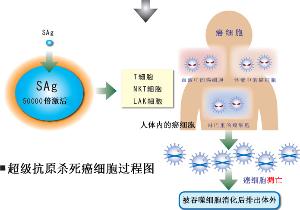
超抗原對免疫系統有很大的影響,包括急性和長期效應。急性效應包括食物中毒和中毒性休克綜合徵。長期效應包括自身免疫性疾病(例如多發性硬化)和免疫缺陷(例如HIV相關的疾病)。這些效應通常對機體是有害的,但如果合理利用的話,超抗原仍然可以對機體產生積極的作用,例如增強機體的免疫反應。利用超抗原可以快速、大量的增強免疫反應的特性在腫瘤治療中可收到不錯的療效。這一療效主要是由於超抗原可大量激活細胞毒性T淋巴細胞(CTL)與NK細胞,從而使得細胞毒性T淋巴細胞(CTL)與NK細胞參與的免疫細胞介導的殺腫瘤細胞活性相應增強。此外被超抗原大量激活的T淋巴細胞分泌的具有抗增殖作用的IFN2γ也增強了這種抗腫瘤活性。
3.1食物中毒在葡萄球菌引起的食物中毒中,SEA2SEE以及SEG2SEI作為潛在的胃腸道毒素起著很重要的作用。這種胃腸道毒素功能並不屬於傳統意義上的超抗原活性範疇。研究發現在這些外毒素N端結構域的高度可變的二硫化物環與胃腸道毒素功能關係密切。
3.2中毒性休克綜合徵(TSS)由金黃色葡萄球菌引起的中毒性休克綜合徵(TSS)可以被看作是一種由毛細血管通透性增強引起的綜合徵,包括高熱,高血壓,皮膚瘀斑以及多器官功能衰竭等等。將金黃色葡萄球菌產生的超抗原SEB注射到BALB/c小鼠體內後會出現衰竭、豎毛、腹瀉、低血壓、低血糖、體重減輕等症狀。由金黃色葡萄球菌產生的TSS也被認為是引起這一症狀的主要因素。有研究發現TNF2α和IFN2γ在中毒性休克綜合徵(TSS)中起著很重要的介導作用。
3.3鏈球菌中毒性休克綜合徵(TSST)由化膿性鏈球菌引起的鏈球菌中毒性休克綜合徵(TSST)是鏈球菌感染引起的疾病中最嚴重的一種,死亡率超過50%。臨床症狀與中毒性休克綜合徵(TSS)十分相似,只是在鏈球菌中毒性休克綜合徵(TSST)中,菌血症,肌炎以及壞死性筋膜炎經常出現。
3.4急性風濕熱(ARF)急性風濕熱(ARF)是一種感染後的後遺症,是一種可引起兒科心臟疾病的主要因素。主要發生在咽部感染化膿性鏈球菌的青少年。產生超抗原SPE2K/L的化膿性鏈球菌血清型M3、M89和產生超抗原SPE2M、SPE2M3的化膿性鏈球菌血清型M18是這種疾病的主要致病菌。
3.5川崎病(KD)川崎病(KD)是一種病因未知的常見於5歲以下兒童的多臟器血管炎,是目前兒童後天性心血管疾
病的主要病因。川崎病(KD)的臨床表現與鏈球菌中毒性休克綜合徵(TSST)、中毒性休克綜合徵(TSS)以及猩紅熱非常類似。川崎病(KD)患者常出現T淋巴細胞和單核細胞大量增殖。早期靜脈注射免疫球蛋白可收到較好的療效。種種跡象表明超抗原可能與這種疾病有關。有證據表明假結核耶爾森氏菌超抗原(YPM2A,YPM2B)可能與川崎病(KD)有關。
3.6自身免疫性疾病迄今為止,超抗原激活大量的針對特殊的自身抗原的T淋巴細胞從而導致或加重自身免疫性疾病的理論還沒有被直接證明。但有研究表明在條件合適的情況下,超抗原確實可以打破自身反應T淋巴細胞的免疫耐受或抑制狀態,從而導致自身免疫性疾病。多發性硬化(MS)是一種中樞神經系統的炎性脫髓鞘的自身免疫性疾病,其症狀主要為麻痹,語言、運動及視覺功能受損。在炎性脫髓鞘疾病的研究中,實驗過敏性腦脊髓炎(EAE)是一種常用的動物模型。比較風濕性關節炎患者與正常人的外周血與關節滑液中的Vβ14+T淋巴細胞,結果表明超抗原也可導致風濕性關節炎這一慢性自身免疫性疾病。銀屑病是一種表皮炎性疾病,主要特徵為表皮角質過度增生以及炎性滲漏。由A族鏈球菌產生的多種超抗原刺激而大量增生的T淋巴細胞在銀屑病的皮膚損傷中起重要的作用,如SPE-A,SPE2C刺激的Vβ2+T淋巴細胞及SPE2C刺激的Vβ15+T淋巴細胞。這一發現表明超抗原可能引起或惡化銀屑病。胰島素依賴性糖尿病(IDDM)是由於胰腺β細胞被自身免疫系統攻擊而導致的。研究發現自身反應性Vβ7+T淋巴細胞參與了該過程,這一發現表明超抗原可能是這種疾病的病因之一。最近從胰島素依賴性糖尿病(IDDM)患者中分離到一種內源性人類逆轉錄病毒,該病毒可以刺激Vβ7+T淋巴細胞大量增殖。因而推測這種病毒性來源的超抗原是胰島素依賴性糖尿病(IDDM)致病因素之一。
3.7免疫缺陷被超抗原大量激活的T淋巴細胞會變得無活性甚至被清除,繼而導致免疫缺陷。這種免疫缺陷可能是由於被激活的T淋巴細胞的TCR內在化引起的。
治療措施
IFN2β在1993年被美國FDA批准用於多發性硬化復發時的治療。儘管IFN2γ能夠改善多發性硬化的症狀,但其副作用如骨髓抑制、羊中發現了一種特殊的Ⅰ型干擾素(IFN)IFN2τ,最初被認為是一種孕激素,但後來發現其有抗病毒活性,而且這種抗α非常相近。與IFN2體重下降等等卻不能忽視。研究人員在病毒活性與人的IFN2β不同的是IFN2τ在高濃度的時候沒有細胞毒性,不會引起骨髓抑制、體重下降等等副作用。進一步研究發現,IFN2τ的保護性作用主要由CD4+Th2抑制細胞以及一些抑制性細胞因子如IL210,TGF2β等等共同介導。結構分析結果明,IFN2τ的N端與其副作用的減少相關。
IL24,IL210,IL213粒細胞集落刺激因子(G2CSF)以及轉移生長因子(TGF2β)是主要抗炎性細胞因子,尤其是IL210可以明顯減輕超抗原造成的損傷。IL210是Th2型細胞因子,主要功能是抑制CD4+T淋巴產生的Th1型細胞因子的功能。IL210可以通過抑制IL22的表達及其活性使得CD4+T淋巴細胞停滯在G0/G1期。研究表明,IL210對IL22表達及其活性的抑制可能是通過抑制Raf和Erk的磷酸化使得MAP激酶途徑的信號傳導受損而引起的。
腎上腺切除的小鼠和使用糖皮質激素受體拮抗劑預處理的小鼠對SEB的敏感性增強。有明確的證據表明內源性糖皮質激素可以下調T淋巴細胞的活性。而且內源性糖皮質激素可以阻止SEB誘導的D2半乳糖胺敏感小鼠的死亡。
在中毒性休克綜合徵(TSS)中常伴隨有NO的過量產生,這些NO可以抑制被超抗原大量活化的T淋巴細胞所產生的促炎性細胞因子,而且由於NO可以抑制血小板的積聚和黏附,因而可以抑制TNF2α和IFN2γ的促血栓形成作用。
這些內源性產生的糖皮質激素,IL210和NO在微生物超抗原誘發的免疫反應中起著正反兩方面的作用。一方面抑制機體的免疫系統對病原微生物的清除作用,另一方面又可以限制可導致休克的免疫系統的過度反應。因而任何針對超抗原導致的疾病的治療措施都必須考慮這些措施可以抑制正常的、起積極作用的免疫調節機制,從而可能導致嚴重的副作用。
源自細菌毒素
中國醫科大學第二臨床學院的王藍田教授告訴記者說,超抗原是上個世紀90年代才出現於近代免疫學中的一個概念。上個世紀70年代,人們在對金黃色葡萄球菌(以下簡稱金葡菌)的腸毒素(SE)引起食物中毒的研究過程中發現,SE對周圍血液中的淋巴細胞具有激活作用。隨後的研究證明,SE與一般的有絲分裂原激活淋巴細胞不同,它必須在輔助細胞或靶細胞表面上有主要組織相容性複合體Ⅱ(MHCⅡ)類分子存在時才能激活T細胞,而且只需極低濃度(1-10納克/毫升)就能激活數量很多的T細胞。1989年,瑞典科學家White等指出,SE與MHCⅡ類分子結合後,並不能激活所有的T細胞,只有那些受體上有Vβ成分的T細胞才能被激活。由於SE對T細胞的激活能力極其強大,是普通抗原的2000-50000倍,故被White等人稱為“超抗原”。
現在的研究表明,超抗原存在於很多地方,細菌、病毒、寄生蟲等均可能產生這類特殊的蛋白質。北京大學臨床腫瘤學院中試基地的免疫學博士王瑜告訴記者,超抗原主要有兩類:外源性超抗原和內源性超抗原。現在已經得到證實的外源性超抗原有金葡菌腸毒素(SEA-SEE)、化膿性鏈球菌中的某些成分等;內源性超抗原有小鼠關節炎支原體、小鼠乳腺腫瘤病毒蛋白等,它們表達在細胞表面,作為次要淋巴細胞刺激抗原(MLs)刺激T細胞增殖。SEA、SEB、SEC等是這類抗原中極具代表性、研究得較為廣泛而深入的幾種,最先受到藥品開發者的重視。
免疫特點
目前普遍認為,機體免疫機能低下是腫瘤發生的主要病因之一,而腫瘤免疫主要是細胞免疫。因此,提高機體的細胞免疫水平以殺滅腫瘤細胞已經成為腫瘤免疫治療研究的熱點,其中各種形式的腫瘤疫苗(瘤苗)的研究更為人關注。那么,超抗原是不是瘤苗?它通過怎樣的途徑發揮抗腫瘤免疫作用呢?
王瑜博士表示,儘管超抗原也是一種抗原,理論上有作為疫苗的可能,但目前還沒有將它視為瘤苗的提法。
王瑜博士認為,超抗原產生免疫作用主要是通過T細胞表面受體(TCR)的兩種識別功能激活機體特異性T細胞得以實現的。首先,超抗原與抗原提呈細胞(APC)或靶細胞表面上的MHCⅡ類分子結合為複合體,然後被TCR識別出來。在這一過程中,超抗原不需要經過APC的加工、處理,以完整的蛋白質形態直接發揮作用,而普通蛋白質抗原必須經APC消化為肽類才能刺激T細胞;其次,已與MHCⅡ類分子相結合的超抗原,只能被TCR表面上某一或某些被稱為Vβ的特定分子識別(Vβ特異性),由此,T細胞才能被激活,產生免疫應答。在這一過程中,超抗原只涉及TCRVβ抗原結合部位外側CDR2和CDR1的識別,而不涉及在識別抗原肽方面起決定作用的CDR3的TCRα的識別,故T細胞對超抗原的識別不受MHC的限制。另外,超抗原也能對MHCⅡ類分子陰性的腫瘤細胞表現出抑制作用,其免疫應答機制還不明了。
成都生物製品研究所陳廷祚教授研究員指出,正是超抗原—MHC複合體通過Vβ與TCR反應,而不是與TCR上的普通抗原結點反應的特性,使具有同一Vβ族的多克隆T細胞激活,因此超抗原作用無嚴格的抗原特異性。人類有50種不同的Vβ基因,一種超抗原會有1/50個以上的T細胞與之反應,而一種普通肽段抗原只有1/104-1/106個T細胞與之反應。所以,普通抗原對T細胞的刺激範圍很小,遠不及總數的千分之一;而超抗原具有的Vβ特異性使其對T細胞刺激範圍大,達總數的5%-10%以上,被激活的T細胞的增殖數量遠遠超過了普通抗原,並產生細胞毒性以及誘導產生大量的細胞因子,如白介素(IL)-1,-2、干擾素(IF)-γ和腫瘤壞死因子(TNF)-α,-β等。
細胞毒性
關於超抗原的細胞毒性表達是很多學者爭論的焦點。結合王藍田教授、陳廷祚研究員、王瑜博士等專家的觀點,超抗原的細胞毒性主要表現在以下三個方面:
一是激活CD8+T細胞(又稱CTL),使之對靶細胞產生殺傷作用。
二是激活CD4+T細胞後分泌大量的細胞因子,通過細胞因子的作用,激活自然殺傷(NK)細胞和單核-巨噬細胞,增強它們的吞噬和殺傷能力。
三是激活的CD4+輔助T細胞誘導產生細胞毒性,即超抗原依賴性細胞介導的細胞毒性(SDCC)。而SDCC是特異性的,只引起表達MHCⅡ類分子靶細胞(腫瘤細胞)的溶解、破壞。換句話說,超抗原-MHCⅡ複合體是被激活的T細胞的“靶結構”,被T細胞識別並導致靶細胞的溶解、破壞。
超抗原的細胞毒作用究竟是以SDCC為主,還是以其他兩種作用為主,或是其他組合方式的作用,各專家有不同看法。但總體來說,他們都認同超抗原具有明顯的抗腫瘤作用。而有關研究表明,超抗原與T細胞的激活、增殖及其產生的細胞毒性呈劑量依賴關係。所以,人們找到了利用超抗原殺傷腫瘤細胞的新方法。
抗腫瘤:超抗原研究的主要方向採用生物方法進行靶向腫瘤免疫治療的研究如火如荼,超抗原研究也正在朝著這一方向發展。中國醫科大學第二臨床學院的王藍田教授告訴記者,與國外學者將純超抗原與抗腫瘤單克隆抗體(MCAB,以下簡稱單抗)製成融合蛋白,在已有的基礎上,國內學者也正進行融合蛋白的研究,以提高金葡液或純超抗原靶向定位於特異腫瘤的免疫效應。
據州中山大學腫瘤研究中心的夏忠軍博士介紹,瑞典LUND大學細胞與分子生物學研究室的DohistenM博士率先將單抗與SEA相偶聯,以克服超抗原對MHCⅡ類分子陰性的腫瘤免疫效應低的缺陷。他與加拿大的OchiA博士均套用化學方法將腫瘤特異性抗原的單抗與SEA或SEB製成偶聯物,使它們具有結合C215抗原和SEA特異性VβT細胞的雙重功能。進一步的研究發現,這些化學偶聯物具有明顯的靶向作用,把大量活化的CD4+細胞導向了C215抗原陽性、MHCⅡ類分子陰性的結腸癌細胞,並致其破壞、溶解;而單用SEB則沒有這種靶向作用。但是,這種偶聯物與腫瘤細胞的融合力低,到達腫瘤部位的數量有限,限制了超抗原免疫作用的發揮。
為了解決融合力低的缺陷,DohistenM博士套用基因重組技術獲得了抗C215的Fab片斷與SEA融合蛋白,形成融合蛋白與腫瘤細胞單向而牢固的抗原抗體結合,從而消除了MHCⅡ類分子表達與否的影響。實驗顯示,這種融合蛋白在腫瘤局部刺激T細胞增殖和產生高濃度的細胞因子,從而減少了全身用藥的毒副作用。但目前的研究表明,大多數腫瘤無特異性抗原,故特異的單抗比較少。而人源性單抗來源存在困難,如採用鼠源性單抗,其用於人體可產生人鼠抗體反應(HAMA)。所以,融合蛋白還不是一種非常理想的套用超抗原抗腫瘤的方法。
2002年8月,浙江大學腫瘤研究所和浙江大學免疫研究所歷時5年完成的一項研究顯示,用轉基因手段可以擴大單抗導向超抗原融合蛋白(C215Fab-SEA)治療腫瘤的範圍,聯合套用白介素18和趨化因子可進一步增強其抗腫瘤的作用。研究人員表示,這些研究成果如經臨床試驗證實,將為惡性腫瘤的生物治療帶來新的希望。
當然,也有另外的研究思路:如第四軍醫大學病理教研室腫瘤抗原肽實驗室的李增山就撰文指出,給肝癌細胞轉入SEA編碼基因,使其表達這種超抗原後,能增強肝癌細胞的免疫原性,達到增強肝癌細胞誘導免疫排斥反應的目的。
產品
國外“開花”國內先“結果”
現套用於臨床的瀋陽協合集團生產的金葡液(高聚生)是世界上首次採用金葡菌代謝產生經超濾加工製成的一種超抗原抗腫瘤產品。1996年,該產品經國家新藥評審後被衛生部批准為第一類生物製品用於臨床進行腫瘤治療,並獲得良好的療效。而當前國外的相關研究或停留在動物實驗階段、或仍處於Ⅰ期臨床試驗階段。超抗原的理論是由國外學者提出來的,為什麼他們沒有開發出產品來,反而在我國搶先“開花結果”呢?
據成都生物製品研究所陳廷祚研究員和中國醫科大學第二臨床學院王藍田教授介紹,西方學者以超抗原作用機制理論的推理為依據,走的是純超抗原研究的路子。他們在證明提純的SEA和SEB具有抗表達MHCⅡ類分子腫瘤的效應後,接著用化學方法製備腫瘤特異抗原與SEA的偶聯物,後又採用基因重組技術製備超抗原——腫瘤特異抗原的融合蛋白,用於靶向抗腫瘤治療。直至1997年5月,才見到西方國家將超抗原用於Ⅰ期臨床試驗的首次報導。他們在研究中發現,用純SE進行免疫,可因殺傷具有MHCⅡ類分子的正常細胞而產生嚴重毒副作用,如發熱、低血壓及白細胞計數顯著減少等。所以,他們的研究至今沒有進入臨床套用階段。
而我國學者走的是開發以超抗原為主要有效成分、多種成分共存的細菌代謝物的除菌超濾液的路子。作為我國最早接觸超抗原理論並長期研究超抗原的著名免疫學專家、陳廷祚研究員告訴記者,我國超抗原產品的研發歷程很值得回味。“奇蹟往往產生於偶然的發現和聯想”,金葡液(高聚生)的開發可歸功於此。
免疫系統
| 系統 | 自適應與天然 | 體液與細胞 | 補體(過敏毒素) | 固有 |
| 抗原與抗體 | 抗原 (超抗原;變應原) | 半抗原 |
| 表位 (線性;構象) | |
| 抗體 (單克隆抗體; 多克隆抗體;自身抗體) | 多克隆B細胞反應 | 同種異型 | 同種型 | 遺傳型 | |
| 免疫複合物 | |
| 免疫細胞/白細胞 | 淋巴系細胞: T細胞 | B細胞 | NK細胞 |
| 髓系細胞:肥大細胞 | 嗜鹼性粒細胞 | 嗜酸性粒細胞 | 巨噬細胞 | |
| 吞噬細胞:中性粒細胞 | 巨噬細胞/網狀內皮系統 | |
| 專職型 APCs:樹突狀細胞 | 巨噬細胞 | B細胞 | |
| 免疫與耐受 | 作用:免疫性 | 自身免疫 | 變態反應 | 炎症 | 交叉反應性 |
| 無作用:耐受 (中樞耐受;外周耐受;克隆無能;克隆缺失) | 免疫缺損 | |
| 免疫遺傳學 | 體細胞超突變 | V(D)J 重組 | 免疫球蛋白類別轉換 | MHC/HLA |
| 免疫物質 | 細胞因子 | 調理素 | 溶細胞素 |
| 其他 | 診斷免疫學 |
免疫系統/ 免疫學
| 免疫系統 | 它是人體抵禦病原菌侵犯最重要的保衛系統。 |
| 系統 | |
| 抗原與抗體 | 抗原 (超抗原, 變應原) | 半抗原 表位 (線性表位, 構象表位) 抗體 (單克隆抗體, 多克隆抗體, 自身抗體) | 多克隆B細胞反應 | 同種異型 | 免疫球蛋白同種異型 | 遺傳型 | 免疫複合物 |
| 免疫細胞/白細胞 | 淋巴系細胞:T細胞 | B細胞 | NK細胞 髓系細胞:肥大細胞 | 嗜鹼性粒細胞 | 嗜酸性粒細胞 | 巨噬細胞 吞噬細胞:中性粒細胞 | 巨噬細胞 | 網狀內皮系統 抗原遞呈細胞:樹突狀細胞 | 巨噬細胞 | B細胞 |
| 免疫 與 耐受 | 作用:免疫性 | 自身免疫 | 變態反應 | 炎症 | 交叉反應性 無作用:耐受 (中樞耐受, 外周耐受, 克隆無能, 克隆缺失) | 免疫缺損 |
| 免疫遺傳學 | 體細胞超突變 | V(D)J 重組 | 免疫球蛋白類別轉換 | MHC/HLA |
| 免疫物質 | 細胞因子 | 調理素 | 溶細胞素 |
| 其他 | 診斷免疫學 |