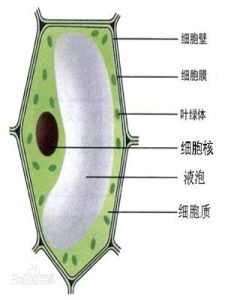
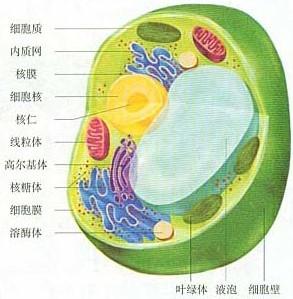
 植物細胞
植物細胞細胞是植物體結構和功能的基本單位。植物界的種類形形色色、千差萬別,但就植物體的構造來說,除了低等的類型(病毒)以外,都是由細胞構成的。單細胞的低等植物,一個細胞就代表一個個體,一切生命活動,包括新陳代謝、生長、發育和繁殖,都由一個細胞來完成;複雜的高等植物,一個個體是由無數的細胞構成的,細胞之間有了機能上的分工和形態結構上的分化,它們相互依存、彼此協作,共同保證著整個有機體正常生活的進行。
簡介
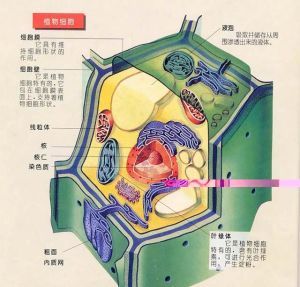 植物細胞
植物細胞組成植物體的細胞的形狀和大小是各不相同的,其不同部位的細胞,形狀和大小與它們行使的功能密切相關。大多數高等植物細胞的直徑通常約在10-200微米之間。植物細胞的大小差異很大,一般必須在顯微鏡下才能看到。在種子植物中,細胞的直徑一般在10~100μm之間,較大細胞的直徑也不過是100~200μm。也有少數植物的細胞較大,肉眼可以分辨出來,如番茄果肉、西瓜瓤的細胞,直徑可達1mm;苧麻莖中的纖維細胞,最長可達550mm;有的細胞極長,如苧麻纖維細胞可長達55cm,最長的細胞十無節乳汁管長達數米至數十米,如橡膠樹的乳汁管,但這些細胞在橫向直徑上仍是很小的。植物細胞的大小是由遺傳因素所控制,其中主要是由於細胞核的作用。
一般說來,具有同樣功能的細胞,它們的大小可由下述因素所控制:①細胞核控制能力的限制。細胞核與細胞質一起進行著細胞中的生長、發育和保持細胞的正常代謝活動,細胞核對於細胞質的影響,在數量上有一定的限制,細胞的大小就受細胞核所能控制範圍的制約。②細胞表面積的限制。生活細胞中,原生質不斷地進行著一切代謝活動,並與周圍環境(包括相鄰的細胞)不斷地進行物質交換;同時,進入細胞的物質,在內部也有一個擴散傳遞問題。細胞體積小,它的相對表面積就大,這對物質的迅速交換和轉運都比較有利。此外,細胞的大小受細胞內代謝速率的影響。在自然界中,可以看到,代謝速率快的植物細胞一般都比較小,而較大的細胞活動相對較少。例如,根、莖頂端的分生組織細胞就比儲藏的薄壁組織細胞要小得多。
植物細胞的形狀非常多樣,常見的有球形、橢圓形、多面體、紡綞形和柱狀體等。植物細胞的形狀大小儘管多種多樣,但基本結構是一樣的。例如一切活細胞都含有原生質和其外面的細胞壁。堅硬的細胞壁保護著原生質體,並且維持著細胞的一定形狀,其主要成分是纖維素。細胞壁是植物細胞獨有的,動物細胞沒有細胞壁。植物細胞還含有質體,是植物細胞生產和儲存營養物質的場所。最常見的質體是葉綠體,它是專門進行光合作用的細胞器。動物細胞中不含有質體。大多數植物細胞都含有一個或幾個液泡,液泡中充滿了液體。液泡的主要作用是轉運和儲藏養分、水分和代謝副產物或代謝廢物,即具有倉庫和中轉站的作用。除此外,植物細胞中還有線粒體、內質網、高爾基體、核糖體、圓球體、溶酶體、微管、微絲等細胞器。植物細胞中最重要的部分要數細胞核了,在光學顯微鏡下,細胞核可明顯地分為核膜、核仁和核質三部分。核是遺傳物質主要分布中心,同時也是遺傳與代謝的控制中心。
歷史
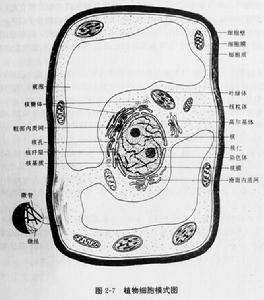 植物細胞
植物細胞人們都知道植物體是由細胞構成的,但這一結論的得出並非那么容易。340多年前,英國皇家科學學會的RobertHooke用荷蘭人Leeuwenhoek發明製作的顯微鏡觀察了一小片軟木,看到軟木是由許多蜂窩狀的小格子組成,Hooke將每一個格子稱作“細胞”。
1838~1839年,德國植物學家MatthiasSchleiden(施萊登)和動物學家施旺根據對植物和動物觀察的大量資料提出:一切動、植物有機體都由細胞組成;每個細胞是相對獨立的單位,既有自己的生命,又與其他細胞共同組成整體生命。第一次明確地指出了細胞是有機體結構的基本單位,是生命活動的基本單位,從而建立了細胞學說(celltheory)。恩格斯高度評價了細胞學說,把它與能量守恆和轉化定律、生物進化論並列為19世紀自然科學的三大發現。細胞學說為生物科學的發展奠定了堅實的基礎。
20世紀初,研製成電子顯微鏡,大大提高了顯微鏡的解析度,從而使人們看到了光學顯微鏡下所看不到的更為精細的結構。20世紀60年代,利用組織培養技術,從植物離體細胞培養成完整的植株,這一事實表明了離體的單細胞具有遺傳上的全能性。更進一步證明了細胞是生物體的結構和功能的基本單位,是生命活動的基本單位,也是生物個體發育和系統發育的基礎。
組成
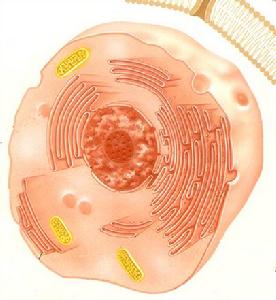 植物細胞
植物細胞細胞壁分為3個部分
1·.胞間層。
2·.初生壁。
3·次生壁。
液泡(vacuole)
幼小的植物細胞(分生組織細胞),具有許多小而分散的液泡,在電子顯微鏡下才能看到。以後隨著細胞的生長,液泡也長大,互相併合,最後在細胞中央形成一個大的中央液泡,它可占據細胞體積的90%以上。關於去掉植物細胞壁的纖維素酶和果膠酶的試劑。
植物材料
植物各個器官,如:根、莖卅、花、果實、種子及愈傷細胞和懸浮細胞等都可作為分離原生質體的材料。但是,要獲得高質量的原生質體,則須選用生長旺盛、生命力強的組織作材料。材料的生理狀況
1.細胞懸浮培養物
在建立細胞懸浮培養物之前,需提前培養愈傷組織。即取用成熟種子胚、未成熟胚、幼穗、花葯、胚芽鞘或幼葉,經無菌消毒後,在26℃黑暗條件下,在含2,4- D 2~4mg/L的 MS固體培養基上,誘導愈傷組織,每隔2~4d轉接一次。從中選出增殖較快而且呈顆粒狀的愈傷組織,或經繼代培養一次後,轉到液體培養基的100ml三角瓶中進行懸浮培養。具體方法是用鏇轉式振盪器,速度控制在80~? 120r/min,在 25±1℃下暗培養。懸浮培養初期應每隔3d繼代一次,一個半月後,吸取4~5ml懸浮細胞轉到250ml三角瓶的40rnl新鮮培養中,以後每隔7d繼代一次。通常經懸浮培養3~4月後,懸浮培養細胞的大小變得較為一致,且細胞質變得較濃時,可用作分離原生質體。
2.葉肉細胞
葉肉細胞是分離原生質體的最好的細胞材料,用葉片的薄壁組織作為材料來源,既要考慮植株的生長環境,又要考慮葉片的年齡及其生理狀態對原生質體分離的影響。取生理狀態適宜的葉片,有利於原生質體的細胞再生和細胞分裂。要獲得良好的培養? 材料,下列外界因素是考慮的重要因子:
(1)光強為3000~6000lx。
(2)溫度為20~25℃培養。
(3)相對濕度在60%~80%左右。
植物的其他器官也可用於分離原生質體,如用花粉四分體和花粉壁細胞。?
3.植物材料的預處理
對原生質體材料進行預處理能提高原生質體的分裂頻率;也可以逐步提高植物材料的滲透壓,以適應培養基中的高滲環境。這些處理包括:暗處理。預培養、低溫處理等。把豌豆的枝條取下後,在分離原生質體前,先讓材料在黑暗中的一定濕度條件下放1~2d,這樣得到的原生質體存活率高,並能繼續分裂;在羽衣甘藍葉肉組織原生質體分離和培養中,先去掉葉片的下表皮,再在誘導愈傷組織的培養基中預培養7d,然後再去壁。經預培養的葉片分離的原生質體高度液泡化,葉綠體也解體;龍膽試管苗的葉片只有用4CC低溫處理後分離得到的原生質體才能分裂。在很多情況下材料不必經過專門的預處理。
二、酶
1.酶的種類
構成植物細胞壁的三個主要成分是:①纖維素,占細胞壁乾重的25 %至50%不等;②半纖維素,平均約占細胞壁乾重的53%左右;③果膠質,一般占細胞壁的5%。分離原生質體最常用的酶有纖維素酶、半纖維素酶和果膠酶。 纖維素酶是從綠色木霉中提取的一種複合酶製劑,主要含有纖維素酶C;,作用於天然的和結晶的纖維素,具有分解天然纖維素的作用,還含纖維素酶CX,作用於定形的纖維素,可分解短鏈纖維素,另含有纖維素二糖酶、木聚糖酶、萄聚糖酶、果膠酶、脂肪酶、磷脂酶、核酸酶、溶菌酶等,總體作用是降解纖維素,得到裸露的原生質體。
果膠酶是從根霉中提取的,使細胞間的果膠質降解,把細胞從組織內分離出來。半纖維素酶製劑可以降解半纖維素為單糖或單糖衍生物。此外,還有蝸牛酶,主要用於花粉母細胞和四分體細胞。 ZA3~867纖維酶是上海植物生理研究所從野生型綠色木霉同各菌種中提取製成的,粗製品是多種酶的複合物,含有纖維素酶(包括C1、CX、B一葡萄糖苷酶等),果膠質,半纖維素酶等,分離細胞壁的效果較好。這種複合酶使用時不需加半纖維素酶和果膠酶等,就可以分離出植物原生質體。 日本產的Onozuka纖維素酶常和果膠酶結合使用,可先用果膠酶降解果膠,使分開細胞,再用纖維素酶處理降解細胞壁。即二步法降解。
植物細胞2.滲透穩定劑
植物細胞壁對細胞有良好的保護作用。去除細胞壁之後如果溶液中的滲透壓和細胞內的滲透壓不同,原生質體有可能漲破或收縮。因此在酶液、洗液和培養液中滲透壓應大致和原生質體內的相同,或者比細胞內滲透壓略大些。滲透壓大些有利於原生質體的穩定,但也有可能阻礙原生質體的分裂。
因此,在分離原生質體的酶溶液內,需加入一定量的滲透穩定劑,其作用是保持原生質體膜的穩定,避免破裂。常用的兩種系統為:①糖溶液系統:包括甘露醇、山梨醇、蔗糖和葡萄糖等,濃度約在0.40~0.80mol/L。本系統還可促進分離的原生質體再生細胞壁並繼續分裂;②鹽溶液系統:包括 KCL、MgSO4和 KH2PO4等。其優點是獲得的原生質體不受生理狀態的影響,因而材料不必在嚴格的控制條件下栽培,不受植株年齡的影響,使某些酶有較大的活性使原生質體穩定。另外,添加牛血清蛋白可減少或防止降解壁過程中對細胞器的破壞。近年來多採用在鹽溶液內進行原生質體分離,然後再用糖溶液作滲透穩定劑的培養基中培養。此外,酶溶液里還可加入適量的葡聚糖硫酸鉀,它可提高原生質體的穩定性。這種物質可使RNA酶不活化,並使離子穩定。
3.酶溶液的pH值
酶溶液的pH值對原生質體的產量和生活力影響很大。用菜豆葉片作培養材料時,發現原始pH值為5.0時,原生質體產生一得很快,但損壞較嚴重,並且培養後大量破裂。當PH值提高到6.0時,最初原生質體卻產生少,但與pH值為5.0時處理同樣時間後相比,原生質體數量顯著增加。原始pH值提高到7.0時生活的原生質體數量進一步增加,損傷的原生質體也少得多。
三、原生質體的分離
分離原生質體時,首先要讓酶製劑大量地吸附到細胞壁的纖維素上去,因此,一般先將材料分離成單細胞,然後分解細胞壁。採用將酶液減壓滲入組織,或將組織切成薄片等方法,都可增加酶液與纖維素分子接觸的機會。
酶處理目前常用的多是“一步法”,即把一定量的纖維素酶,果膠酶和半纖維素酶組成混合酶溶液,材料在其中處理一次即可得到分離的原生質體。
植物材料須按比例和酶液混合才能有效地游離原生質體,一般去表皮的葉片需酶量較少,而懸浮細胞則用酶量較大。每克材料用酶液10~30ml不等。由於不同材料的生理特點不同,在研究游離條件時,必須試驗不同滲透壓濃度的細胞,找出適宜的滲透濃度。例如,游離小麥是浮細胞的原生質體的酶液中須加入0.55mol/L甘露醇,游離水稻懸浮細胞的原生質體的酶液中只加 0.4~0.45mol/L的甘露醇,兩者差別較大。酶解處理時把滅菌的葉片或子葉等材料下表皮撕掉,將去表皮的一面朝下放入酶液中。去表皮的方法是:在無菌條件下將葉面晾乾、順葉脈輕輕撕下表皮。如果去表皮很困難,也可直接將材料切成小細條,放入酶液中。對於懸浮細胞等材料,如果細胞團的大小很不均一,在酶解前最好先用尼龍網篩過濾一次,將原細胞團去掉,留下較均勻的小細胞團時再進行酶解。
酶解處理一般地在黑暗中靜止進行,在處理過程中偶爾輕輕搖晃幾下。對於懸浮細胞,愈傷組織等難游離原生質體的材料,可置於搖床上,低速振盪以促進酶解。酶解時間幾小時至幾十小時不等、以原生質體游離下來為準。但是,時間過長對原生質體有害,所以一般不應超過24h。酶解溫度要從原生質體和酶的活性兩方面考慮。對於這幾種酶來說,最佳處理溫度在40~50℃,但這個溫度對植物細胞來說太高,所以一般都在25℃ 左右進行酶解。
若用葉片作為材料,取已展開的生活葉片,用0.53%次氨酸鈉和70%酒精進行表面滅菌,然後切成2cm見方。把 4g葉組織置於含有 200ml不加蔗糖和瓊脂的培養基500ml三角瓶中。在 4℃黑暗條件下培養16~24h,以後葉片轉入含有纖維素酶、果膠酶、無機鹽和緩衝液的混合液中,pH值為5.6,通常在酶液中使用的等滲劑為0.55~0.6mol甘露醇。然後,酶液真空滲入葉片組織。在28℃條件下,每分鐘40轉的鏇轉式轉床上培養4h後,葉片組織可完全分離。
若用懸浮培養細胞,可不經過果膠酶處理,因為懸浮細胞液主要由單細胞和小細胞團組成。取懸浮細胞放入10ml的酶液中(3%纖維素酶,14%蔗糖,pH值5.0~6.0),在25~33℃條件下酶解24h。原生質體一酶混合液用30um的尼龍網過濾,通過低速離心收集原生質體。
四、影響原生質體分離的因素
1.酶製劑活力和純度
粗製的商品酶含有核酸酶和蛋白酶等雜質,它們對原生質體的活力是有害的。因此,在使用之前須將這些酶純化,一般利用凝膠柱使酶製劑脫鹽純化。酶的活性還與pH值有關。Onoznka纖維素酶R-10和離析酶R一10的最適宜pH值分別為5~6和4~5。不過實際上酶溶液的pH值經常調節4.7~6.0之間。
2.滲透穩定劑的作用
在分離原生質體時,滲透穩定劑有保護原生質體結構及其活力的作用。糖溶液系統可使分離的原生質體能再生細胞壁,並使之能繼續分裂,其缺點是有抑制某些多糖降解酶的作用。鹽溶液系作滲透穩定劑時對材料要求較嚴格,且使原生質體穩定,使某些酶有較大活性。但是易使原生質體形成假壁,同時使分裂後細胞是分散的。
五、原生質體的淨化和活力測定
在分離的原生質體中,常常混雜有亞細胞碎片,維管束成分,未解離細胞,破碎的原生質體以及微生物等。這些混雜物的存在會對原生質體產生不良影響。此外,還需去掉酶溶液。以淨化原生質體。
 植物細胞
植物細胞原生質體純化常用過濾和離心相結合的方法,步驟大致如下:
1.將原生質體混合液經篩孔大小為40-100um的濾網過濾,以除去未消化的細胞團塊和篩管、導管等雜質,收集濾液。
2.將收集到的濾液離心,轉速以將原生質體沉澱而碎片等仍懸浮在上清液中為準,一般以500r/min離心15min。用吸管謹慎地吸會上清液。
3.將離心下來的原生質體重新懸浮在洗液中(除不含酶外,其他成分和酶液相同),再次離心,去上清液,如此重複三次。
4.用培養基清洗一次,最後用培養基將原生質調到一定密度進行培養。一般原生質體的培養密度為104~106/ml。
在原生質體培養前,常常先對原生質體的活性進行檢測。測定原生質體活性有多種方法,如觀察胞質環流、活性染料染色、螢光素雙醋酸酯(FDA)染色等。這些方法各有特點,但現在一般用的是FDA染色法。FDA本身無螢光,無極性,可透過完整的原生質體膜。一旦進入原生質體後,由於受到脂酶分解而產生有螢光的極性物質螢光素。它不能自由出太原生質體膜,因此有活力的細胞便產生榮光,而無活力的原生質體不能分解FDA,因此無螢光產生。
FDA染色測活性的方法如下: 取洗滌過的原生質體懸浮液 0.5ml,置於10×100mm的小試管中,加入 FDA溶液使其最終濃度為 0.01%,混勻、置於室溫5min後用螢光顯微鏡觀察。激發光濾光片用QB24,壓制濾光片用JB8。發綠色螢光的原生質體為有活力的,不產生榮光的為無活力的。由於葉綠素的關係,葉肉原生質發黃綠色螢光的為有活力的,發紅色螢光的為無活力的。
細胞的大小
組成植物體的細胞的形狀和大小是各不相同的,其不同部位的細胞,形狀和大小與它們行使的功能密切相關。大多數高等植物細胞的直徑通常約在10-200微米之間。植物細胞的大小差異很大,一般必須在顯微鏡下才能看到。在種子植物中,細胞的直徑一般在10~100微米之間,較大細胞的直徑也不過是100~200微米。也有少數植物的細胞較大,肉眼可以分辨出來,如番茄果肉、西瓜瓤的細胞,直徑可達1mm;苧麻莖中的纖維細胞,最長可達550mm;有的細胞極長,如苧麻纖維細胞可長達55cm,最長的細胞十無節乳汁管長達數米至數十米,如橡膠樹的乳汁管,但這些細胞在橫向直徑上仍是很小的。植物細胞的大小是由遺傳因素所控制,其中主要是由於細胞核的作用。
因素所控制
①細胞核控制能力的限制。細胞核與細胞質一起進行著細胞中的生長、發育和保持細胞的正常代謝活動,細胞核對於細胞質的影響,在數量上有一定的限制,細胞的大小就受細胞核所能控制範圍的制約。②細胞表面積的限制。生活細胞中,原生質不斷地進行著一切代謝活動,並與周圍環境(包括相鄰的細胞)不斷地進行物質交換;同時,進入細胞的物質,在內部也有一個擴散傳遞問題。細胞體積小,它的相對表面積就大,這對物質的迅速交換和轉運都比較有利。此外,細胞的大小受細胞內代謝速率的影響。在自然界中,可以看到,代謝速率快的植物細胞一般都比較小,而較大的細胞活動相對較少。例如,根、莖頂端的分生組織細胞就比儲藏的薄壁組織細胞要小得多。植物細胞的形狀非常多樣,常見的有球形、橢圓形、多面體、紡綞形和柱狀體等。植物細胞的形狀大小儘管多種多樣,但基本結構是一樣的。例如一切活細胞都含有原生質和其外面的細胞壁。堅硬的細胞壁保護著原生質體,並且維持著細胞的一定形狀,其主要成分是纖維素。細胞壁是植物細胞獨有的,動物細胞沒有細胞壁。植物細胞還含有質體,是植物細胞生產和儲存營養物質的場所。最常見的質體是葉綠體,它是專門進行光合作用的細胞器。動物細胞中不含有質體。大多數植物細胞都含有一個或幾個液泡,液泡中充滿了液體。液泡的主要作用是轉運和儲藏養分、水分和代謝副產物或代謝廢物,即具有倉庫和中轉站的作用。除此外,植物細胞中還有線粒體、內質網、高爾基體、核糖體、圓球體、溶酶體、微管、微絲等細胞器。植物細胞中最重要的部分要數細胞核了,在光學顯微鏡下,細胞核可明顯地分為核膜、核仁和核質三部分。核是遺傳物質主要分布中心,同時也是遺傳與代謝的控制中心。
細胞壁分類
1.胞間層。 2.初生壁。 3.次生壁。 3液泡(vacuole) 幼小的植物細胞(分生組織細胞),具有許多小而分散的液泡,在電子顯微鏡下才能看到。以後隨著細植物細胞
胞的生長,液泡也長大,互相併合,最後在細胞中央形成一個大的中央液泡,它可占據細胞體積的90%以上。 4關於去掉植物細胞壁的纖維素酶和果膠酶的試劑. 要分離植物原生質體,必須去掉由果膠質、纖維素和半纖維素及木質素等構成的細胞壁。在本世紀前期是採用分離機械法。即將葉肉細胞,愈傷組織和液體懸浮培養細胞置於高滲的糖溶液中,使之質壁分離,原生質體收縮成球形。然後用剪刀剪碎組織,就可切開細胞壁獲得少量完整的原生質體。不過這種方法分離的原生質體太少,而且只能適於部分組織,Cocking發明的酶解法,開創了大量分離原生質體的新技術,所以目前普遍採用酶分離法來獲得原生質體。 通常植物細胞都比較小,形狀多種多樣。細胞的形狀和大小,取決於細胞的遺傳性、所擔負的生理功能以及對環境的適應性,且伴隨著細胞的生長和分化,常相應地發生改變。
形態與類型
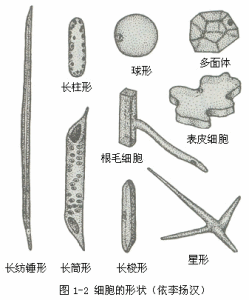 形狀
形狀單細胞藻類植物和細菌或分離的單個細胞,因細胞處於游離狀態,常為球形或近於球形。多細胞植物體中,細胞是緊密排列在一起的,由於相互擠壓,往往形成不規則的多面體。高等植物體內的細胞,具有精細的分工,其形狀極具多樣性。例如,輸送水分和養料的細胞(導管分子和篩管分子),呈長筒形,並連線成相通的“管道”,以利於物質的運輸;起支持作用的細胞(纖維),一般呈長梭形,並聚集成束,加強支持的功能;吸收水、肥的根毛細胞,向外產生一條長管狀的突起,增大了它和土壤的接觸面積(圖1-2)。這些細胞形狀的多樣性都是細胞形態與其功能相適應的結果。
一般講來,植物細胞的體積很小,多數細胞的直徑為10~100μm,肉眼難以辨別。有人認為:細胞體積的大小,主要受細胞核所能控制的範圍的制約,體積小,則表面積大,有利於細胞與外界進行物質交換。但不同種類、不同部位的細胞大小差別懸殊。
一般結構
植物細胞雖然大小不一、形狀多樣,但其結構基本相同(圖1-3)。植物細胞由原生質體(protoplast)和細胞壁
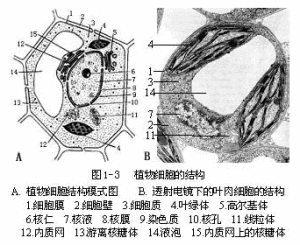 結構
結構(cellwall)兩部分組成。原生質體是由生命物質—原生質(protoplasm)分化而成的結構,是一個細胞內全部生活物質的總稱。真核植物細胞的原生質體又可分為細胞膜、細胞質和細胞核三部分;原核植物細胞的原生質體中,沒有明顯的細胞質和細胞核的分化。細胞壁是包被在原生質體外側的保護結構,動物細胞不具細胞壁。
(一)原生質體的結構
原生質體由細胞膜、細胞質和細胞核三部分組成。
1.細胞膜(cellmembrane)
細胞膜又稱質膜(plasmalemma),是位於原生質體外圍、緊貼細胞壁的膜結構。組成質膜的主要物質是蛋白質和脂類,以及少量的多糖、微量的核酸、金屬離子和水。在電子顯微鏡下,用四氧化鋨固定的細胞膜具有明顯的“暗-明-暗”三條平行的帶,其內、外兩層暗帶由蛋白質分子組成,中間一層明帶由雙層脂類分子組成,三者的厚度分別約為2.5nm、3.5nm和2.5nm,這樣的膜稱為單位膜(unitmembrane)或生物膜(biomembrane)(圖1-4)。
細胞膜有重要的生理功能,它既使細胞維持穩定代謝的胞內環境,又能調節和選擇物質進出細胞。細胞膜通過
 植物細胞
植物細胞胞飲作用(pinocytosis)、吞噬作用(phagocytosis)或胞吐作用(exocytosis)吸收、消化和外排細胞膜外、內的物質。在細胞識別、信號傳遞、纖維素合成和微纖絲的組裝等方面,質膜也發揮重要作用。
2.細胞質(cytoplasm)
真核細胞質膜以內、細胞核以外的原生質稱為細胞質。細胞質可進一步分為胞基質和細胞器。
1)胞基質(cytoplasmicmatrix)
胞基質或稱胞質溶膠(cytosol)、基本細胞質(fundamentalcytoplasm)或透明質(hyaloplasm)等,是細胞器代謝的外環境,是除細胞器和後含物以外的、呈均質、半透明、膠網狀的液態物質。
2)細胞器(organelle)
細胞器是細胞內具有特定的形態、結構和功能的亞細胞結構。活細胞的細胞質內有多種細胞器,包括具有雙層膜結構的質體、線粒體,具有單層膜結構的內質網、高爾基體、液泡、溶酶體、圓球體和微體,以及無膜結構的核糖體、微管、微絲等。
(1)質體(plastid)
質體是真核植物細胞特有的細胞器,一般有幾個至十幾個μm。根據質體的發育程度、功能和色素情況,可將其分為前質體、葉綠體、白色體和有色體。
前質體(proplastid)前質體主要存在於根端、莖端、胚和卵等的幼齡細胞內。前質體一般是無色或呈淡綠色的球狀體,直徑約為1~1.5μm,其外有雙層膜包被,內膜內褶,伸入基質中,或形成少許游離的小泡或類囊體(thylakoid),膜內基質中有少量的DNA、RNA、核糖體和可溶性蛋白等。當細胞生長分化時,前質體可轉變成其他類型的質體。
葉綠體(chloroplast)高等植物的葉綠體,主要存在於葉肉細胞內,在莖的皮層細胞、保衛細胞、花萼和未成熟的果實中也有分布,其功能是光合作用(photosynthesis),合成有機物。葉綠體呈透鏡形或橢圓形,長徑3~10μm,短徑2~4μm。細胞內葉綠體的數目、大小和形狀因植物種類和細胞類型不同而有很大差異。一個細胞內可能有十多個、幾十個、甚至幾百個葉綠體,如菠菜的葉肉細胞內,有200~400個葉綠體。在細胞內,葉綠體常分布在靠近質膜處的胞基質中。
白色體(1eucoplast)白色體來自於前質體,是不含可見色素的質體,常見於甘薯、馬鈴薯等植物的地下貯藏器官、胚以及少數植物葉的表皮細胞中。白色體近於球形,約2~5μm大小,其內部結構簡單,在基質中僅有少數不發達的片層(圖1-7)。根據白色體的功能及所貯藏的物質不同可將其分為造粉體(amyloplast)、造蛋白體(proteinoplast)和造油體(elaioplast)。造粉體是貯存澱粉的白色體,主要分布於子葉、胚乳、塊莖和塊根等貯藏組織中,遇碘呈藍紫色。儲藏蛋白質的白色體稱為造蛋白體,常見於分生組織、表皮和根冠等細胞中,遇碘呈黃色;貯存脂類物質的白色體為造油體,存在於胞基質中,遇蘇丹III呈橙紅色。
有色體(chromoplast)有色體由前質體發育而來,或由葉綠體失去葉綠素而成,是含有類胡蘿蔔素,包括黃色
 植物細胞
植物細胞的葉黃素(xanthophyll)和紅色的胡蘿蔔素(carotene)的質體。在不同細胞或同一細胞的不同時期,由於二者含量的比例不同,有色體呈紅、黃色之間的種種色彩。有色體可見於部分植物的花瓣、成熟的果實、胡蘿蔔的貯藏根以及衰老的葉片中。有色體的形狀以及內部結構多種多樣。大多數植物的花瓣以及柑桔、黃辣椒的果實中的有色體呈球狀;黃水仙花瓣、番茄果實中的有色體呈同心圓排列的膜結構;紅辣椒果實中呈管狀等。有色體賦予花、果實鮮艷的色彩,可吸引昆蟲,有利於傳粉和果實的傳播。
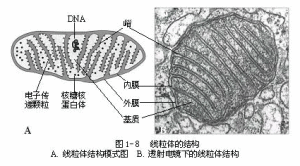
(2)線粒體(mitochondrion)
活的真核細胞一般都有線粒體,是細胞內化學能轉變成生物能的主要場所。線粒體的形態與細胞類型和生理狀況密切有關,常呈球狀、桿狀、分枝等。線粒體的大小一般為(0.5~1.0)μm×(1~2)μm,有的可達(2~4)μm×(7~14)μm。細胞的種類或細胞的生理活性不同,線粒體的數目亦有差異。一般代謝旺盛的細胞中線粒體數目多,如玉米的一個根冠細胞中,估計有100~3000個線粒體。
(3)核糖體(核糖核蛋白體,核蛋白體,ribosome)
核糖體是合成蛋白質的細胞器。生長旺盛、代謝活躍的細胞核心糖體多。核糖體主要存在於胞基質中,但在細
 植物細胞
植物細胞胞核、內質網外表面及質體和線粒體的基質中也有分布。核糖體含有大約60%的核糖核酸和40%的蛋白質。胞基質中的核糖體由兩個近於半球形、大小不等的亞基結合而成(圖1-7),直徑約為17~23nm。多個核糖體可結合到一個mRNA鏈上,形成多聚核糖體(polyribosome)。
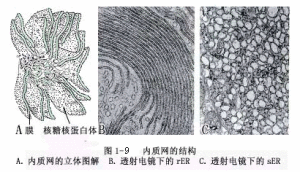
(4)內質網(endoplasmicreticulum,ER)
內質網是由單層膜圍成的扁平的囊、槽、池或管狀的、相互溝通的網狀系統(圖1-9)。ER膜可和核膜的外層膜相連,也可經過胞間連絲和相鄰細胞的ER相連,但是不與質膜相連。內質網有兩種類型:①糙面內質網(roughendoplasmicreticulum,rER),其膜的外表面附著有核糖體。②光面內質網(smoothendoplasmicreticulum,sER),其膜上無核糖體。
內質網具有製造、包裝和運輸代謝產物的作用。rER能合成蛋白質及一些脂類,並將其運到sER,再由sER形成小泡,運到高爾基體,然後分泌到細胞外(圖1-10)。sER還可合成脂類、糖元等。ER特化或分離出的小泡可形成液泡、高爾基體、圓球體及微體等細胞器。有人認為質體、線粒體和細胞核等的外層膜也與ER有關。此外,內質網還有“分室”作用,將許多細胞器相對分隔開,便於各自的代謝順利進行。
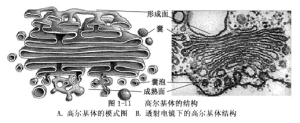
(5)高爾基體(golgibody,dictyosome)
高爾基體是由一疊(一般l~8個)扁平、平滑、近圓形的單位膜圍成的、直徑約1~3μm的多囊結構(cisterna,或稱小池、瀦泡、槽庫),在生長和分泌旺盛的細胞內特別多(圖1-11)。
高爾基體是動態的結構,有極性。凸出的一面為形成面(近核面),凹入的一面是成熟面(近質膜面)。高爾基體邊緣膨大且具穿孔,或分枝成許多小管,周圍有很多由扁囊邊緣“出芽”脫落的囊泡,它們可轉移到胞基質中,和其他來源的某些小泡融合,也可和質膜結合(圖1-10)。
高爾基體的主要功能是合成多糖,參與細胞壁的形成,有時也參與運輸ER合成的物質。
(6)液泡(vacuole)
液泡是由具選擇通透性的液泡膜(tonoplast)和細胞液組成的細胞器。在不同類型或不同發育時期的細胞中,液泡的數目、大小、形狀、成分都有差別。幼期的細胞,如頂端分生組織細胞內,液泡小、數量多,散布於胞基質中。隨著細胞的長大和分化,小液泡增大,並逐漸合併為少數幾個甚至一個位於細胞中央的大液泡,將其他的原生質都擠成一薄層,包在液泡的外圍而緊貼著細胞壁,有利於新陳代謝和細胞的生長(圖1-12)。
液泡的主要生理功能包括:①調節細胞水勢和維持細胞的膨壓,液泡吸水膨脹,是植物體保持挺立狀態的根本因素;若液泡失水,植株就萎蔫,影響植物生長。②參與細胞內物質的積累、儲藏與轉化,控制液泡內的K+、Na+、Ca2+、Cl-、以及磷酸鹽、檸檬酸、蘋果酸和多種胺基酸等物質的輸入和輸出,對細胞代謝起著調節和穩定的作用。液泡還儲藏糖、脂肪、蛋白質等。③防禦作用,許多植物液泡中還有幾丁質酶,它能分解破壞真菌的細胞壁,當植物體被真菌侵害時,幾丁質酶合成增加,對病原體有殺傷作用。
(7)溶酶體(lysosome)和圓球體(spherosome)
溶酶體是由單層膜構成的能分解蛋白質、核酸、多糖等生物大分子的細胞器(圖1-13)。溶酶體主要來自於高爾基體和內質網分離的小泡。它的形狀和大小差異較大,一般為球形,直徑0.2~0.8μm。溶酶體除含特有的酸性磷酸酶外,還有許多(已知的有60多種)其他的水解酶。
溶酶體具有異體吞噬(heterophagy)、自體吞噬(autophagy)和自溶作用(autolysis)的功能。溶酶體分解從外界進入到細胞內的物質,稱為異體吞噬,例如,有些大分子物質、病毒、細菌,經胞飲或吞噬作用被細胞攝入後,和溶酶體融合而被消化。溶酶體消化細胞自身的局部細胞質或細胞器稱為自體吞噬。自溶作用是指在植物發育進程中,有一些細胞會逐步正常地死亡,這是在基因控制下,溶酶體膜破裂,將其中的水解酶釋放到細胞內,而引起的細胞自身溶解死亡。自溶作用實際上是一種細胞的程式性死亡(programmedcelldeath),有利於個體發育。
圓球體是由單層膜圍成的細胞器。圓球體除含水解酶外,還有脂肪酶,能積累脂肪。圓球體普遍存在於植物細胞中,與脂肪的代謝有關。
(8)微體(microbody)
微體是單層膜包圍的呈球狀或啞鈴形的細胞器,其直徑約0.2~1.5μm,普遍存在於植物細胞中。植物體內的微體有兩種類型:一類是含過氧化氫酶的過氧化物酶體(peroxisome)(圖1-14),另一類是含乙醇酸氧化酶的乙醛酸循環體(glyoxysome)。
過氧化物酶體常和葉綠體、線粒體聚集在一起,將光呼吸(photorespiration)的底物乙醇酸氧化為乙醛酸。
乙醛酸循環體除存在於油料植物種子的胚乳或子葉細胞外,在大麥、小麥種子的糊粉層以及玉米的盾片細胞內也有存在。在種子萌發過程中,乙醛酸循環體將儲存在子葉和胚乳中的脂類物質逐步轉化為糖類,滿足種子萌發之需。
(9)細胞骨架(cytoskeleton)
細胞骨架是真核細胞的細胞質內普遍存在的蛋白質纖維網架系統,包括微絲(microfilament,MF)系統、微管(microtubule,MT)系統和中間纖維(intermediatefilament,IF)系統。這三類骨架系統分別由不同蛋白質分子以不同方式裝配成不同直徑的纖維,然後靠許多連線蛋白相互連線形成既有柔韌性又有剛性的三維網架,把分散在細胞質中的細胞器及各種膜結構組織起來,固定在一定的位置,使細胞內新陳代謝有條不紊地進行(圖1-15)。細胞骨架系統還是細胞內能量轉換的主要場所,微絲系統、微管系統和相關的馬達蛋白(motorprotein)相互作用,將化學能直接轉換為機械能,驅使細胞及細胞內組分的
 植物細胞
植物細胞運動。
微絲主要由肌動蛋白(actin)組成直徑6~8nm的細絲(圖1-16)。肌動蛋白分子近球形,分子量為42kDa,它既可以以溶解的單體G-肌動蛋白(globularactin)存在,又可聚合成纖維狀的F-肌動蛋白(fibrousactin)。它們的聚合和解聚與細胞生理狀態、細胞內陽離子及ATP等條件有關。微絲參與細胞質流動、染色體運動、葉綠體運動、胞質分裂、物質運輸以及與膜有關的一些重要生命活動如內吞作用和外排作用等。
微管主要由微管蛋白(tubulin)和少量微管結合蛋白組成(圖1-16)。
在植物細胞內,微管的主要功能有:①支持和維持細胞的一定形狀,例如被子植物的精子細胞呈紡錘形,與細胞質中的微管和細胞長軸相一致地排列有關。用秋水仙素等藥劑將微管破壞,精子細胞就變成球形。②參與構成有絲分裂和減數分裂時出現的紡錘絲。③調節細胞壁的生長和分化。④影響胞內物質的運輸和胞質運動。⑤構成低等植物的鞭毛,調節整個細胞的運動。
中間纖維又稱為中間絲或中等纖維,直徑約為10nm,由於其平均直徑在微管和微絲之間,故稱為中間纖維。中間纖維是由長的、桿狀的蛋白質裝配的一種堅韌、耐久的蛋白質纖維。一般認為,中間纖維在維持細胞形態、調節胞內顆粒運動、控制細胞器和細胞核定位等方面有重要作用。
3.細胞核(nucleus)
細胞核是真核細胞遺傳與代謝的控制中心。生活的細胞一般都有一個近於球形的細胞核,因其折光率與細胞質不同,在光學顯微鏡下容易辨別。
細胞核的大小、形狀以及在胞內所處的位置,與細胞的年齡、功能以及生理狀況有關,而且也受某些外界因素的影響。在胚、根端和莖端的分生組織細胞中,細胞核所占的體積通常較大,約占整個細胞體積的1/3~1/2,直徑約為7~10μm。在薄壁組織和其他許多分化成熟的細胞內,細胞核的直徑一般為35~50μm,但其相對體積卻比年幼細胞小。不過,有少數植物的細胞核很大,如蘇鐵的卵細胞核,直徑可達1mm,肉眼可見;而最小的細胞核,如某些真菌的細胞核,其直徑不超過0.5
 植物細胞
植物細胞μm。細胞核的形狀,雖然一般是近於球形的,但也有許多不同形狀,如禾本科植物的保衛細胞,細胞核呈啞鈴形;在一些花粉的營養細胞和感染黑穗病的玉米葉片的上表皮細胞中,細胞核形成許多不規則的裂瓣。細胞核在細胞內所處的位置,因細胞的生長和分化狀況而改變。在幼期細胞中,細胞核常位於細胞中央,細胞生長時,由於液泡的增大和合併成中央大液泡,細胞核常被擠至細胞的一側。
一般植物細胞僅具一個細胞核,但花葯絨氈層細胞、乳汁管以及許多真菌和藻類植物的細胞中常含有兩個或更多的細胞核。分化成熟的篩管分子,其細胞核解體,因而不具細胞核。一般說來沒有核的細胞不能長期正常生活。
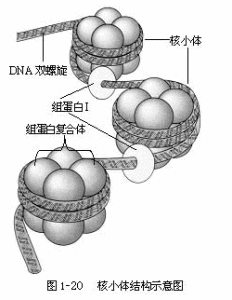
細胞核的結構,隨著細胞周期的改變而相應地變化。間期的細胞核可分為核被膜(nuclearmembrane)、核仁(nucleolus)和核質(nucleoplasm)三部分(圖1-17)。
間期細胞核的主要功能是貯存和複製DNA;合成和向細胞質轉運RNA。DNA在間期一定階段(S期即DNA合成期)以半保留方式複製,其含量倍增,為子細胞準備一整套和母細胞相同的遺傳物質,通過有絲分裂,分配給子細胞。由此可進一步理解細胞核是細胞的控制中心。rRNA在核仁中合成,並參與核蛋白體亞單位的形成,mRNA和tRNA是以染色質中的DNA為模板合成的,並經核孔轉移到細胞質中,參與細胞質中的蛋白質合成。
3.核質(nucleoplasm)
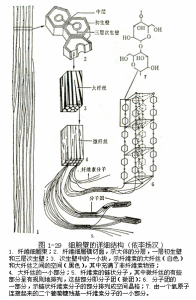
(二)細胞壁(cellwall)
細胞壁是原生質體生命活動過程中向外分泌的多種物質複合而成的結構,為植物細胞所特有。細胞壁支撐和保護植物細胞,與維持原生質體的膨壓和植物組織的吸收、蒸騰、運輸和分泌等方面的生理活動有很大的關係。多細
 植物細胞
植物細胞胞植物的細胞壁有支持和鞏固植物體作用,特別是那些特化為機械組織的細胞的細胞壁。
1.細胞壁的結構分層
在細胞發育生長過程中,因其所形成的壁物質在種類、數量、比例以及物理組成上的時空差異,細胞壁結構表現出分層現象(lamellation),在顯微鏡下可區分為胞間層、初生壁和次生壁(圖1-21)。一般認為,分化完成後仍保持有生活的原生質體的細胞,不具次生壁。
(1)胞間層(intercellularlayer)或中層(middlelamella)胞間層是新的子細胞形成時產生的、以果膠為主的細胞壁結構。果膠是一類多糖物質,膠粘而柔軟,能將相鄰的細胞粘在一起,果膠物質的可塑性能緩衝細胞間的擠壓又不致阻礙初生壁生長和擴大表面積。胞間層在一些酶(如果膠酶)或酸、鹼的作用下會發生分解,使相鄰細胞失去
 植物細胞
植物細胞連線,而彼此分離。西瓜、番茄等果實成熟時,部分果肉細胞彼此分離就是這個原因。
(2)初生壁(primarywall)初生壁是細胞生長、體積增大時所形成的壁層,分別位於胞間層兩側。構成初生壁的主要物質有纖維素、半纖維素和果膠物質等。初生壁一般都很薄,厚度約1~3μm,不過也有均勻或局部增厚的,前者如柿胚乳細胞,後者如厚角組織細胞。然而,增厚的初生壁是可逆的,即在一定情況下厚的初生壁又可以變薄,例如柿子胚乳細胞的壁物質在種子萌發時,分解轉化,厚壁又變薄;厚角組織在轉變成分生組織時,其增厚的壁也能變薄。
(3)次生壁(secondarywall)次生壁是某些細胞在生理上分化成熟、體積停止增大、原生質體走向消失的過程中在初生壁內側產生的壁層,一般比初生壁厚得多。例如,各種纖維細胞、導管、管胞、石細胞等。構成次生壁的物質以纖維素為主,但還有木質素、角質素、礦質等物質。
根據次生壁中纖維素微纖絲的排列方向,可將其進一步地分為內、中、外三層,微纖絲在各層以不同的取向規則地排列,使細胞壁厚度增加,剛性增強,但缺乏延伸性(圖1-24)。
2.細胞壁的生長
3.紋孔和胞間連絲
1)紋孔(pit)
初生壁的厚度往往是不均勻的,常有一些凹陷區域,其內有許多胞間連絲通過,這個區域稱為初生紋孔場(pri
 植物細胞
植物細胞marypitfield)(圖1-25)。次生壁形成時,有的初生紋孔場所在的位置不形成次生壁,在細胞壁上,只有中層和初生壁隔開,而無次生壁的較薄區域稱為紋孔。相鄰兩細胞的紋孔通常成對存在,合稱紋孔對(pitpair)。紋孔對中的胞間層和兩邊的初生壁,合稱紋孔膜(pitmembrane)。紋孔的腔,稱為紋孔腔(pitcavity)(圖1-
2)胞間連絲(plasmodesma)
胞間連絲是連線相鄰兩個植物細胞間的細胞質細絲,是細胞間物質、信息和能量交流的直接通道,行使水分、營養物質、小的信號分子以及大分子的胞間運輸功能。胞間連絲一般都很細,直徑小於0.1μm,經銀、汞等重金屬特殊處理、使它擴大,可在光學顯微鏡下分辨出來(圖1-27)。
高等植物的生活細胞之間,一般都有胞間連絲相連,其數量、分布位置不一。一個分生組織細胞,可能有1000~10000條胞間連絲。細胞的不同側面,胞間連絲的數量不一,篩管分子和某些傳遞細胞之間,胞間連絲特別多。
4.細胞壁的化學組成
5.細胞壁在植物細胞生命活動中的作用
(三)植物細胞的後含物
植物細胞生活過程中,不僅為生長、分化供應營養物質和能量,同時也產生貯藏物質、代謝廢物或植物的次生物質等,這些非原生質的物質稱為後含物(ergasticsubstance)。
1.儲藏物質
葉綠體光合作用的同化物除運往植物體各部位供新陳代謝消耗外,一部分可暫時儲存起來,需要時經分解再利用。常見的儲藏物質有澱粉、脂類(油和脂肪)和蛋白質。
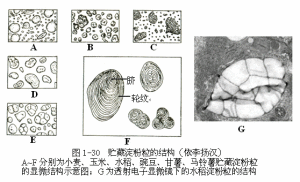
1)澱粉(starch)
澱粉是植物細胞的質體中形成的最普遍的儲藏物質,儲藏澱粉常呈顆粒狀,稱為澱粉粒(starchgrain)(圖1-30),主要分布於儲藏組織的細胞中。例如,禾本科作物籽粒的胚乳細胞,甘薯、馬鈴薯、木薯等薯類作物薯塊的儲藏薄壁組織細胞,都有大量的澱粉粒存在。澱粉遇碘呈藍紫色,可根據這種特性反應,檢驗其存在與否。
不同植物的澱粉粒的大小、形狀和臍所在的位置,都各有其特點,可作為商品檢驗、生藥鑑定上的依據之一。
2)蛋白質(protein)
儲藏蛋白質以多種形式存在於細胞質中。例如,在禾本科植物籽粒的糊粉層中,儲藏的蛋白質粒稱糊粉粒(aleuronegrain),形成於液泡之中。蓖麻、油桐胚乳細胞的糊粉粒內,除了無定形的蛋白質外,還含有蛋白質的擬晶體和非蛋白質的球狀體(圖1-31),花生子葉細胞內,也可見到這樣的糊粉粒,但量較少。在馬鈴薯塊莖外圍的儲藏薄壁組織細胞中,蛋白質的擬晶體和澱粉粒共存於同一細胞內。
糊粉粒還含有水解酶。因此,除了是一種蛋白質的儲藏結構外,還可以看作是一種被隔離的含有水解酶的溶酶體。儲藏蛋白質常呈固體狀態,與原生質體中有生命而呈膠體狀態的蛋白質性質不同。儲藏蛋白質遇碘呈黃色。
3)油(oil)和脂肪(fat)
在植物細胞中,油和脂肪是由造油體合成的重要的儲藏物質,二者可能少量地存在於每個細胞內,呈小油滴或固體狀,大量地存在於一些油料植物種子或果實內,子葉、花粉等細胞內也可見到。油和脂肪遇蘇丹III或蘇丹IV呈橙紅色。
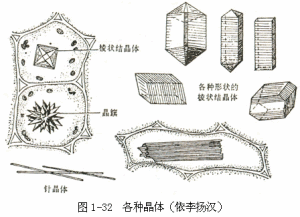
2.晶體(crystal)和矽質小體(silicabody)
在植物細胞中的結晶形成於液泡內,常為草酸鈣結晶,呈各種形狀(圖1-32),如印度橡皮樹葉的上表皮細胞中的結晶呈鍾乳體等,禾本科、莎草科、棕櫚科植物莖、葉的表皮細胞內所含的二氧化矽晶體,稱為矽質小體。
培養
(1)光強為3000~6000lx。(2)溫度為20~25℃培養。(3)相對濕度在60%~80%左右。植物的其他器官也可用於分離原生質體,如用花粉四分體和花粉壁細胞。 3.植物材料的預處理對原生質體材料進行預處理能提高原生質體的分裂頻率;也可以逐步提高植物材料的滲透壓,以適應植物細胞培養基中的高滲環境。這些處理包括:暗處理。預培養、低溫處理等。把豌豆的枝條取下後,在分離原生質體前,先讓材料在黑暗中的一定濕度條件下放1~2d,這樣得到的原生質體存活率高,並能繼續分裂;在羽衣甘藍葉肉組織原生質體分離和培養中,先去掉葉片的下表皮,再在誘導愈傷組織的培養基中預培養7d,然後再去壁。經預培養的葉片分離的原生質體高度液泡化,葉綠體也解體;龍膽試管苗的葉片只有用4CC低溫處理後分離得到的原生質體才能分裂。在很多情況下材料不必經過專門的預處理。
酶的種類
構成植物細胞壁的成分①纖維素,占細胞壁乾重的25%至50%不等;②半纖維素,平均約占細胞壁乾重的53%左右;③果膠質,一般占細胞壁的5%。分離原生質體最常用的酶有纖維素酶、半纖維素酶和果膠酶。纖維素酶是從綠色木霉中提取的一種複合酶製劑,主要含有纖維素酶C;,作用於天然的和結晶的纖維素,具有分解天然纖維素的作用,還含纖維素酶CX,作用於定形的纖維素,可分解短鏈纖維素,另含有纖維素二糖酶、木聚糖酶、萄聚糖酶、果膠酶、脂肪酶、磷脂酶、核酸酶、溶菌酶等,總體作用是降解纖維素,得到裸露的原生質體。果膠酶是從根霉中提取的,使細胞間的果膠質降解,把細胞從組織內分離出來。半纖維素酶製劑可以降解半纖維素為單糖或單糖衍生物。此外,還有蝸牛酶,主要用於花粉母細胞和四分體細胞。ZA3~867纖維酶是上海植物生理研究所從野生型綠色木霉同各菌種中提取製成的,粗製品是多種酶的複合物,含有纖維素酶(包括C1、CX、B一葡萄糖苷酶等),果膠質,半纖維素酶等,分離細胞壁的效果較好。這種複合酶使用時不需加半纖維素酶和果膠酶等,就可以分離出植物原生質體。日本產的Onozuka纖維素酶常和果膠酶結合使用,可先用果膠酶降解果膠,使分開細胞,再用纖維素酶處理降解細胞壁。即二步法降解。
滲透穩定劑
植物細胞壁對細胞有良好的保護作用。去除細胞壁之後如果溶液中的滲透壓和細胞內的滲透壓不同,原生質體有可能漲破或收縮。因此在酶液、洗液和培養液中滲透壓應大致和原生質體內的相同,或者比細胞內滲透壓略大些。滲透壓大些有利於原生質體的穩定,但也有可能阻礙原生質體的分裂。因此,在分離原生質體的酶溶液內,需加入一定量的滲透穩定劑,其作用是保持原生質體膜的穩定,避免植物細胞
破裂。常用的兩種系統為:①糖溶液系統:包括甘露醇、山梨醇、蔗糖和葡萄糖等,濃度約在0.40~0.80mol/L。本系統還可促進分離的原生質體再生細胞壁並繼續分裂;②鹽溶液系統:包括KCL、MgSO4和KH2PO4等。其優點是獲得的原生質體不受生理狀態的影響,因而材料不必在嚴格的控制條件下栽培,不受植株年齡的影響,使某些酶有較大的活性使原生質體穩定。另外,添加牛血清蛋白可減少或防止降解壁過程中對細胞器的破壞。近年來多採用在鹽溶液內進行原生質體分離,然後再用糖溶液作滲透穩定劑的培養基中培養。此外,酶溶液里還可加入適量的葡聚糖硫酸鉀,它可提高原生質體的穩定性。這種物質可使RNA酶不活化,並使離子穩定。酶溶液的pH值[1]酶溶液的pH值對原生質體的產量和生活力影響很大。用菜豆葉片作培養材料時,發現原始pH值為5.0時,原生質體產生一得很快,但損壞較嚴重,並且培養後大量破裂。當PH值提高到6.0時,最初原生質體卻產生少,但與pH值為5.0時處理同樣時間後相比,原生質體數量顯著增加。原始pH值提高到7.0時生活的原生質體數量進一步增加,損傷的原生質體也少得多。
原生質體的分離
分離原生質體時,首先要讓酶製劑大量地吸附到細胞壁的纖維素上去,因此,一般先將材料分離成單細胞,然後分解細胞壁。採用將酶液減壓滲入組織,或將組織切成薄片等方法,都可增加酶液與纖維素分子接觸的機會。酶處理目前常用的多是“一步法”,即把一定量的纖維素酶,果膠酶和半纖維素酶組成混合酶溶液,材料在其中處理一次即可得到分離的原生質體。植物材料須按比例和酶液混合才能有效地游離原生質體,一般去表皮的葉片需酶量較少,而懸浮細胞則用酶量較大。每克材料用酶液10~30ml不等。由於不同材料的生理特點不同,在研究游離條件時,必須試驗不同滲透壓濃度的細胞,找出適宜的滲透濃度。酶解處理時把滅菌的葉片或子葉等材料下表皮撕掉,將去表皮的一面朝下放入酶液中。去表皮的方法是:在無菌條件下將葉面晾乾、順葉脈輕輕撕下表皮。如果去表皮很困難,也可直接將材料切成小細條,放入酶液中。對於懸浮細胞等材料,如果細胞團的大小很不均一,在酶解前最好先用尼龍網篩過濾一次,將原細胞團去掉,留下較均勻的小細胞團時再進行酶解。
酶的處理方式
酶解處理一般地在黑暗中靜止進行,在處理過程中偶爾輕輕搖晃幾下。對於懸浮細胞,愈傷組織等難游離原生質體的材料,可置於搖床上,低速振盪以促進酶解。酶解時間幾小時至幾十小時不等、以原生質體游離下來為準。但是,時間過長對原生質體有害,所以一般不應超過24h。酶解溫度要從原生質體和酶的活性兩方面考慮。對於這幾種酶來說,最佳處理溫度在40~50℃,但這個溫度對植物細胞來說太高,所以一般都在25℃左右進行酶解。若用葉片作為材料,取已展開的生活葉片,用0.53%次氨酸鈉和70%酒精進行表面滅菌,然後切成2cm見方。把4g葉組織置於含有200ml不加蔗糖和瓊脂的培養基500ml三角瓶中。在4℃黑暗條件下培養16~24h,以後葉片轉入含有纖維素酶、果膠酶、無機鹽和緩衝液的混合液中,pH值為5.6,通常在酶液中使用的等滲劑為0.55~0.6mol甘露醇。然後,酶液真空滲入葉片組織。在28℃條件下,每分鐘40轉的鏇轉式轉床上培養4h後,葉片組織可完全分離。若用懸浮培養細胞,可不經過果膠酶處理,因為懸浮細胞液主要由單細胞和小細胞團組成。取懸浮細胞放入10ml的酶液中(3%纖維素酶,14%蔗糖,pH值5.0~6.0),在25~33℃條件下酶解24h。原生質體一酶混合液用30um的尼龍網過濾,通過低速離心收集原生質體。
原生質體分離因素
1.酶製劑活力和純度粗製的商品酶含有核酸酶和蛋白酶等雜質,它們對原生質體的活力是有害的。因此,在使用之前須將這些酶純化,一般利用凝膠柱使酶製劑脫鹽純化。酶的活性還與pH值有關。Onoznka纖維素酶R-10和離析酶R一10的最適宜pH值分別為5~6和4~5。不過實際上酶溶液的pH值經常調節4.7~6.0之間。2.滲透穩定劑的作用在分離原生質體時,滲透穩定劑有保護原生質體結構及其活力的作用。糖溶液系統可使分離的原生質體能再生細胞壁,並使之能繼續分裂,其缺點是有抑制某些多糖降解酶的作用。鹽溶液系作滲透穩定劑時對材料要求較嚴格,且使原生質體穩定,使某些酶有較大活性。但是易使原生質體形成假壁,同時使分裂後細胞是分散的。
原生質體的淨化和活力測定
在分離的原生質體中,常常混雜有亞細胞碎片,維管束成分,未解離細胞,破碎的原生質體以及微生物等。這些混雜物的存在會對原生質體產生不良影響。此外,還需去掉酶溶液。以淨化原生質體。
步驟 1.將原生質體混合液經篩孔大小為40-100um的濾網過濾,以除去未消化的細胞團塊和篩管、導管等雜質,收集濾液。 2.將收集到的濾液離心,轉速以將原生質體沉澱而碎片等仍懸浮在上清液中為準,一般以500r/min離心15min。用吸管謹慎地吸會上清液。 3.將離心下來的原生質體重新懸浮在洗液中(除不含酶外,其他成分和酶液相同),再次離心,去上清液,如此重複三次。 4.用培養基清洗一次,最後用培養基將原生質調到一定密度進行培養。一般原生質體的培養密度為104~106/ml。在原生質體培養前,常常先對原生質體的活性進行檢測。測定原生質體活性有多種方法,如觀察胞質環流、活性染料染色、螢光素雙醋酸酯(FDA)染色等。這些方法各有特點,但現在一般用的是FDA染色法。FDA本身無螢光,無極性,可透過完整的原生質體膜。一旦進入原生質體後,由於受到脂酶分解而產生有螢光的極性物質螢光素。它不能自由出太原生質體膜,因此有活力的細胞便產生榮光,而無活力的原生質體不能分解FDA,因此無螢光產生。FDA染色測活性的方法如下:取洗滌過的原生質體懸浮液0.5ml,置於10×100mm的小試管中,加入FDA溶液使其最終濃度為0.01%,混勻、置於室溫5min後用螢光顯微鏡觀察。激發光濾光片用QB24,壓制濾光片用JB8。發綠色螢光的原生質體為有活力的,不產生榮光的為無活力的。由於葉綠素的關係,葉肉原生質發黃綠色螢光的為有活力的,發紅色螢光的為無活力的。